Przeczytaj
Właściwości sulfanu i oksydanu
Sulfan powszechnie znany jako siarkowodór, jest to związek o wzorze sumarycznym . W temperaturze pokojowej jest to silnie toksyczny gaz o charakterystycznym zapachu zgniłych jaj. Dobrze rozpuszcza się w wodzie, a jego wodny roztwór zwany jest kwasem siarkowodorowym. Oksydan powszechnie znany jako tlenek wodoru lub woda jest to związek o wzorze sumarycznym . W temperaturze pokojowej występuje jako bezbarwna, bezwonna ciecz. Jest to jedna z najbardziej rozpowszechnionych na świecie substancji odpowiadająca za prawidłowe funkcjonowanie organizmów żywych i ekosystemów.
Choć związki te wykazują analogiczną budowę, to ich właściwości znacząco różnią się od siebie, co wiąże się przede wszystkim z odmiennymi właściwościami atomów centralnych, takimi jak rozmiar atomu czy elektroujemność. W szczególności ta druga właściwość znacząco wpływa na właściwości tych związków, takie jak temperatura topnienia i wrzenia.
Poniższa tabela przedstawia porównanie pewnych wielkości fizycznych oksydanu i sulfanu.
Wzór | ||
|---|---|---|
Kąt pomiędzy wiązaniami | ||
Entalpia tworzenia | ||
Temperatura topnienia | ||
Temperatura wrzenia |
Indeks dolny Tabela Porównanie przykładowych wielkości fizycznych dla oksydanu i sulfanu. Indeks dolny koniecTabela Porównanie przykładowych wielkości fizycznych dla oksydanu i sulfanu.
Indeks dolny Źródło: Bielański A. Podstawy chemii nieorganicznej, tom , Warszawa, Indeks dolny koniecŹródło: Bielański A. Podstawy chemii nieorganicznej, tom , Warszawa,
Budowa cząsteczki
Wodorki pierwiastków 16 grupy charakteryzują się kątową budową cząsteczki, a atom centralny przyjmuje hybrydyzację . Największy kąt pomiędzy wiązaniami wykazuje cząsteczka oksydanu (). W przypadku sulfanu kąt ten jest bliski . Różnica w budowie wynika z różnicy w rozmiarach atomów centralnych, co przekłada się na różnice w oddziaływaniach pomiędzy atomami wodoru i pomiędzy wolnymi parami elektronowymi. Atom siarki jest większy od atomu tlenu, a to powoduje, że w cząsteczce sulfanu atomy wodoru są bardziej oddalone od siebie niż w cząsteczce oksydanu, przez co słabiej się od siebie odpychają. Dodatkowo, siła odpychania się od siebie wolnych par elektronowych słabnie w mniejszym stopniu niż siła odpychania się od siebie atomów wodoru wraz ze wzrostem odległości, stąd w obydwóch cząsteczkach kąt między wiązaniami atom centralny – wodór jest mniejszy niż w przypadku geometrii tetraedrycznej (), a dodatkowo kąt pomiędzy wiązaniami w cząsteczce sulfanu jest mniejszy niż w cząsteczce oksydanu.

Polaryzacja wiązania w cząsteczce oksydanu wynika z wysokiej wartości elektroujemności tlenu. Silna polaryzacja tego wiązania powoduje, że w odróżnieniu od sulfanu pomiędzy cząsteczkami oksydanu mogą występować wiązania wodorowewiązania wodorowe.
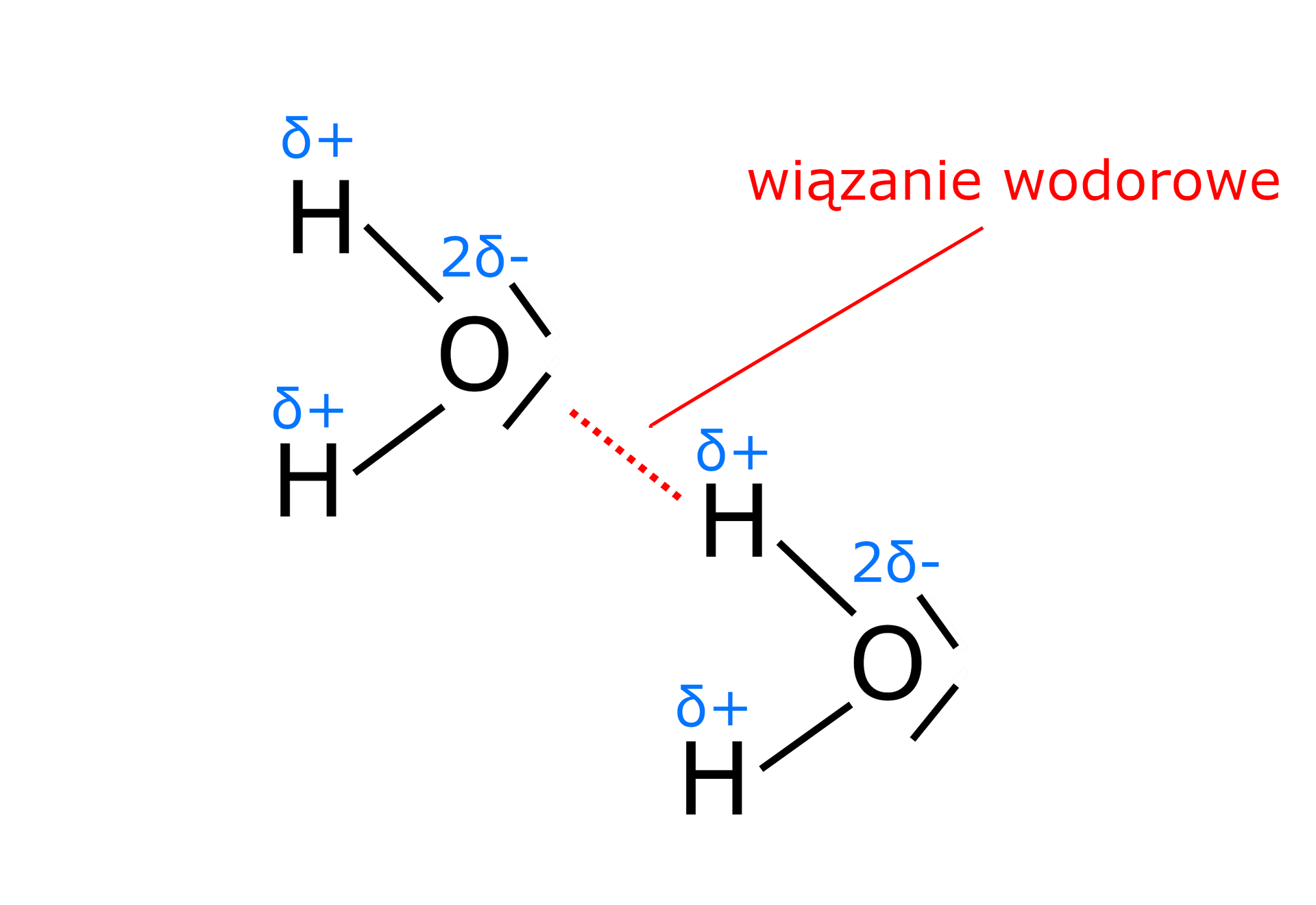
Zdolność do tworzenia wiązania wodorowego znacząco wpływa na właściwości fizyczne związków chemicznych. Dzięki wiązaniom wodorowym lód uzyskuje specyficzną luźną strukturę. W strukturze lodu każdy atom tlenu tworzy cztery wiązania wodorowe. W dwóch z nich udział biorą „własne” atomy wodoru danej cząsteczki, w dwu atomy wodoru pochodzące od innych cząsteczek. W czasie ogrzewania lodu wzmagają się drgania cieplne i przy temperaturze liczba zerwanych wiązań jest tak duża, że lód zmienia się w ciecz. Ponadto obecność licznych wiązań wodorowych między cząsteczkami oksydanu w stanie ciekłym, a także duża polarnośćpolarność cząsteczek oksydanu i związane z nią oddziaływania elektrostatyczne znacznie wpływają na temperaturę wrzenia.
Jak już wspomniano pomiędzy cząsteczkami nie tworzą się wiązania wodorowe. Występują między nimi jednak siły (oddziaływania) międzycząsteczkowe, słabsze od sił powodujących tworzenie się wiązania wodorowego. Następstwem tego jest gęste ułożenie cząsteczek sulfanu w sieć cząsteczkową, przez co temperatura topnienia zestalonego sulfanu jest znacznie niższa od temperatury topnienia zestalonego oksydanu. Dlatego też w temperaturze pokojowej oksydan jest cieczą, a sulfan jest gazem.
Połączenia wodoru z tlenowcami różnią się znacznie zachowaniem w wysokich temperaturach. Oksydan jest stabilny w wysokich temperaturach bez żadnego dostrzegalnego rozkładu. Sulfan natomiast w temperaturach bliskich ulega reakcji dysocjacjidysocjacji termicznej.
Otrzymywanie
Spośród wodorków tlenowców tylko sulfan i oksydan można otrzymać w bezpośredniej reakcji z pierwiastków.
Proces otrzymywania oksydanu jest reakcją silnie egzotermicznąegzotermiczną (mieszanina tlenu i wodoru w stosunku objętościowym 2:1 nazywana jest mieszaniną piorunującąmieszaniną piorunującą), przebiegającą zgodnie z równaniem:
Sulfan można otrzymać w bezpośredniej reakcji siarki z wodorem. Reakcja ta jest niżej energetyczna aniżeli reakcja otrzymywania oksydanu, przez co sulfan jest znacznie mniej trwały:
Słownik
rodzaj oddziaływania międzycząsteczkowego; w wiązaniu wodorowym atom wodoru tworzy mostek łączący dwa elektroujemne atomy ; z jednym z nich () połączony jest wiązaniem kowalencyjnym spolaryzowanym (wiązanie chemiczne), a z drugim — siłami elektrostatycznymi
reakcja, w wyniku której wydziela się z układu do otoczenia energia na sposób ciepła
mieszanina wodoru z tlenem w stosunku objętościowym , w której po zainicjowaniu reakcji dochodzi do wydzielenia znacznych ilości ciepła i wybuchu
rozpad związku chemicznego na mniejsze indywidua chemiczne pod wpływem czynnika zewnętrznego, np. wody, ciepła lub światła
właściwość indywiduów chemicznych polegająca na występowaniu w nich elektrycznego momentu dipolowego w wyniku nierównomiernego rozłożenia cząstkowych ładunków elektrycznych w ich objętości
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, t. , Warszawa .
Trzebiatowski W., Chemia nieorganiczna, Warszawa , wyd. .
Greenwood N. N., Earnshaw A., Chemistry of the Elements, Butterworth‑Heinemann, 2nd edition, , , , .