Przeczytaj
Jeżeli elektrolizie poddaje się stopione elektrolity (np. tlenki, wodorotlenki, sole), to w takich warunkach wszystkie metale ulegają redukcji na katodzie (niezależnie od wartości ich potencjału standardowego).
Elektroliza stopionych tlenków
Przykładem procesu, w którym wykorzystuje się elektrolizę stopionego tlenku, jest otrzymywanie glinu poprzez proces Halla-Héroulta, opracowanego w roku. Tlenek glinu(), otrzymany z boksytu, rozkładany jest elektrolitycznie na metaliczny glin oraz gazowy tlen. Proces ten zachodzi w sposób ciągły i rozpoczyna się od etapu rozpuszczenia tlenku glinu w krioliciekriolicie, który wypełnia wannę elektrolityczną. Temperatura procesu utrzymywana jest na poziomie –. Powstający w tym procesie glin oddzielany jest od elektrolitu i sukcesywnie usuwany z komory elektrolizera. Uzyskany metal ma większą gęstość od elektrolitu, więc osiada na dnie wanny elektrolitycznej. Z kolei wydzielający się tlen reaguje z grafitową okładziną anody, tworząc tlenek węgla(), który, wydzielając się intensywnie, powoduje mieszanie się elektrolitu i staje się nośnikiem dla gazowych produktów ubocznych.

Wtórna reakcja na anodzie:
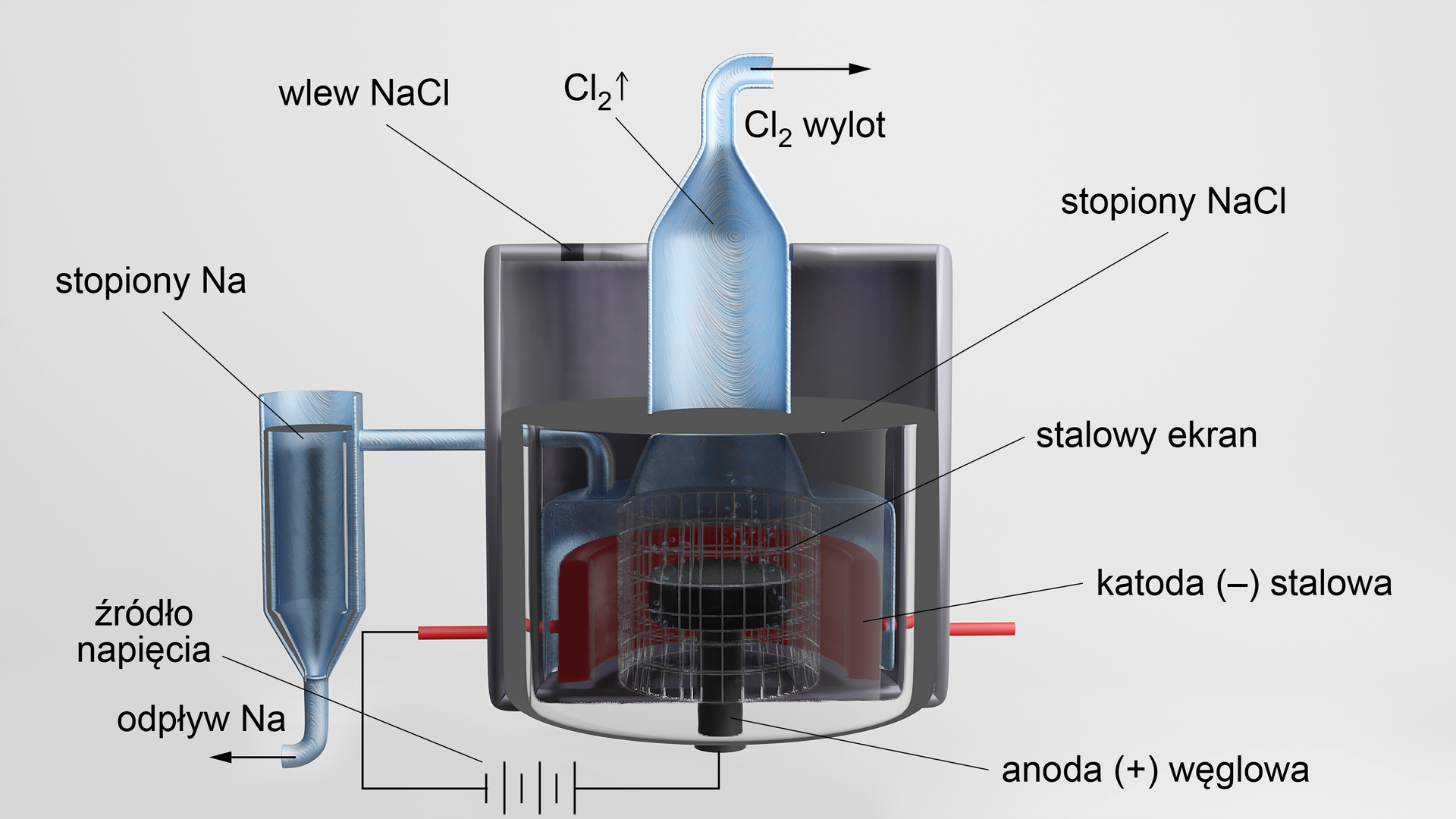
Elektroliza stopionych soli
Stopione sole należą do przewodników elektrolitycznych – dobrze przewodzą prąd. Podczas elektrolizy, na anodzie i katodzie wydzielają się produkty ich rozkładu, podobnie jak w przypadku elektrolizy roztworów wodnych. Wówczas z chlorku ołowiu() otrzymuje się chlor i ołów, z chlorku sodu – chlor i sód, a z azotanu() sodu – sód, tlen oraz tlenki azotu.
Metoda stapiania soli stosowana jest wtedy, gdy nie ma możliwości przeprowadzenia elektrolizy wodnych roztworów tych soli (zdarza się, że produkty elektrolizy wodnej reagują z wodą).
Przykładem tego typu elektrolizy jest stapianie chlorku sodu ().
Naturalne solanki, woda morska, karnalit czy dolomit są źródłem chlorku magnezu. Po przeróbce chemicznej tych surowców otrzymuje się uwodniony chlorek magnezu, który jest surowcem do elektrolizy. Chlorek magnezu jest stapiany w temperaturze . W efekcie, na katodzie otrzymywany jest ciekły magnez, natomiast na anodzie wydziela się taka sama ilość chloru.
Elektroliza stopionego chlorku cynku
Umieść w tyglutyglu około bezwodnego chlorku cynku. Następnie ustaw tygiel nad palnikiem i zacznij go ogrzewać aż do stopienia soli (). Kolejnym krokiem jest umieszczenie dwóch elektrod grafitowych, połączonych płaską baterią (), w stopionej soli. Poczekaj kilka minut i opisz obserwację.
Uwaga! Doświadczenie należy przeprowadzać pod wyciągiem.
Podczas przeprowadzania elektrolizy opisanej w doświadczeniu możemy zaobserwować, że nad tyglem pojawia się gaz o charakterystycznym zapachu chloru, a na jednej z elektrod gromadzi się ciało stałe o wyglądzie odmiennym od stopionej soli. Te obserwacje wskazują na zajście elektrolizy stopionej soli.
Elektroliza stopionych wodorotlenków
Przemysłową metodą otrzymywania metalicznego sodu jest proces Castnera, prowadzony w drodze elektrolizy stopionego wodorotlenku sodu w temperaturze około .

W procesie tym metaliczny sód wytwarza się na katodzie. Ze względu na to, że jego gęstość jest mniejsza od stopionego wodorotlenku sodu, wędruje ku górze i gromadzi się w kolektorze.
Reakcje elektrochemiczne tego procesu przedstawiono poniżej.
Reakcja uboczna:
Słownik
minerał, fluoroglinian sodu
naczynie laboratoryjne stosowane do suszenia, prażenia i/lub stapiania substancji, zwłaszcza podczas analizy chemicznej
węglanowa skała osadowa, składająca się z minerału dolomitu w ilości –
minerał, uwodniony chlorek potasu i magnezu
ilasta skała osadowa składająca się głównie z wodorotlenków glinu
Bibliografia
Atkins P., Paula J., Chemia fizyczna, Warszawa 2015.
Atkins P., Podstawy chemii fizycznej, Warszawa 1999.
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2007.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa–Bielsko‑Biała 2010.