Przeczytaj
Budowa cząsteczki wody
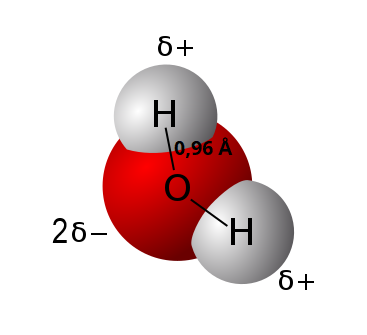
Woda jest substancją niezbędną do życia i jest uznawana za najpopularniejszy rozpuszczalnik na Ziemi. Cząsteczka wody ma tę niezwykłą właściwość, że na skutek jej działania, wiązania spolaryzowane lub jonowe innych związków chemicznych ulegają rozerwaniu i substancja rozpada się (dysocjuje) na jony. Wynika to z faktu, że w cząsteczce wody występują wiązania kowalencyjne (atomowe) spolaryzowane (różnica elektroujemności pomiędzy tlenem a wodorem wynosi ∆E = 3,5 - 2,1 = 1,4). Bardziej elektroujemny atom (tlen) stanowi biegun ujemny, a mniej elektroujemny (wodór) biegun dodatni. Cząsteczka wody posiada zatem dwa bieguny (dodatni i ujemny) i o takiej cząsteczce mówimy, że jest dipolemdipolem.
Autodysocjacja wody
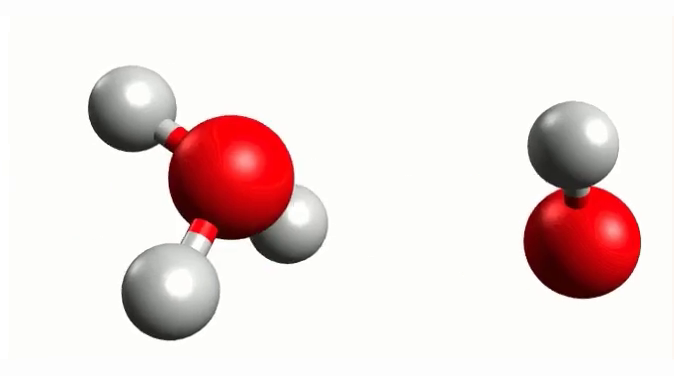
Na skutek oddziaływania cząsteczki wody z sąsiednią cząsteczką może się ona rozpadać na jony. Proces ten nazywany jest dysocjacją elektrolityczną (lub dysocjacją jonową). Z uwagi na to, że reagują ze sobą cząsteczki tego samego typu mówimy, że jest to proces autodysocjacjiautodysocjacji (lub autoprotolizy). Podobnie jak w każdej innej reakcji chemicznej równowaga reakcji zostaje osiągnięta w momencie, gdy stężenia zarówno substratów jak i produktów nie wykazują dalszej tendencji do zmiany (ustala się stan równowagi dynamicznej). Zgodnie z teorią Brønsteda-Lowry’egoBrønsteda-Lowry’ego w czystej wodzie, na skutek autodysocjacji, obecne są w niewielkiej ilości jony oraz . Proces autodysocjacji wody zachodzi w minimalnym stopniu i polega w istocie na reakcji cząsteczki wody z drugą, co można opisać równaniem:
Atom wodoru jednej cząsteczki wody, silnie oddziałujący poprzez wiązanie wodorowe z atomem tlenu drugiej cząsteczki wody, odrywa się w postaci jonu wodoru i „przechodzi” do drugiej cząsteczki wody. W efekcie powstają jony oksoniowe () oraz wodorotlenkowe (), co prezentuą poniższe grafiki.
Co to jest iloczyn jonowy wody?
Korzystając z równania autodysocjacji wody (2) można zapisać wyrażenie na stałą równowagi termodynamicznej wody (w temp. 25°C) w postaci:
Do wyrażenia na stałą równowagi wstawiamy stężenia równowagowe. W tym przypadku powinniśmy wstawić stężenie równowagowe cząsteczek wody, które nie zdysocjowały. Z uwagi na fakt, że woda dysocjuje w bardzo niewielkim stopniu to stężenie zdysocjowanych (równowagowych) cząsteczek wody jest praktycznie równe stężeniu początkowemu. Zakładając, że gęstość wody wynosi 1000 , a masa molowa wynosi 18 , otrzymujemy stężenie molowe wody:
W kolejnym kroku stężenie to wstawiamy do wyrażenia na stałą dysocjacji wody, które przyjmuje postać:
Na podstawie danych doświadczalnych i pomiarów wartości przewodnictwa jonówprzewodnictwa jonów wyznaczono, że stała dysocjacji wody liczbowo jest równa 1,8 ∙ 10Indeks górny -16-16 w temperaturze około 25°C. Powyższa wartość świadczy o tym, że woda jest bardzo słabym elektrolitem, ponieważ dysocjuje w nieznacznym stopniu. Wartość stężenia molowego wody możemy przenieść na lewą stronę równania, ponieważ jest ona właściwie niezmienna i możemy traktować ją jako stałą. Możemy zatem zapisać, że:
Po podstawieniu stężenia wody i wartości stałej dysocjacji KIndeks dolny HIndeks dolny 22O Indeks dolny koniecHIndeks dolny 22O otrzymujemy wyrażenie:
Po wymnożeniu otrzymujemy zatem:
Z powyższych równań wynika, że wartość iloczynu stężeń jonów (oksoniowego oraz wodorotlenkowego), na które dysocjuje cząsteczka wody jest wartością stałą. Iloczyn stężeń jonów (oksoniowego i wodorotlenkowego) nazwano iloczynem jonowym wody i oznaczono symbolem Kw.
Iloczyn jonowy wody to specjalny rodzaj stałej dysocjacji otrzymany przez wymnożenie wartości stałej równowagi dla procesu dysocjacji wody i stężenie niezdysocjowanych cząsteczek wody. Wartość iloczynu jonowego wody:
Wartość iloczynu jonowego wody nie zależy od stężenia kwasu i zasady dodawanej do wody, a jedynie od temperatury.
- 1. zestaw danych:
- Temperatura [[°C]]: 0
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 0.114; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 2. zestaw danych:
- Temperatura [[°C]]: 5
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 0.186; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 3. zestaw danych:
- Temperatura [[°C]]: 10
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 0.293; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 4. zestaw danych:
- Temperatura [[°C]]: 15
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 0.457; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 5. zestaw danych:
- Temperatura [[°C]]: 20
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 0.681; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 6. zestaw danych:
- Temperatura [[°C]]: 25
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 1.008; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 7. zestaw danych:
- Temperatura [[°C]]: 30
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 1.471; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 8. zestaw danych:
- Temperatura [[°C]]: 35
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 2.089; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 9. zestaw danych:
- Temperatura [[°C]]: 40
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 2.916; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 10. zestaw danych:
- Temperatura [[°C]]: 45
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 4.074; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 11. zestaw danych:
- Temperatura [[°C]]: 50
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 5.476; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 12. zestaw danych:
- Temperatura [[°C]]: 55
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 7.244; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 13. zestaw danych:
- Temperatura [[°C]]: 60
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 9.550; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 14. zestaw danych:
- Temperatura [[°C]]: 65
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 12.58; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 15. zestaw danych:
- Temperatura [[°C]]: 70
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 15.850; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 16. zestaw danych:
- Temperatura [[°C]]: 75
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 20; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 17. zestaw danych:
- Temperatura [[°C]]: 80
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 25.120; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 18. zestaw danych:
- Temperatura [[°C]]: 85
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 30.900; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 19. zestaw danych:
- Temperatura [[°C]]: 90
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 38.020; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
- 20. zestaw danych:
- Temperatura [[°C]]: 95
- Wartość iloczynu jonowego wody [*10[baseline-shift: super; font-size: smaller;]14[/]]: 45.710; Podpis osi wartości: Wartość iloczynu jonowego wody [[10[baseline-shift: super; font-size: smaller;]-14[/]]]
Wykres zależności wartości iloczynu jonowego wody od temperatury:
-
temperatura : 0
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 0.114
-
temperatura : 5
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 0.186
-
temperatura : 10
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 0.293
-
temperatura : 15
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 0.457
-
temperatura : 20
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 0.681
-
temperatura : 25
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 1.008
-
temperatura : 30
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 1.471
-
temperatura : 35
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 2.089
-
temperatura : 40
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 2.916
-
temperatura : 45
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 4.074
-
temperatura : 50
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 5.476
-
temperatura : 55
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 7.244
-
temperatura : 60
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 9.550
-
temperatura : 65
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 12.58
-
temperatura : 70
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 15.850
-
temperatura : 75
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 20
-
temperatura : 80
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 25.120
-
temperatura : 85
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 30.900
-
temperatura : 90
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 38.020
-
temperatura : 95
wartość_iloczynu_jonowego_wody_[*10[superscript]14[/]] : 45.710
Chociaż stężenie jonów może zmieniać się podczas dodawania różnych substancji do wody, iloczyn stężeń [] i [] pozostaje w danej temperaturze zawsze stały. Oznacza to, że jeśli w temperaturze 25°C, stężenie jonów [] wynosi 0,1 , to stężenie jonów [] jest równe 10Indeks górny -13-13 .
Pamiętając, że:
iloczyn jonowy wody Kw można przedstawić w postaci logarytmicznej:
Z powyższego równania wynika prosta zależność między pH oraz pOH. Na jej podstawie można wywnioskować, że w miarę wzrostu pH, pOH musi się zmniejszać, tak, aby spełnione było równanie:

W rozcieńczonych roztworach wodnych, w stałej temperaturze, bez względu na rodzaj substancji rozpuszczonej w wodzie, iloczyn jonowy wody KIndeks dolny ww jest wielkością stałą.
Słownik
cząsteczka polarna, w której na skutek różnicy elektroujemności następuje rozdzielenie ładunku dodatniego i ujemnego
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) związek chemiczny, który ulega procesowi rozpadu na jony pod wpływem wody i jest zdolny do przewodzenia prądu; gdy jest całkowicie zdysocjowany mówimy o elektrolicie mocnym
rodzaj reakcji dysocjacji elektrolitycznej, która polega na rozpadzie na jony wskutek reakcji ze sobą cząsteczek tego samego związku
teoria kwasowo‑zasadowa, według której kwas jest zdolny do oddawania kationów wodoru, a zasadą jest substancja zdolna do przyjmowania kationów wodoru; kwas‑donor, zasada‑akceptor
wyraża stosunek iloczynu molowych stężeń równowagowych produktów reakcji do iloczynu molowych stężeń równowagowych substratów; stężenia produktów i substratów są podniesione do potęg odpowiadającym współczynnikom stechiometrycznym odpowiednich reagentów
rodzaj przewodnictwa elektrycznego, w którym nośnikiem prądu są jony
reakcja, która może zachodzić równocześnie w kierunku produktów lub substratów
; wykładnik stężenia jonów oksoniowych w roztworze
; wykładnik stężenia jonów wodorotlenkowych w roztworze