Przeczytaj
Właściwości wodoru
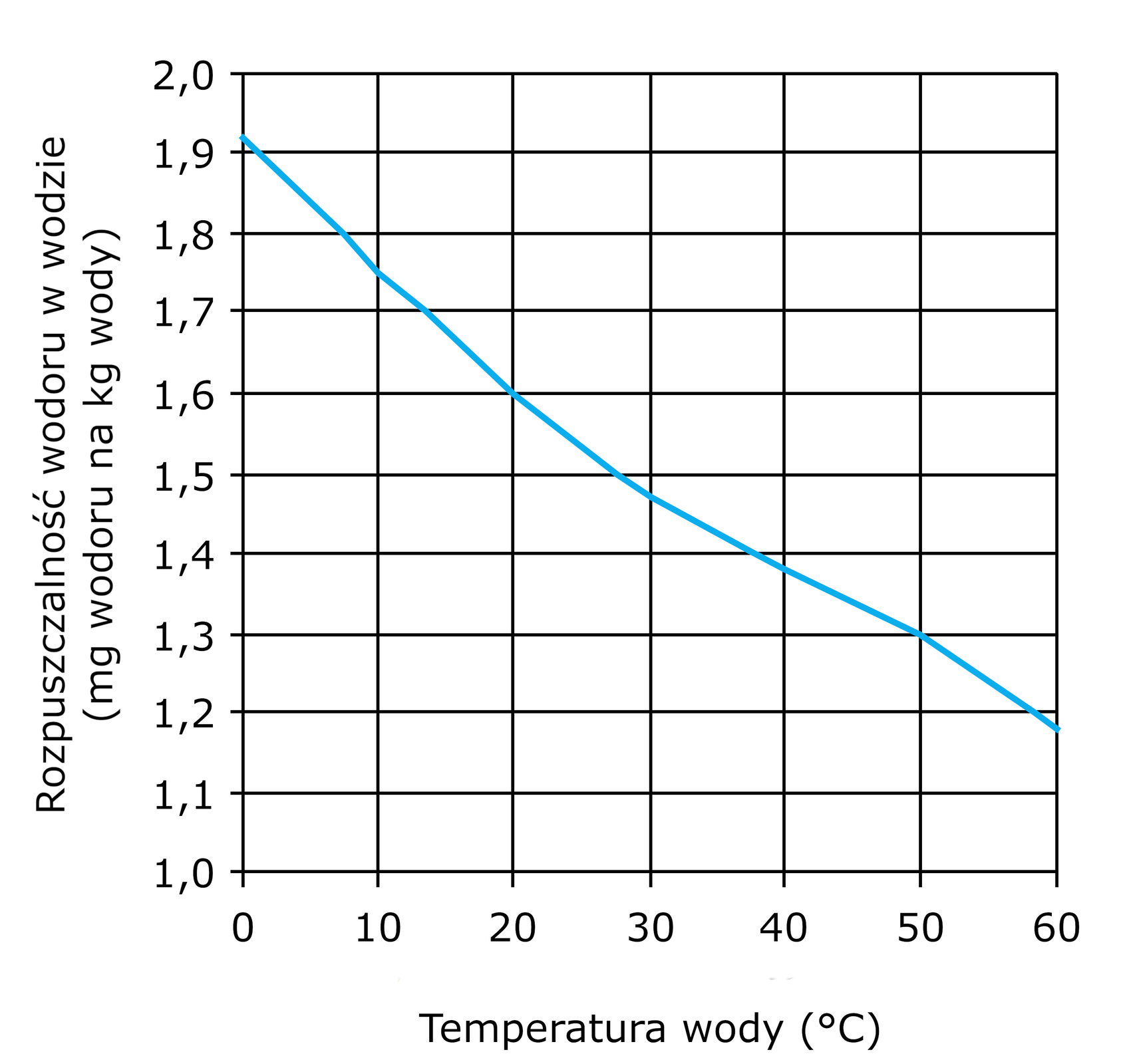
Wodór w warunkach normalnych ( i ) jest gazem bezwonnym, bezbarwnym, a w podwyższonej temperaturze przenika przez metale i szkło kwarcowe. Jest prawie nierozpuszczalny w wodzie, ale za to bardzo dobrze rozpuszcza się zarówno w palladzie i niklu, jak i stopach, takich jak np. stop niklu i lantanu.
- bezbarwny gaz;
- słabo rozpuszczalny w wodzie;
- dobrze rozpuszcza się w palladzie i niklu;
- wykazuje najmniejszą gęstość spośród wszystkich odkrytych pierwiastków chemicznych.
- bezwonny;
- palny;
- reaguje z niemetalami, tworząc wodorki niemetali;
- reaguje z tlenem, tworząc wodę, z azotem amoniak, z siarką siarkowodór, z chlorem, dając chlorowodór;
- reaguje z metalami, tworząc wodorki metali.
Badanie gęstości wodoru
Wodór jest najlżejszym gazem na świecie. Jego gęstość jest mniejsza od gęstości powietrza. Oznacza to, że wodór ma też najmniejszą gęstość ze wszystkich pierwiastków. Jeżeli napełnimy balon wodorem, ten uniesie się do góry.

Film dostępny pod adresem /preview/resource/R137d3o37CIhg
Animacja przedstawia napełnianie balonów pięcioma gazami: tlenkiem węgla(<math aria‑label="cztery">
Prostym eksperymentem określającym gęstość wodoru względem powietrza jest przyłożenie do siebie dwóch probówek (jednej z powietrzem, a drugiej z wodorem). Do odwróconej dnem do góry probówki zawierającej wodór, przykładamy od dołu drugą probówkę z powietrzem.

Trzymając mocno obie probówki, odwracamy je dnem do góry i wylotem do dołu. Wodór, jako gaz „leżjszy”od powietrza, przemieści się do górnej probówki. Odwracamy probówkę z wodorem i szybko przykładamy palące się łuczywko. Podczas reakcji będzie słychać charakterystyczny dźwięk spalania wodoru, co świadczy o jego obecności w probówce, w której wcześniej było powietrze.
Wodór jest gazem łatwopalnym. Pierwiastek ten wraz z tlenem tworzy mieszaninę wybuchową. Dlatego wykonywanie doświadczeń z użyciem tego gazowego niemetalu jest bardzo niebezpieczne!
Badanie właściwości redukujących wodoru
Wodór wykazuje właściwości redukujące, względem takich związków jak: , , :
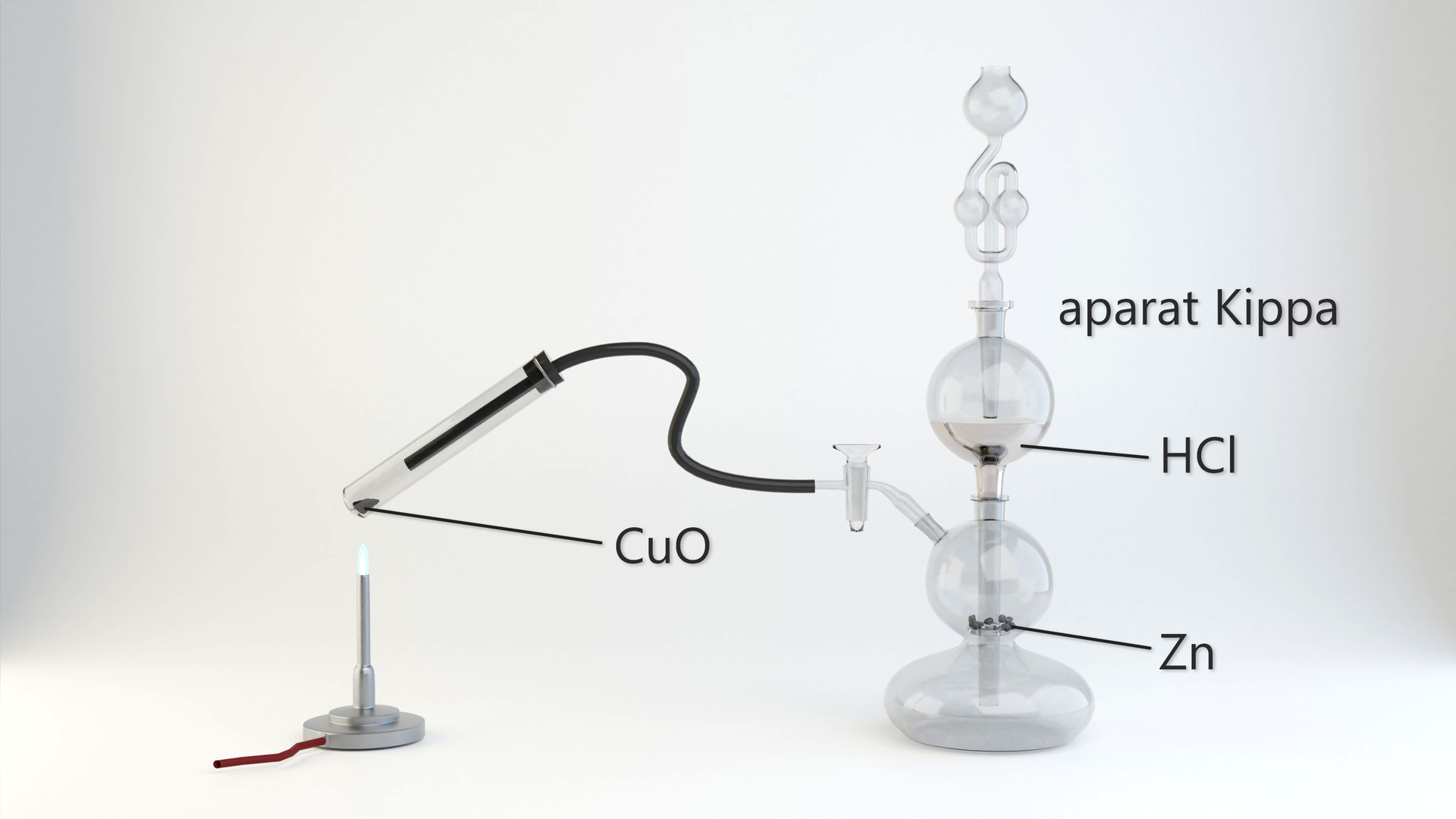
W laboratorium reakcje z udziałem gazów przeprowadza się z pomocą tzw. aparatu Kippaaparatu Kippa. W ten sposób można przeprowadzić wspomnianą już reakcję redukcji tlenku miedzi() przez gazowy wodór. W probówce umieszcza się tlenek miedzi() i łączy się ją z wężem, którego drugi koniec zamocowany jest do aparatu Kippaaparatu Kippa. Probówkę należy ogrzewać, jednocześnie wprowadzając gazowy wodór, wytwarzany w wyniku zachodzącej między cynkiem i kwasem chlorowodorowym reakcji chemicznej.
Otrzymywanie wodoru
Do metod przemysłowych wytwarzania wodoru zaliczają się:
konwersja metanu i innych węglowodorów z parą wodną:
konwersja tlenku węgla z parą wodną:
elektroliza wodnego roztworu . Przyłożenie pola elektrycznego powoduje uporządkowanie ruchu jonów w roztworze, ujemnie naładowane jony chloru wędrują do anody, oddają elektrony i przechodzą do stanu cząsteczkowego:
Natomiast dodatnie jony sodu przyjmują elektrony, stając się atomami. Reagują z wodą według równania:
Reakcja wody z metalami:
Istnieją także metody laboratoryjne:
reakcje metali (np. , , ) z kwasami (np. , ):
reakcje metali z wodą; jeśli użyjemy zamiast , możemy otrzymać deuter, np.
reakcja wodorków z wodą, np. , , (niebezpieczne, gwałtowne reakcje).
Najbardziej znanymi reakcjami otrzymywania wodoru w laboratorium są:
reakcja kwasu solnego (chlorowodorowego) z cynkiem:
reakcja glinu z wodorotlenkiem sodu:
Słownik
szklane urządzenie laboratoryjne stosowane przy otrzymywaniu gazów w wyniku reakcji ciała stałego z cieczą; poszczególne elementy urządzenia połączone są ze sobą za pomocą złączy szlifowych, co gwarantuje szczelność

Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987.
Bogdańska Zarembina A., Matusewicz E. I., Matusewicz J., Chemia dla szkół średnich, Warszawa 1995.
Grębosz M., Zapotoczny S., Słownik szkolny. Chemia, Warszawa 2007.
Hassa R., Mrzigod A., Mrzigod J., Sułkowski W., Chemia – podręcznik i zbiór zadań w jednym, Straszyn 2003.
Kaczyński J., Czaplicki A., Chemia ogólna, Warszawa 1974.
Litwin M., Styka – Wlazło S., Szymońska J., Chemia ogólna i nieorganiczna, Warszawa 2002.
Pazdro K. M., Chemia. Podręcznik do kształcenia rozszerzonego w liceach, Warszawa 2020.
Sawicka J., Janich‑Kilian A., Cejner‑Mania W., Urbańczyk G., Tablice chemiczne, Gdańsk 2015.



