Przeczytaj
Wiązania chemiczne powstają w wyniku przekazywania elektronów walencyjnych pomiędzy reagującymi atomami lub uwspólniania elektronów walencyjnych reagujących ze sobą atomów. Atomy poszczególnych pierwiastków chemicznych reagują ze sobą i tworzą odpowiednie wiązania chemiczne, dążąc do uzyskania trwałej energetycznie konfiguracji elektronowej atomu najbliższego helowca.
W przypadku atomów pierwiastków bloku , elektronami walencyjnymi są elektrony obsadzające podpowłokę ostatniej powłoki. W przypadku atomów pierwiastków bloku , elektronami walencyjnymi są elektrony ostatniej powłoki rozmieszczone na podpowłokach typu i . Natomiast w przypadku atomów pierwiastków bloku elektrony walencyjne, to elektrony zajmujące podpowłokę ostatniej powłoki oraz elektrony podpowłoki z przedostatniej powłoki.
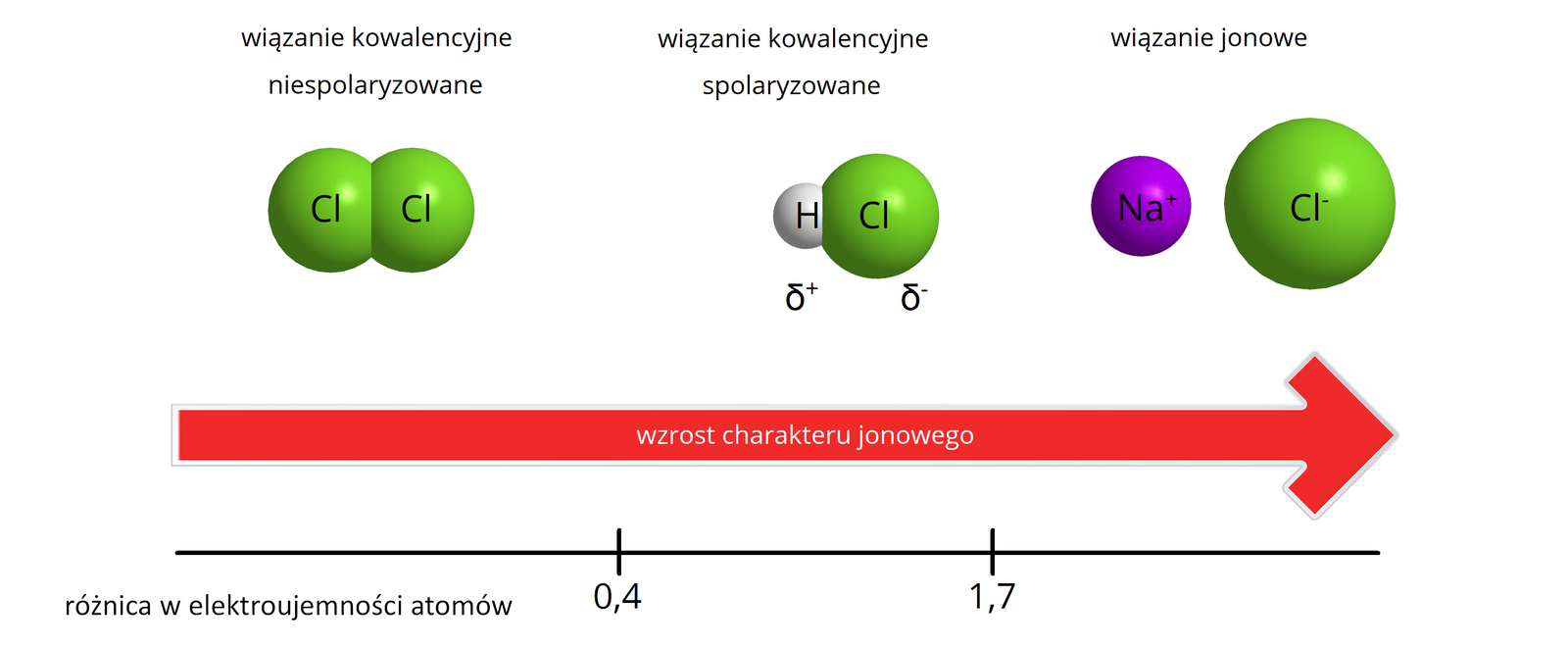
W sposób przybliżony rodzaje wiązań powstających między atomami można określić wyznaczając różnice elektroujemnościelektroujemności pomiędzy dwoma atomami, które tworzą wiązanie chemiczne. Przypomnijmy, że elektroujemność jest „skłonnością” atomu do przyciągania elektronów. Zazwyczaj wykorzystujemy skalę elektroujemności zaproponowaną przez Paulinga.
Atomy mogą uzyskać stabilną konfigurację elektronową gazów szlachetnych na drodze:
przekazania elektronów walencyjnych jednego atomu drugiemu – powstaje wiązanie heteropolarne – jonowe,
uwspólnienia elektronów walencyjnych – powstaje wiązanie kowalencyjne (niespolaryzowane lub spolaryzowane, w tym szczególny przypadek wiązania kowalencyjnego – wiązanie koordynacyjne (donorowo‑akceptorowe)).
Atomy gazów szlachetnych mają korzystny, najniższy z atomów wszystkich pierwiastków, stan energetyczny, który wynika ze szczególnie trwałej konfiguracji elektronowej, tj. oktetu elektronowego (ośmiu sparowanych elektronów walencyjnych) lub, w przypadku atomu helu, dubletu elektronowego (dwóch sparowanych elektronów walencyjnych).
Wiązania kowalencyjne (atomowe)
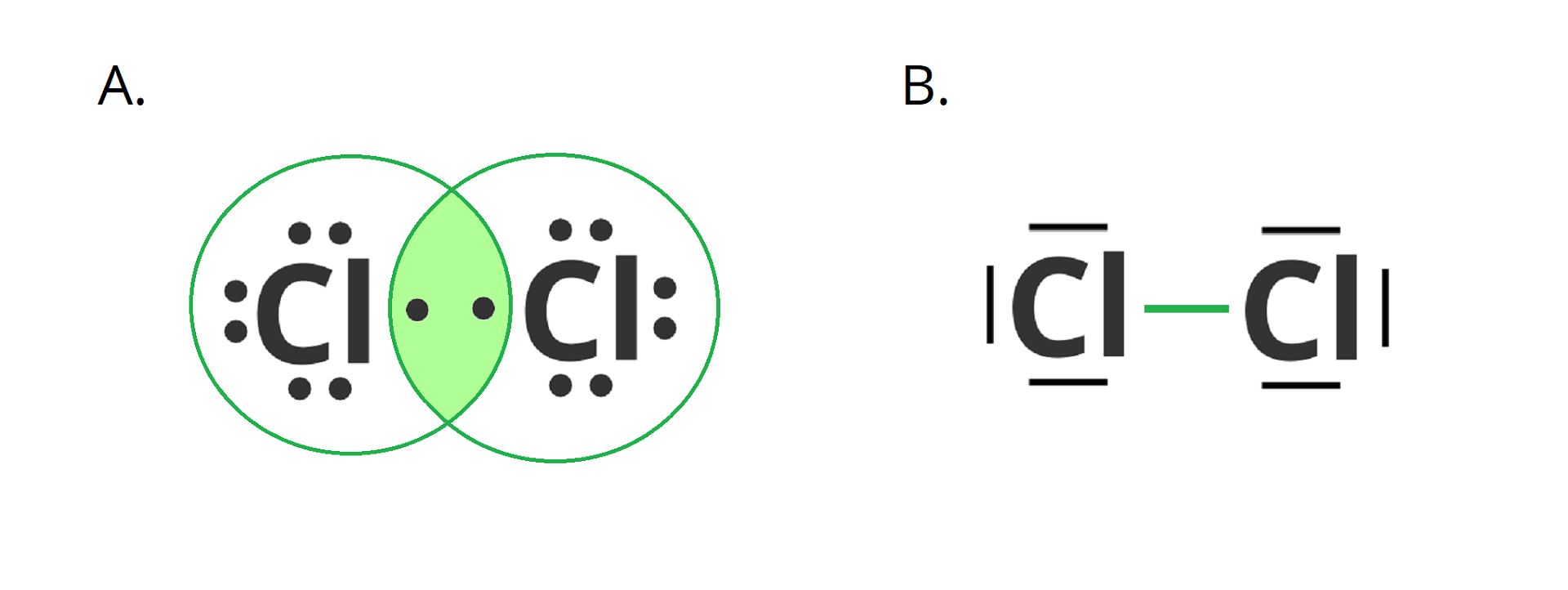
Wiązania te polegają na utworzeniu wspólnej pary elektronów (wiązanie pojedyncze), dwóch wspólnych par elektronów (wiązanie podwójne) lub trzech wspólnych par elektronów (wiązanie potrójne) przez dwa atomy. Elektrony mogą być dostarczane:
przez oba atomy w równej liczbie – każdy atom dostarcza po jednym elektronie do jednej wspólnej pary – mamy wtedy do czynienia z wiązaniem kowalencyjnym,
przez jeden z atomów – jeden atom dostarcza całą parę elektronową (dwa elektrony) – mamy wtedy do czynienia z wiązaniem kowalencyjnym typu koordynacyjnego.
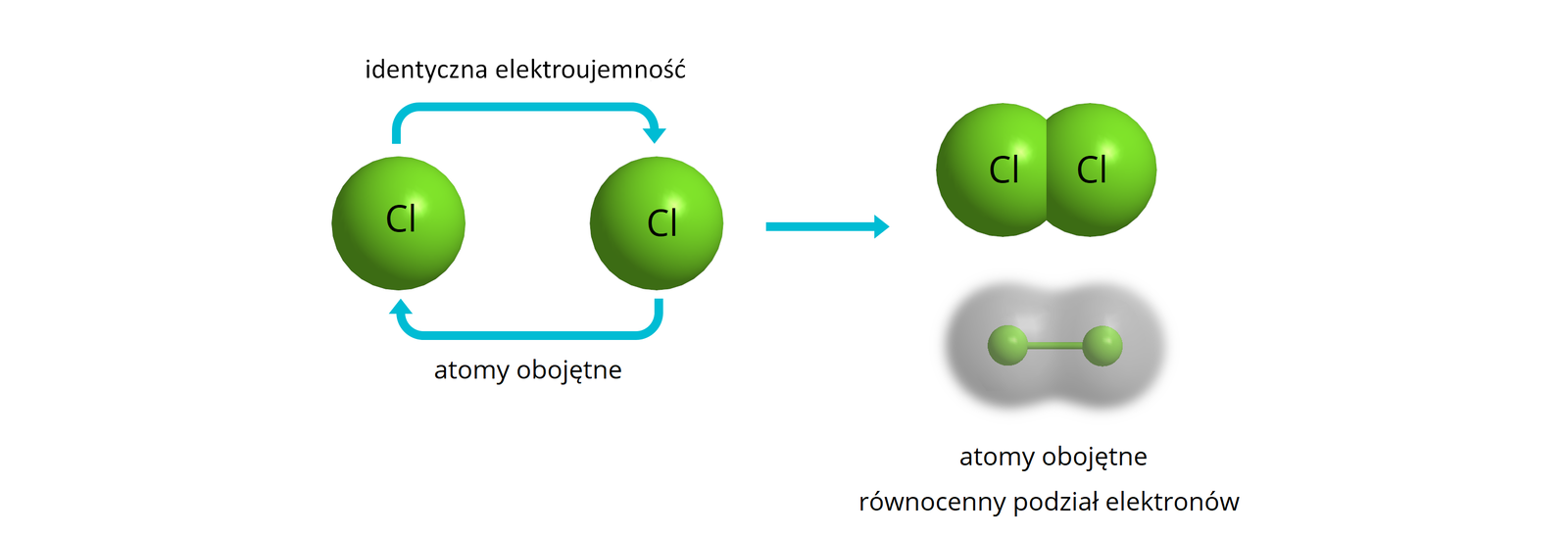
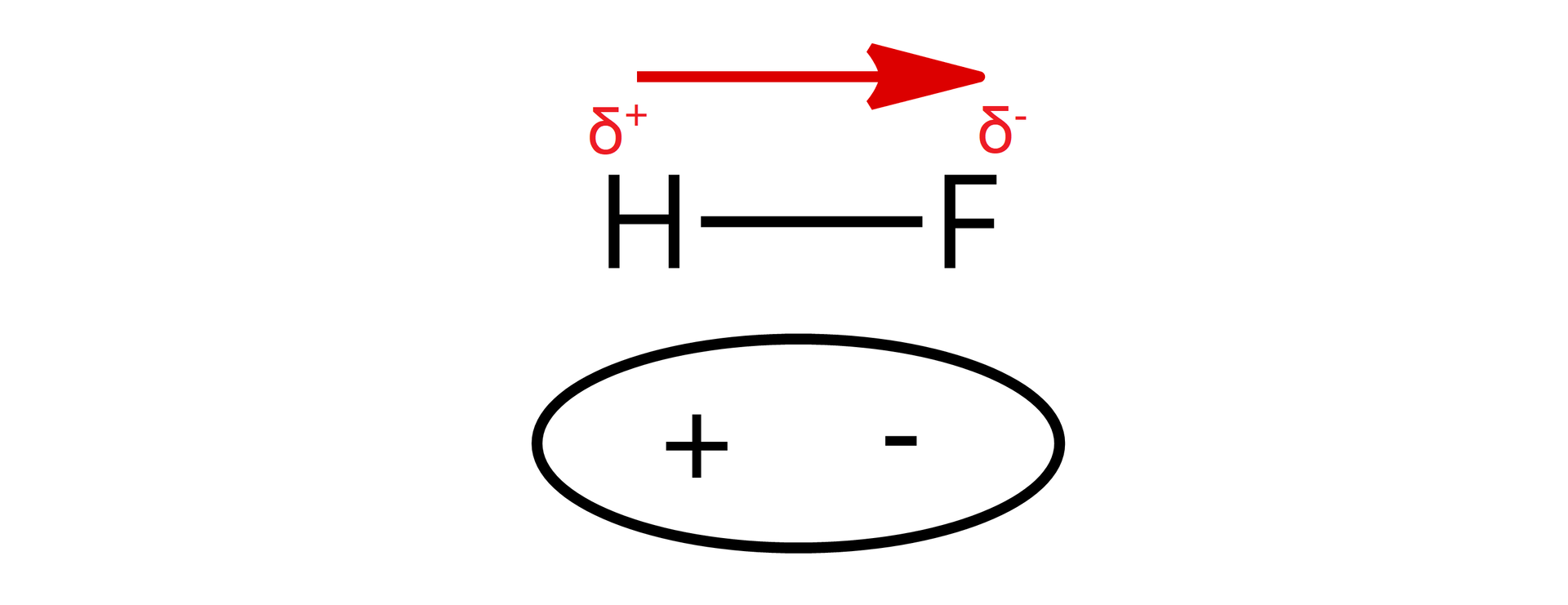
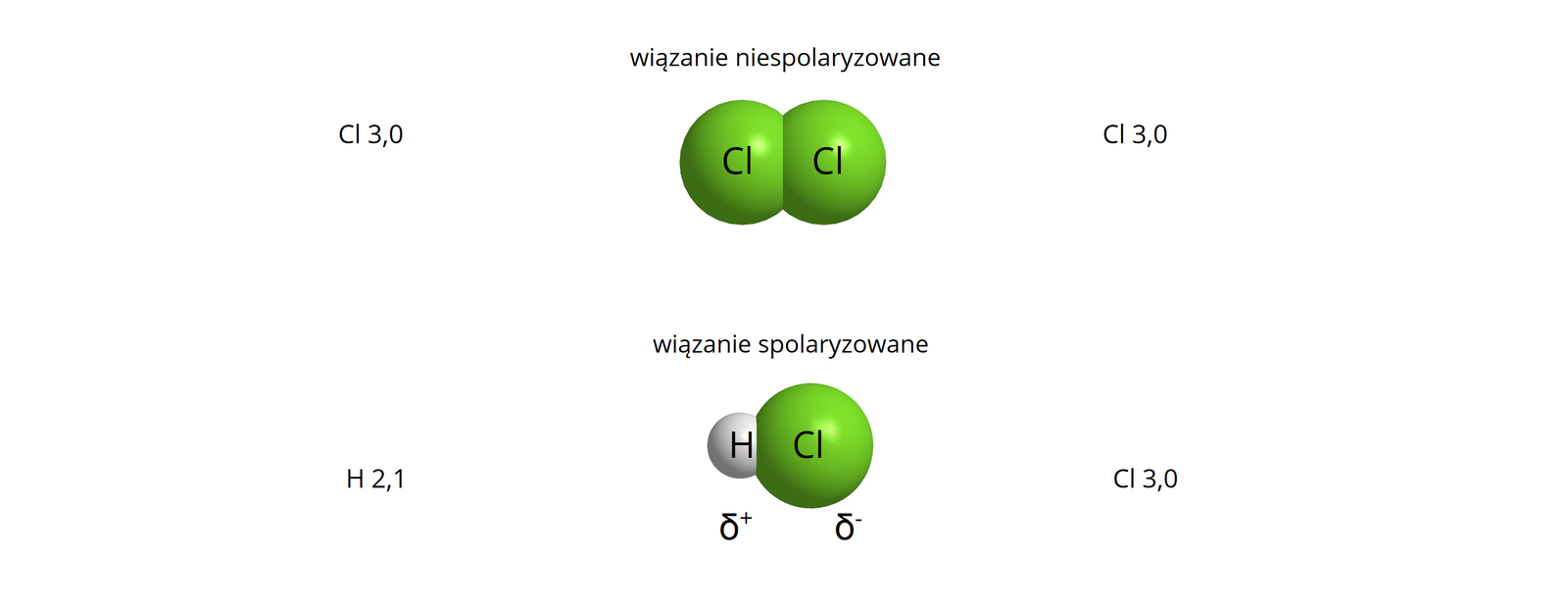
Zazwyczaj wiązania kowalencyjne występują pomiędzy atomami pierwiastków, gdy różnica elektroujemności między nimi mieści się w zakresie , lecz nie jest to reguła (w przypadku fluorowodoru wiązanie kowalencyjne powstaje pomimo różnicy elektroujemności między wodorem a fluorem równej ). W przypadku gdy różnica elektroujemności pomiędzy atomami tworzącymi wiązanie jest znikoma (dla uproszczenia przyjmuje się, że wartość ta jest mniejsza lub równa ) wiązanie kowalencyjne określa się mianem niespolaryzowanego – utworzona wspólna para nie jest przesunięta w znaczny sposób w stronę, któregoś z atomów tworzących wiązanie. Oba atomy przyciągają elektrony z tą samą siłą.
Wiązanie takie występuje m.in. w cząsteczkach utworzonych przez atomy tego samego pierwiastka, np.: , , , , , . Wyjątkiem są cząsteczki związków zbudowanych z dwóch różnych pierwiastków, których różnica elektroujemności wynosi . Są to np. fosforowodór czy siarczek węgla .
Wiązania kowalencyjne spolaryzowane
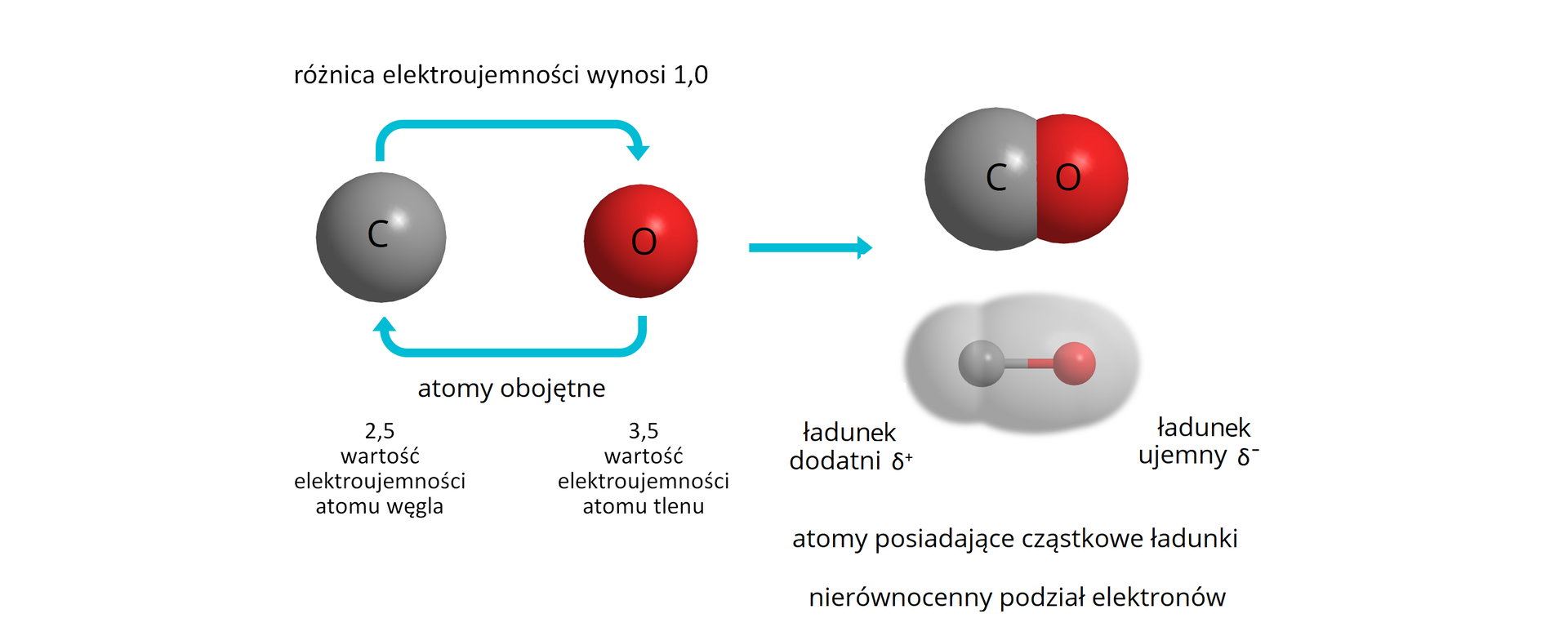
Wiązanie to polega na uwspólnianiu pary elektronów walencyjnych przez atomy tworzące wiązanie, w sposób podobny do wiązania kowalencyjnego niespolaryzowanego, niemniej wspólna para jest w sposób znaczący przesunięta w kierunku atomu bardziej elektroujemnego. Zazwyczaj przyjmuje się, że wiązanie kowalencyjne określamy jako spolaryzowane, kiedy różnica elektroujemności obu atomów tworzących wiązanie jest większa od . Wiązanie kowalencyjne spolaryzowane najczęściej występuje w związkach nieorganicznych i organicznych, w skład których wchodzą atomy niemetali różniących się dość znacznie wartością elektroujemności.
Przykładem wiązania kowalencyjnego spolaryzowanego może być również wiązanie tworzące się między atomem wodoru a chloru.
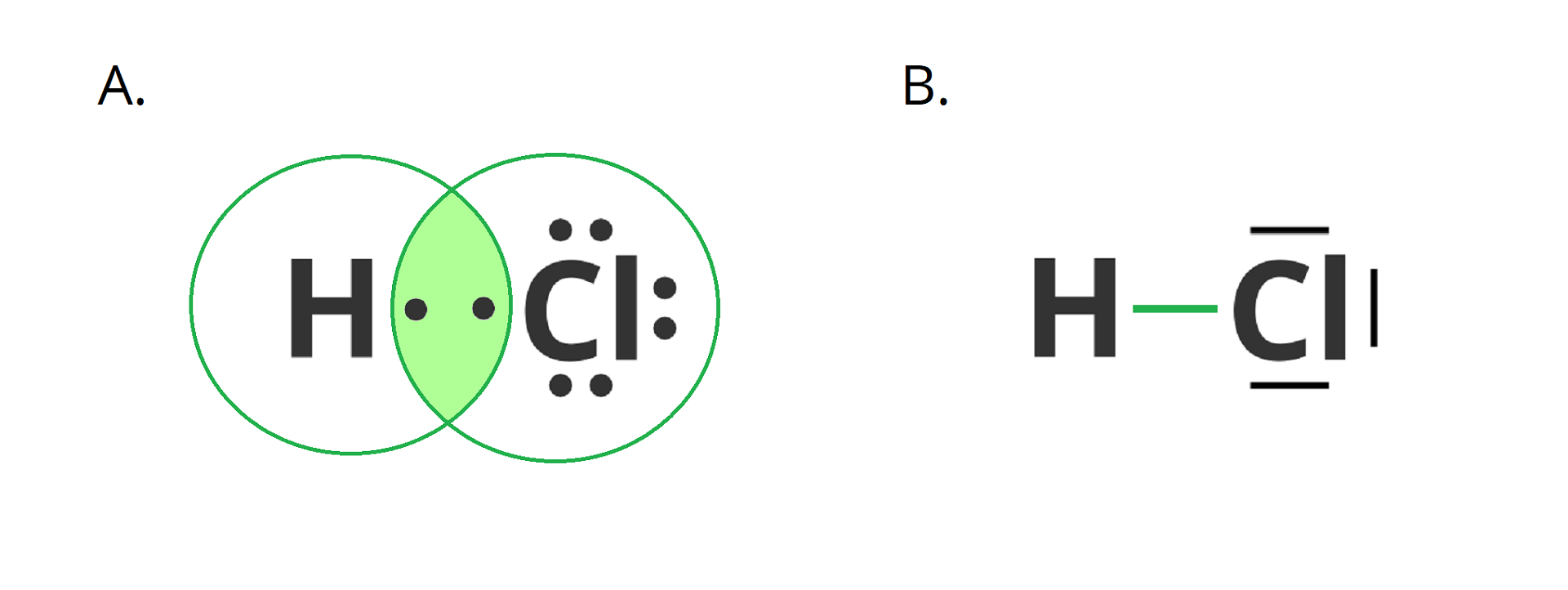
Innym przykładem związku chemicznego o budowie kowalencyjnej jest woda.
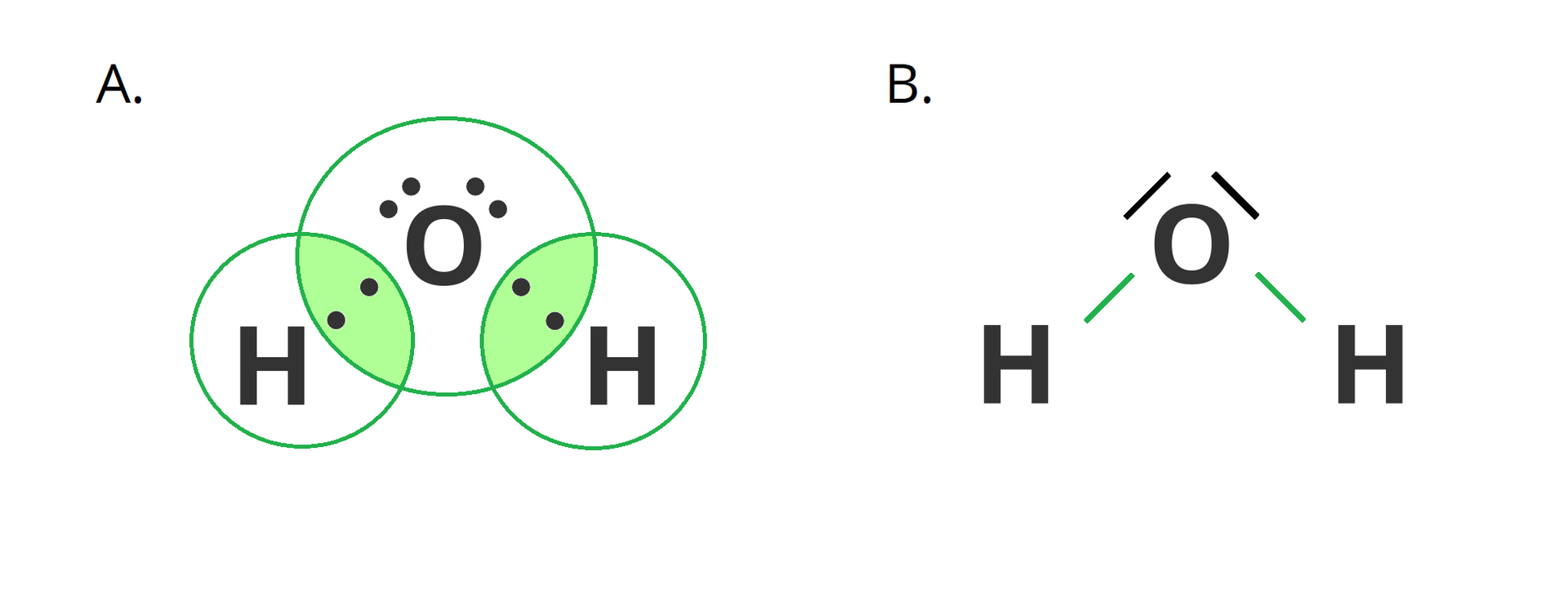
Wiązaniom kowalencyjnym spolaryzowanym towarzyszy powstawanie dipolidipoli, czyli w uproszczeniu układów, w których można wyróżnić różnoimienne bieguny (dodatni i ujemny) położone względem siebie w określonej odległości. Bieguny te, w cząsteczkach związków chemicznych z wiązaniami kowalencyjnymi spolaryzowanymi, powstają w wyniku nierównomiernego rozkładu elektronów wokół atomów tworzących dane wiązanie. Atomy pierwiastka o większej elektroujemności silniej przyciągają elektrony z wiążącej pary elektronowej, zyskując tym samy cząstkowy ładunek ujemny. Jednocześnie atomy pierwiastka o mniejszej elektroujemności zyskują cząstkowy ładunek dodatni.
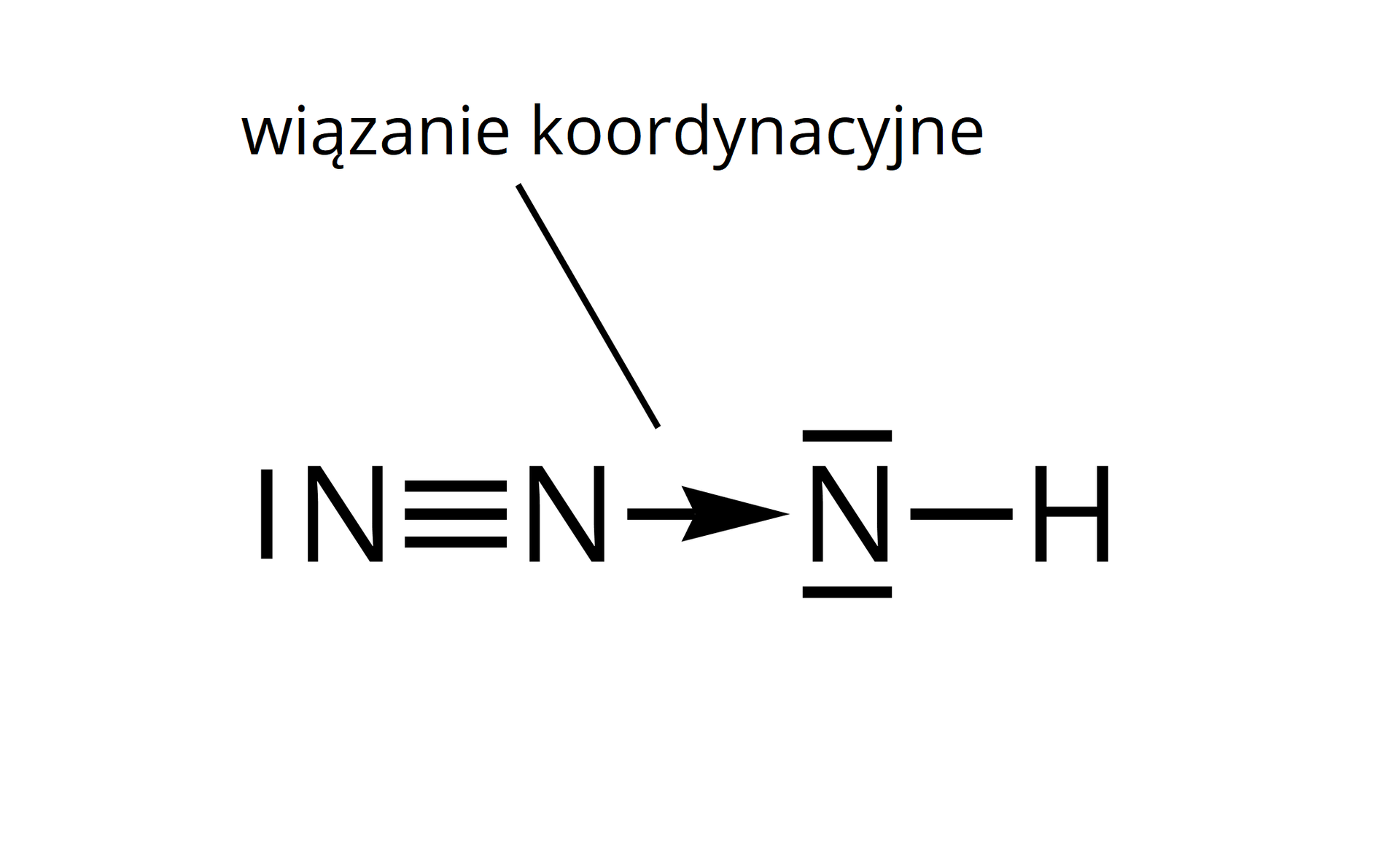
Wiązanie kowalencyjne typu koordynacyjnego
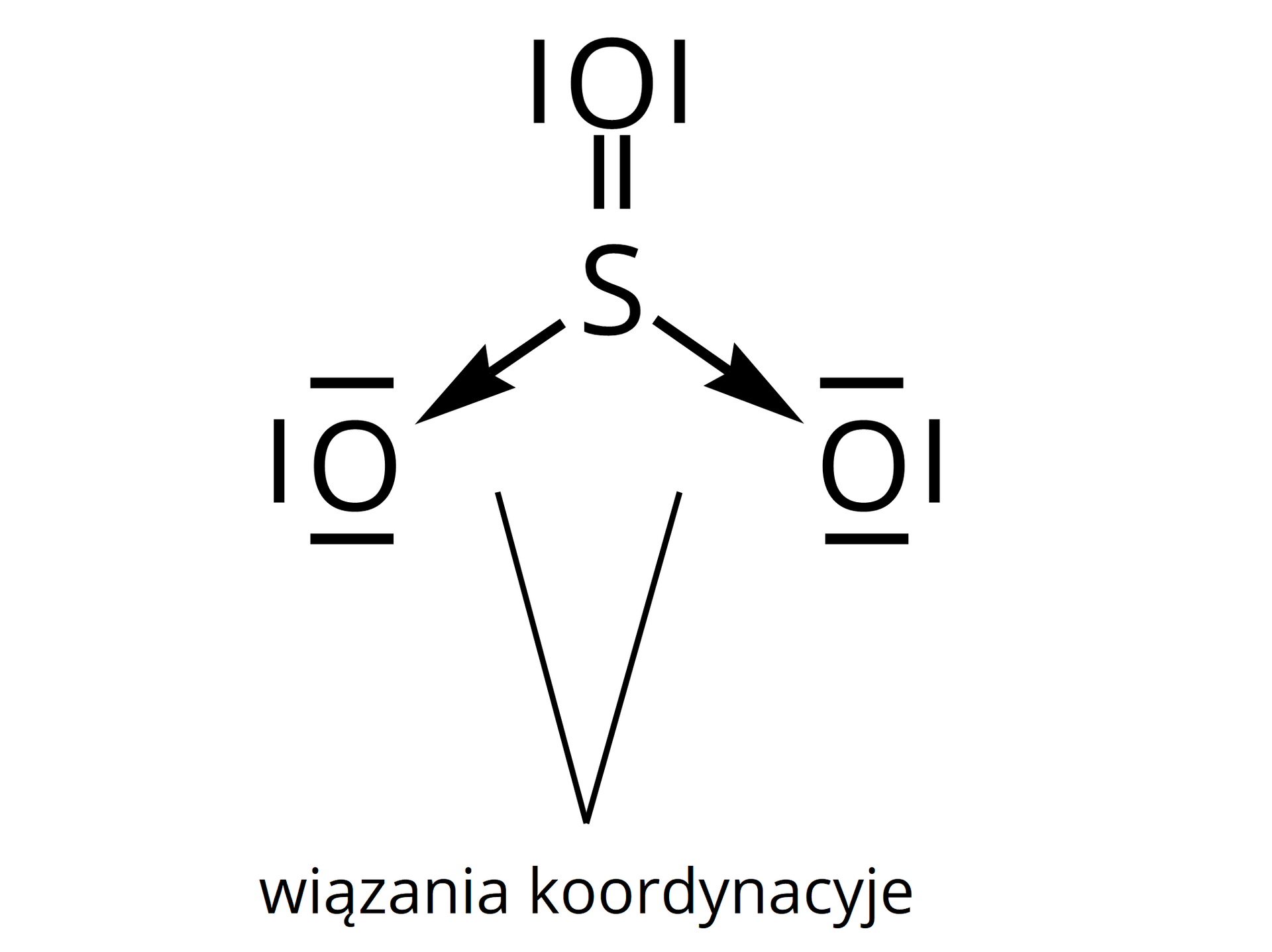
Wiązanie koordynacyjne (zwane również donorowo‑akceptorowym) to wiązanie kowalencyjne, które powstaje kiedy wspólna para elektronowa pochodzi w całości od jednego z atomów tworzących wiązanie. Wiązanie takie często oznaczamy w postaci strzałki, choć nie jest to konieczne.
Zależnie od różnicy elektroujemności pomiędzy atomami, wiązanie koordynacyjne może, podobnie jak zwykłe wiązanie kowalencyjne, mieć charakter niespolaryzowany i spolaryzowany.
Przykład wiązania koordynacyjnego niespolaryzowanego – cząsteczka azydku wodoru ().
Przykład wiązania koordynacyjnego spolaryzowanego – cząsteczka tlenku siarki .
Podsumowanie
Pomiędzy atomami niemetali tworzą się wiązania kowalencyjne:
niespolaryzowane (różnica elektroujemności )
spolaryzowane (różnica elektroujemności ().
Słownik
miara tendencji do przyciągania elektronów przez atomy danego pierwiastka, gdy tworzy on związek chemiczny z atomami innego pierwiastka. Atom bardziej elektroujemnego pierwiastka „przyciąga” do siebie elektrony tworzące wiązanie z atomem mniej elektroujemnym, co prowadzi do polaryzacji wiązania. W skrajnym przypadku, gdy elektroujemności atomów obu pierwiastków bardzo się różnią (np. sód i chlor), dochodzi do pełnego przeskoku elektronów na bardziej elektroujemny atom, co prowadzi do powstania wiązania jonowego
(gr. dipolos „dwa bieguny”) układ dwóch różnoimiennych ładunków lub biegunów magnetycznych, wytwarzający pole dipolowe. Można go scharakteryzować wektorem zwanym momentem dipolowym
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Bogdańska Zarembina A., Matusewicz E. I., Matusewicz J., Chemia dla szkół średnich
Kaczyński J., Czaplicki A., Chemia ogólna, Warszawa 1974
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.
Pazdro K., Zbiór zadań z chemii dla szkół ponadgimnazjalnych, Warszawa 2003.