Przeczytaj
Liczba elektronów w chmurze elektronowej atomów w układzie okresowym rośnie od jednego - w przypadku atomu wodoru (), a do stu osiemnastu - dla atomu oganesonu (). Aby poprawnie zapisać konfigurację elektronowąkonfigurację elektronową (strukturę elektronową) atomu, należy właściwie przyporządkować elektrony powłokompowłokom, podpowłokompodpowłokom i orbitalom. Przypisanie im konkretnych orbitali, czyli funkcji opisujących ich zachowanie, jest oparte o trzy bardzo ważne reguły: zakaz Pauliegozakaz Pauliego, reguła Hundareguła Hunda oraz zasada rozbudowy powłok. Konfiguracja elektronowa dla atomów różni się od tej dla jonów. W przypadku atomów liczba elektronów jest równa liczbie protonów, a w przypadku jonów te wartości są różne. Zapis konfiguracji elektronowej dla jonów rozpoczyna się od zapisu konfiguracji dla odpowiadającego mu atomu i jeśli mamy do czynienia z kationem, to liczbę elektronów musimy pomniejszyć, np. dla glinu o elektrony, a w przypadku anionu, np. chloru , należy tę liczbę elektronów odpowiednio zwiększyć o jeden.
Zakaz Pauliego
W atomie nie mogą istnieć elektrony posiadające takie same wartości wszystkich liczb kwantowych. Reguła ta tłumaczy, że jeden orbital, określany trzema liczbami kwantowymi: , oraz , może opisywać zachowanie maksymalnie dwóch elektronów, które różnić się będą spinową liczbą kwantową . W atomie nie istnieją elektrony o takich samych czterech liczbach kwantowych.
Reguła Hunda
Orbitale o takiej samej energii (zdegenerowane) zajmowane są po kolei, z jednakową orientacją spinu oraz w taki sposób, aby liczba niesparowanych elektronów była możliwie największa. Pary elektronów tworzą się dopiero po zajęciu przez pojedyncze elektrony wszystkich poziomów orbitalnychpoziomów orbitalnych podpowłoki.

Zasada rozbudowy powłok
Każdy układ fizyczny dąży do osiągnięcia stanu minimalnej energii, stąd też powłoki i podpowłoki obsadzane są przez elektrony, rozpoczynając od tych o najniższych energiach. Zajmowanie wyższych orbitali jest bardziej skomplikowane, bowiem energie kolejnych orbitali nie są uporządkowane wraz z kolejnym numerem powłok. Ma to związek z faktem, że każda kolejna powłoka rozdziela się na większą liczbę orbitali, a różnice energetyczne między tymi powłokami stają się coraz mniejsze.

Poniższy schemat przedstawia kolejność zajmowania przez elektrony poziomów energetycznych w oparciu o energię orbitali.

Zazwyczaj elektrony znajdujące się na ostatniej powłoce elektronowej (walencyjnej) to elektrony walencyjneelektrony walencyjne. Pozostałe elektrony wraz z jądrem atomowym nazywają się rdzeniem atomowym.
Powyższe reguły zapisu konfiguracji elektronowej wraz z informacjami, jakich wartości liczb kwantowych dostarczają nam dla powłok, pozwalają przewidzieć, ile maksymalnie elektronów może zawierać dana podpowłoka. Należy pamiętać, że pojedyncza klatka, reprezentująca poziom orbitalny, może zawierać maksymalnie dwa elektrony. Podpowłoka może być obsadzona przez dwa elektrony (podpowłoka typu posiada jeden poziom orbitalny wypełniony maksymalnie przez dwa elektrony). Podpowłokę może zajmować elektronów (podpowłoka typu posiada poziomy orbitalne, każdy z nich może zwierać maksymalnie po dwa elektrony, co w sumie daje elektronów). Natomiast podpowłokę może zajmować odpowiednio elektronów, ponieważ podpowłoka posiada pięć poziomów orbitalnych. Dlaczego? Poniższy przykład wyjaśni tę zasadę.
Przykład liczb kwantowych dla pierwszych powłok:
LICZBY KWANTOWE | ||
|---|---|---|
() | ||
() () | , , | |
() () () | , , , , , , | |
() () () () | , , , , , , , , , , , , | |
Na podstawie liczb kwantowych określ, ile form przestrzennych można przypisać poziomom orbitalnym ?
Konfigurację elektronową można przedstawić na trzy sposoby, wykorzystując:
oznaczenia literowe powłok, np.:
symbole orbitali (zapis symboliczny lub zapis symboliczny skrócony), np.:
zapis klatkowy dla :
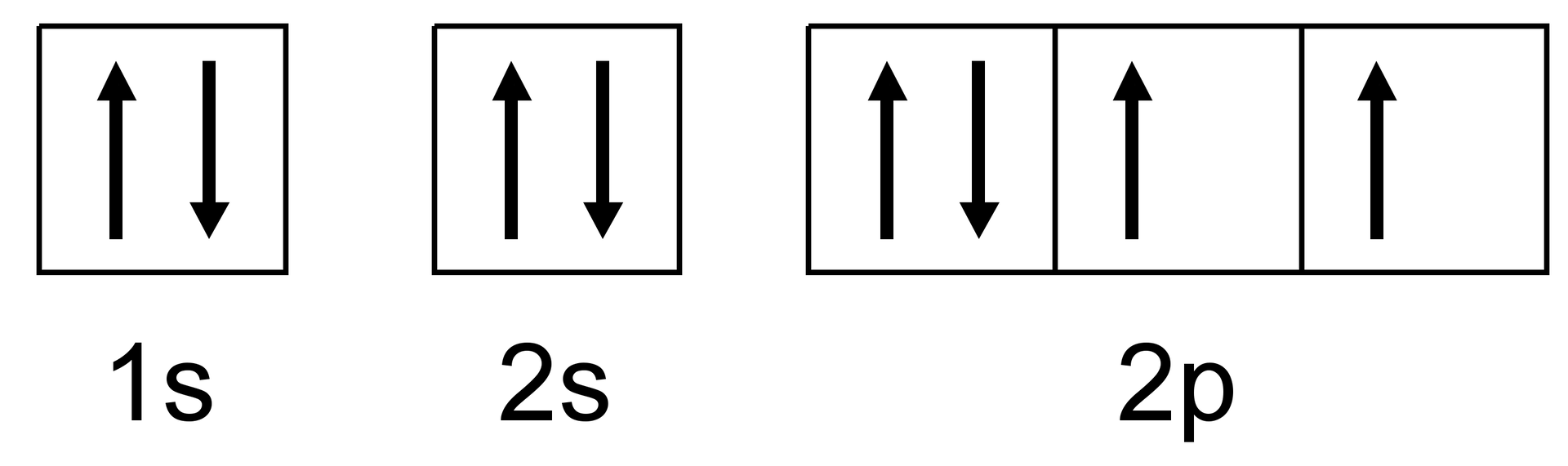
Wyjątki
Od podanych reguł istnieją wyjątki. Według zasad, konfiguracja elektronowa dla chromu powinna być następująca:
Jednak jest to zapis nieprawidłowy i właściwą konfiguracją jest:
Strata, wynikająca z odebrania elektronu z orbitalu , jest bardziej intratna, ponieważ orbitale o konfiguracji i są korzystniejsze energetycznie, trwalsze i posiadają dużą symetrię przestrzenną. Takie zjawisko nazywane jest promocjąpromocją. Występuje również dla miedzi, molibdenu i srebra.
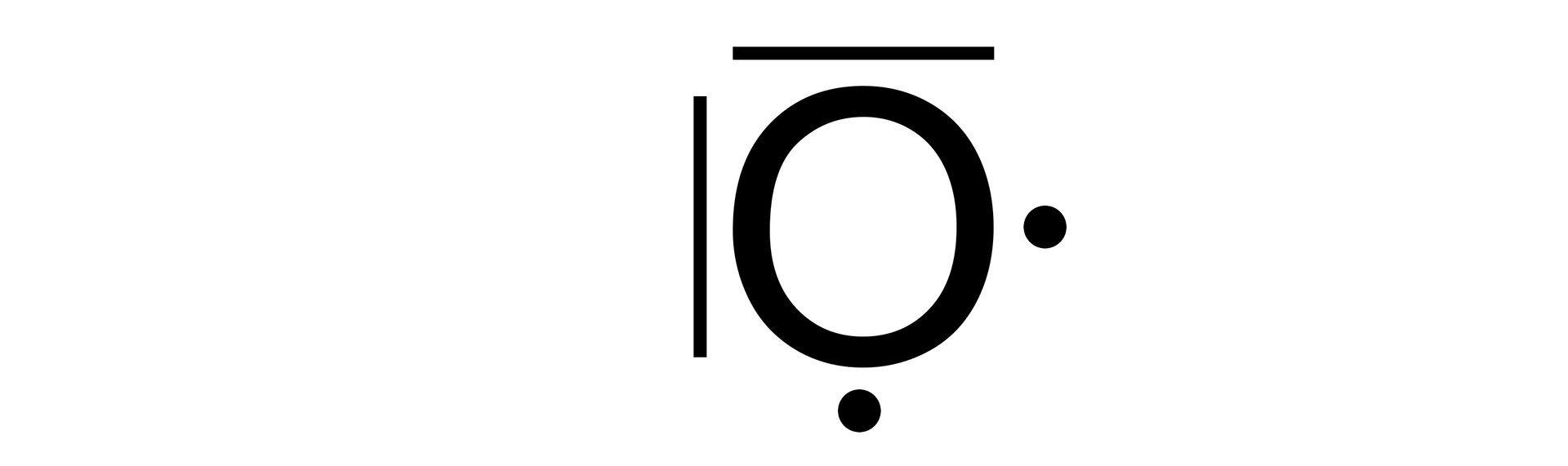
Konfigurację elektronów walencyjnych atomu można opisywać przy zastosowaniu wzoru Lewisa. Jest to elektronowy wzór strukturalny, w którym pary elektronów zaznacza się kreskami, a pojedyncze elektrony kropkami. Zatem konfiguracja elektronowa powłoki walencyjnej atomu tlenu () wygląda następująco:
Określ konfigurację elektronową atomu krzemu.
Słownik
to opis atomu, polegający na rozkładzie elektronów na podstawie prawdopodobieństwa ich położenia w atomie w funkcji odległości od jądra
w atomie nie mogą istnieć elektrony posiadające takie same wartości wszystkich liczb kwantowych
orbitale o takiej samej energii (zdegenerowane) zajmowane są po kolei, z jednakową orientacją spinu i tak, aby liczba niesparowanych elektronów była możliwie największa. Pary elektronów tworzą się dopiero po zajęciu przez pojedyncze elektrony wszystkich poziomów orbitalnych podpowłoki
zbiór elektronów o tej samej wartości głównej liczby kwantowej ()
zbiór elektronów, które posiadają taką samą wartość pobocznej liczby kwantowej ()
zbiór elektronów, zawierający takie same wartości dla głównej liczby kwantowej (), pobocznej liczby kwantowej () oraz magnetycznej liczby kwantowej ()
elektrony występujące na zewnętrznych powłokach elektronowych atomu, zajmujące orbitale o największej energii (dla danego pierwiastka); biorą udział w tworzeniu wiązań chemicznych i decydują o właściwościach pierwiastka
wszystkie elektrony znajdujące się na powłokach innych niż powłoki walencyjne
nieregularność w konfiguracji elektronowej, zapewniająca lepsze korzyści energetyczne
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia 2005.
