Przeczytaj
Jak komunikują się komórki?
Komórki mogą się ze sobą komunikować za pomocą sygnałów chemicznych – białek lub innych substancji. Komórka nadawcza uwalnia te związki chemiczne do przestrzeni międzykomórkowej, skąd mogą się przedostać w pobliże komórki docelowej. Sygnał chemiczny może zostać wysłany zarówno do komórki znajdującej się w sąsiedztwie nadawcy, jak również być transportowany na duże odległości, do komórek w odległych częściach ciała. To, na jaką komórkę zadziała dana cząsteczka sygnałowa, jest zależne od tego, czy ma ona specyficzny dla tej cząsteczki receptorreceptor. Komórka odpowie na przekazywaną informację tylko wtedy, gdy ligandligand połączy się z receptorem zakotwiczonym w jej błonie. Warto jednak pamiętać, że oprócz receptorów błonowych istnieją także receptory cytoplazmatyczne, w przypadku których specyficzne cząsteczki sygnałowe muszą najpierw przeniknąć przez barierę błony komórkowej.

Receptor sprzężony z białkiem G
Receptory sprzężone z białkiem Gbiałkiem G (GPCR) to duża rodzina receptorów metabotropowychreceptorów metabotropowych aktywowanych przez hormony i neurotransmitery, o podobnej budowie oraz mechanizmie działania. Pojedynczy receptor zbudowany jest z jednego łańcucha polipeptydowego, zakotwiczonego w błonie komórki. Na zewnątrz wystaje miejsce wiązania cząsteczki sygnałowej, którą może być hormon czy też neuroprzekaźnik, a od strony wnętrza komórki znajduje się miejsce wiązania białka G. Po związaniu receptora z odpowiednim ligandem dochodzi do aktywacji białka G, które z kolei aktywuje enzym prowadzący do wywołania odpowiedzi komórkowej. Do aktywacji białka G jest niezbędna wiążąca się z nim cząsteczka GTPGTP. Receptory sprzężone z białkiem G biorą udział w wielu ważnych procesach fizjologicznych, takich jak odbieranie bodźców zmysłowych, regulacja działania autonomicznego układu nerwowego, neuroprzekaźnictwo, a także reakcje na zażycie substancji psychoaktywnych.
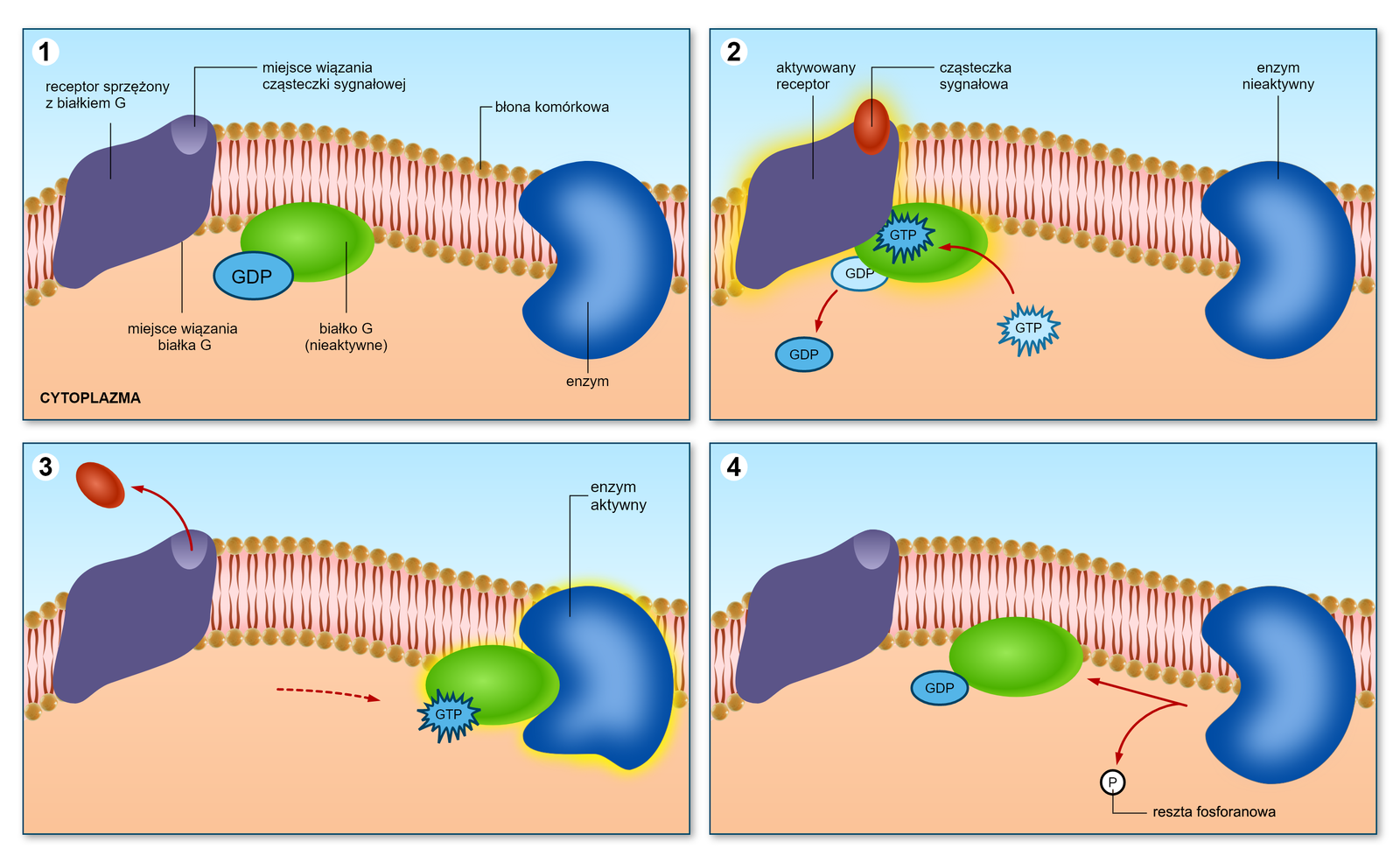
Dopóki receptor nie zwiąże się z ligandem, białko G związane jest z cząsteczką GDP i jest nieaktywne.
Po związaniu cząsteczki sygnałowej (liganda) do receptora zmienia on swoją konformację, co umożliwia związanie się z nim białka G, które odłącza GDPGDP, a w jego miejsce przyłącza się GTP. W ten sposób białko G ulega aktywacji.
Aktywne białko G łączy się z odpowiednim enzymem, aktywując go, co umożliwia wywołanie odpowiedzi komórkowej.
Po odłączeniu się cząsteczki sygnałowej od receptora GTP ulega hydrolizie do GDP, przez co białko G traci swoją aktywność i wraca do stanu wyjściowego.
Receptorowe kinazy tyrozynowe
Receptorowe kinazy tyrozynoweReceptorowe kinazy tyrozynowe są dużą klasą receptorów katalitycznychreceptorów katalitycznych o aktywności enzymatycznej kinazkinaz – katalizują przenoszenie grup fosforanowych z ATP na cząsteczki tyrozyny białka przekaźnikowego. Budowa receptora obejmuje zewnątrzkomórkowe miejsce wiązania liganda, część zakotwiczoną w błonie oraz wewnątrzkomórkowy ogon, zawierający cząsteczki tyrozyny. Receptor zyskuje swoją aktywność enzymatyczną dopiero po związaniu swoistego liganda, co w konsekwencji skutkuje autofosforylacją, a następnie fosforylacją innych białek (tzw. białek przekaźnikowych), co prowadzi do uruchomienia odpowiedzi komórkowej. Receptorowe kinazy tyrozynowe uczestniczą m.in. w przekazywaniu sygnałów związanych z regulacją cyklu komórkowego, a także procesami nowotworzenia. Mogą się wiązać z czynnikami wzrostuczynnikami wzrostu, promującymi podziały komórek, gojenie się ran czy utrzymanie neuronów przy życiu.

Dopóki z receptorem nie zwiąże się cząsteczka sygnałowa (ligand), występuje on w formie niezależnych polipeptydów.
Przyłączenie cząsteczki sygnałowej skutkuje połączeniem się łańcuchów polipeptydowych z wytworzeniem dimeru.
Dimeryzacja aktywuje region kinazy tyrozynowej w obu monomerach, umożliwiając przenoszenie reszt fosforanowych z ATP na tyrozyny drugiego z monomerów. Proces ten nazywa się autofosforylacją.
Do ufosforylowanych tyrozyn aktywnego białka receptorowego przyłączają się nieaktywne białka przekaźnikowe, które ulegają fosforylacji a tym samym aktywacji wywołując specyficzną odpowiedź komórkową.
Receptorowe kanały jonowe bramkowane ligandem
Kanały jonowe bramkowane ligandemKanały jonowe bramkowane ligandem to rodzaj receptorów jonotropowychreceptorów jonotropowych, które po przyłączeniu liganda są zdolne do zmiany konformacji, tworząc kanał dla różnych jonów. Tego typu receptory regulują przepływ jonów w poprzek błony komórkowej, co ma szczególne znaczenie w funkcjonowaniu komórek nerwowych przy przekazywaniu sygnału w synapsach.

Dopóki cząsteczka sygnałowa (ligand) nie przyłączy się do receptora, kanał pozostaje zamknięty dla jonów.
Po związaniu się liganda następuje otwarcie bramki, a swoiste jony mogą swobodnie przepływać przez kanał, prowadząc do wywołania odpowiedzi komórkowej.
Po odłączeniu liganda od receptora bramka ponownie się zamyka.
Zaburzenia w przekazywaniu sygnału przez receptory prowadzą do wielu różnych chorób, takich jak nowotwory, choroby serca czy astma. Ponadto, niektóre bakterie produkują toksyny, które zaburzają przekazywanie sygnałów przez białka G, a w konsekwencji – funkcjonowanie komórki. Przykładem takiej substancji jest toksyna botulinowa wydzielana przez pałeczkę jadu kiełbasianego.

Słownik
białka występujące w błonie komórkowej eukariontów; odbierają sygnały z zewnątrz komórki i przekazują je do białek efektorowych znajdujących się w jej wnętrzu; mają zdolność wiązania GTP
cząsteczka chemiczna pobudzająca komórki do podziałów komórkowych i wzrostu
guanozyno−5′−difosforan; organiczny związek chemiczny zbudowany z rybozy, guaniny i dwóch reszt kwasu pirofosforowego, zawierający jedno wiązanie wysokoenergetyczne; pełni rolę przenośnika energii
guanozyno−5′−trifosforan; organiczny związek chemiczny zbudowany z rybozy, guaniny i trzech reszt kwasu pirofosforowego, zawierający dwa wiązania wysokoenergetyczne; pełni rolę przenośnika energii
białkowy kanał transbłonowy dla jonów, którego otwarcie jest regulowane przez przyłączenie swoistego ligandu
duża grupa enzymów, które przenoszą grupy fosforanowe z ATP (lub innych nukleozydotrifosforanów) na różne związki z wytworzeniem ich pochodnych fosforanowych; są jedną z ważniejszych grup enzymów odpowiedzialnych za procesy regulacyjne; biorą udział np. w regulacji metabolizmu glikogenu i cyklu komórkowego, naprawie DNA, apoptozie oraz procesach nowotworowych
cząsteczka sygnalizacyjna zdolna do wiązania się ze specyficznym dla niej receptorem
wyspecjalizowana cząsteczka chemiczna o specyficznej budowie przestrzennej, mająca zdolność selektywnego wiązania cząsteczek sygnałowych (ligandów) przez oddziaływania międzycząsteczkowe
rodzaj receptora błonowego sprzężonego z kanałem jonowym działającym na zasadzie transportu biernego
receptor zawierający po stronie cytoplazmatycznej centrum katalityczne (zwykle kinazy białkowej) aktywowane przez cząsteczkę sygnałową, inicjujący reakcje prowadzące do zmiany ekspresji materiału genetycznego komórki lub jej funkcjonowania
receptor, którego pobudzenie wywołuje zmiany metaboliczne komórki
(RTK, ang. receptor tyrosine kinases) receptory powierzchniowe komórek; charakteryzują się aktywnością enzymatyczną kinaz
(GPCR, ang. G protein‑coupled receptor) rodzaj receptora błonowego, który po związaniu z ligandem przekazuje sygnał do komórki przez aktywację białka G