Reakcje chemiczne – podsumowanie
Substancje mogą powstawać w różny sposób, np. w wyniku połączenia się atomów pierwiastków chemicznych bądź na drodze rozpadu związków chemicznych. Temu powstawaniu może towarzyszyć wiele efektów. Zdarza się również, że reakcje przebiegają bez widocznych objawów. Niezależnie od tego, każdą z przemian chemicznych można opisać za pomocą równania reakcji. Aby takie równanie było czytelne i zrozumiałe dla wszystkich, przy jego konstruowaniu trzeba przestrzegać pewnych reguł.
1. Zjawisko fizyczne a przemiana chemiczna
Zjawisko fizyczne to przemiana, podczas której zmieniają się właściwości fizyczne substancji. W tym procesie nie powstają żadne nowe pierwiastki i związki chemiczne.
Przemiana chemiczna to z kolei proces, w którym jedne substancje przekształcają się w inne, o odmiennych właściwościach.

Które z poniższych przemian należą do fizycznych, a które do chemicznych? Dopasuj je do odpowiedniego miejsca w tabeli.
2. W jaki sposób przedstawiamy przebieg reakcji chemicznej?
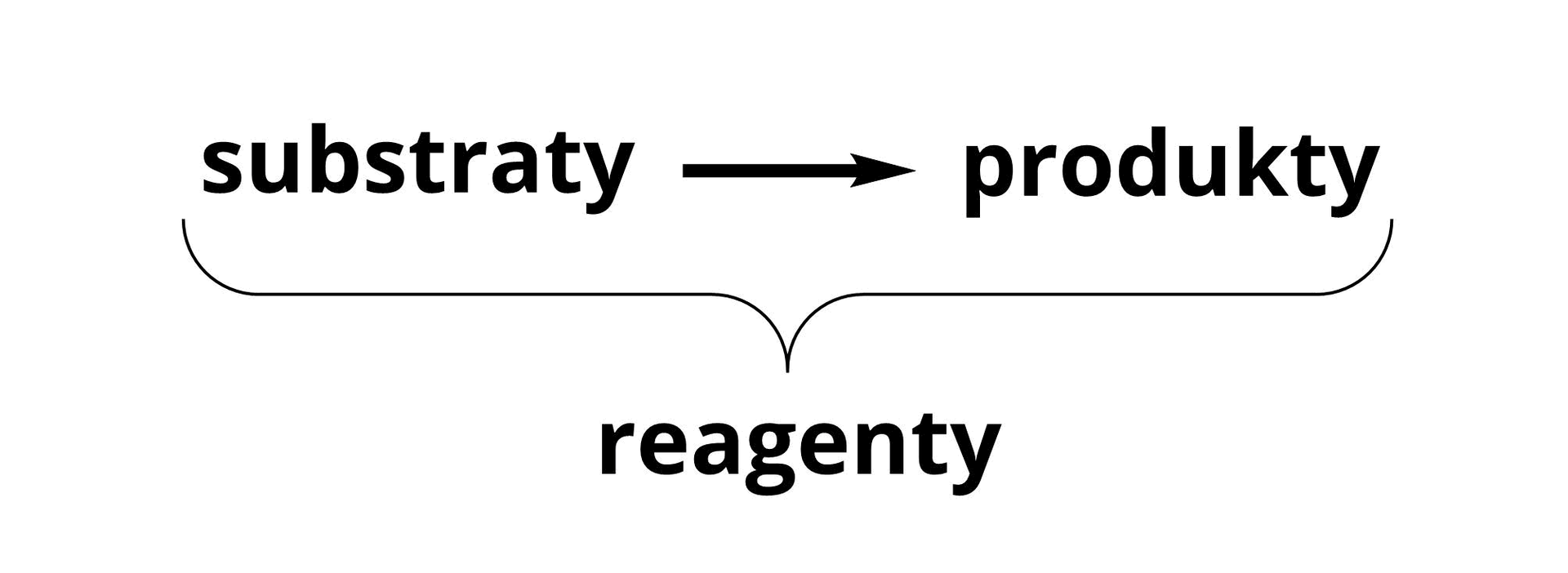
Substancje, które ulegają przemianom w wyniku reakcji chemicznej, to substraty, natomiast te, które w ich wyniku powstają, to produkty. Substraty oraz produkty czasami określamy wspólnie jako reagenty.
Przemianę chemiczną opisuje się za pomocą równania reakcji. Po jego lewej stronie zapisuje się substraty, po prawej zaś produkty. Przy użyciu strzałki zaznacza się kierunek reakcji – od substratów do produktów:
3. Jak możemy zapisywać równania reakcji chemicznych?
W równaniach reakcji można posługiwać się nazwami pierwiastków i związków chemicznych, ale najczęściej stosuje się symbole pierwiastków i wzory związków chemicznych.
Zapis z użyciem nazw substancji:
Zapis z użyciem symboli i wzorów chemicznych:
W poprawnie zapisanym równaniu, liczby atomów poszczególnych pierwiastków występujących po obu jego stronach są identyczne:

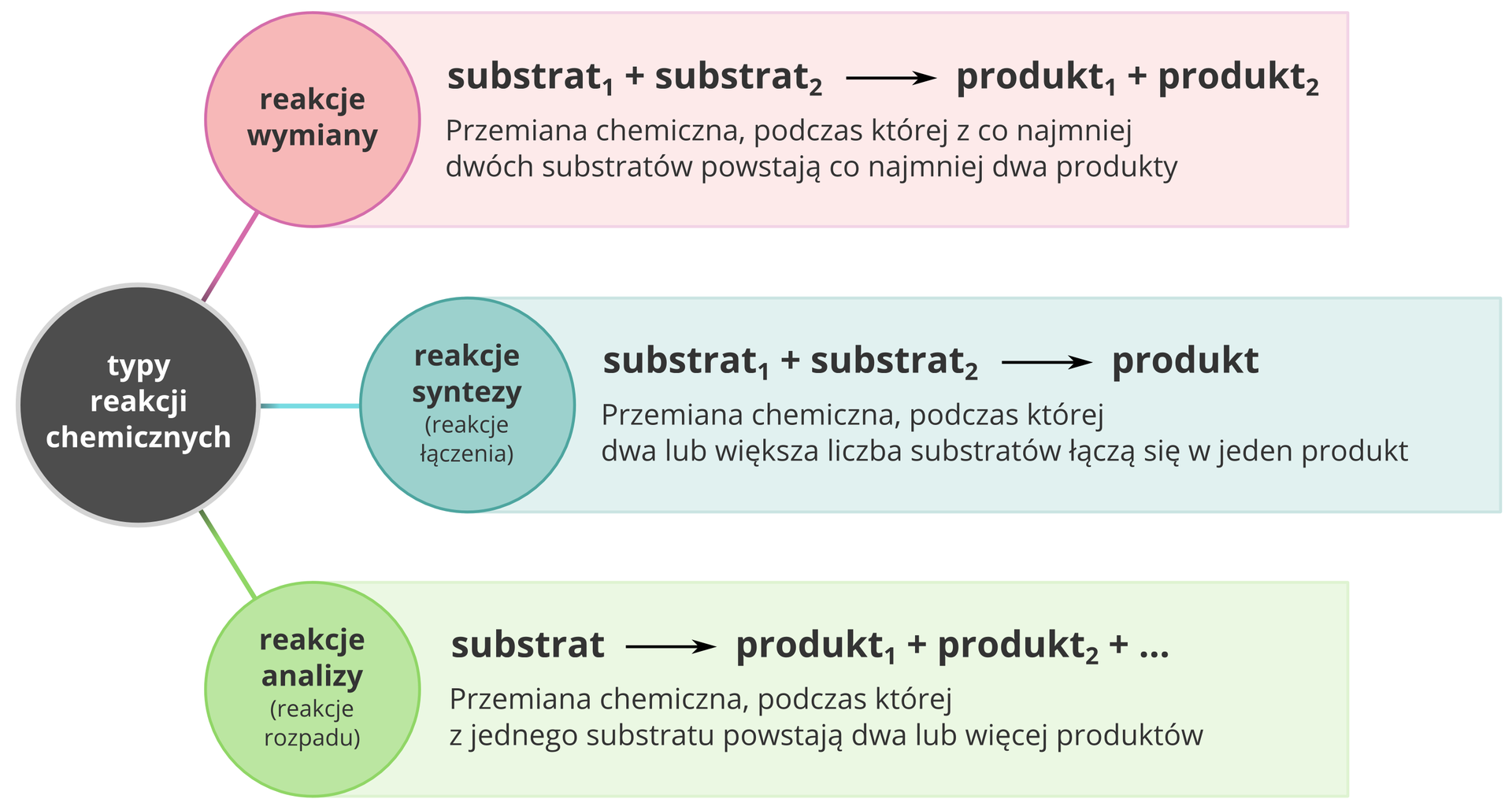
4. Jakie znamy rodzaje reakcji chemicznych?
5. Co to są reakcje egzoenergetyczne i endoenergetyczne?
Ze względu na towarzyszące reakcjom chemicznym efekty energetyczne, wyróżnia się reakcje egzotermiczne i endotermiczne.


6. Co to są: masa atomowa, masa cząsteczkowa?
Masa atomowa to masa jednego atomu pierwiastka chemicznego, wyrażona w atomowych jednostkach masy (unitach).
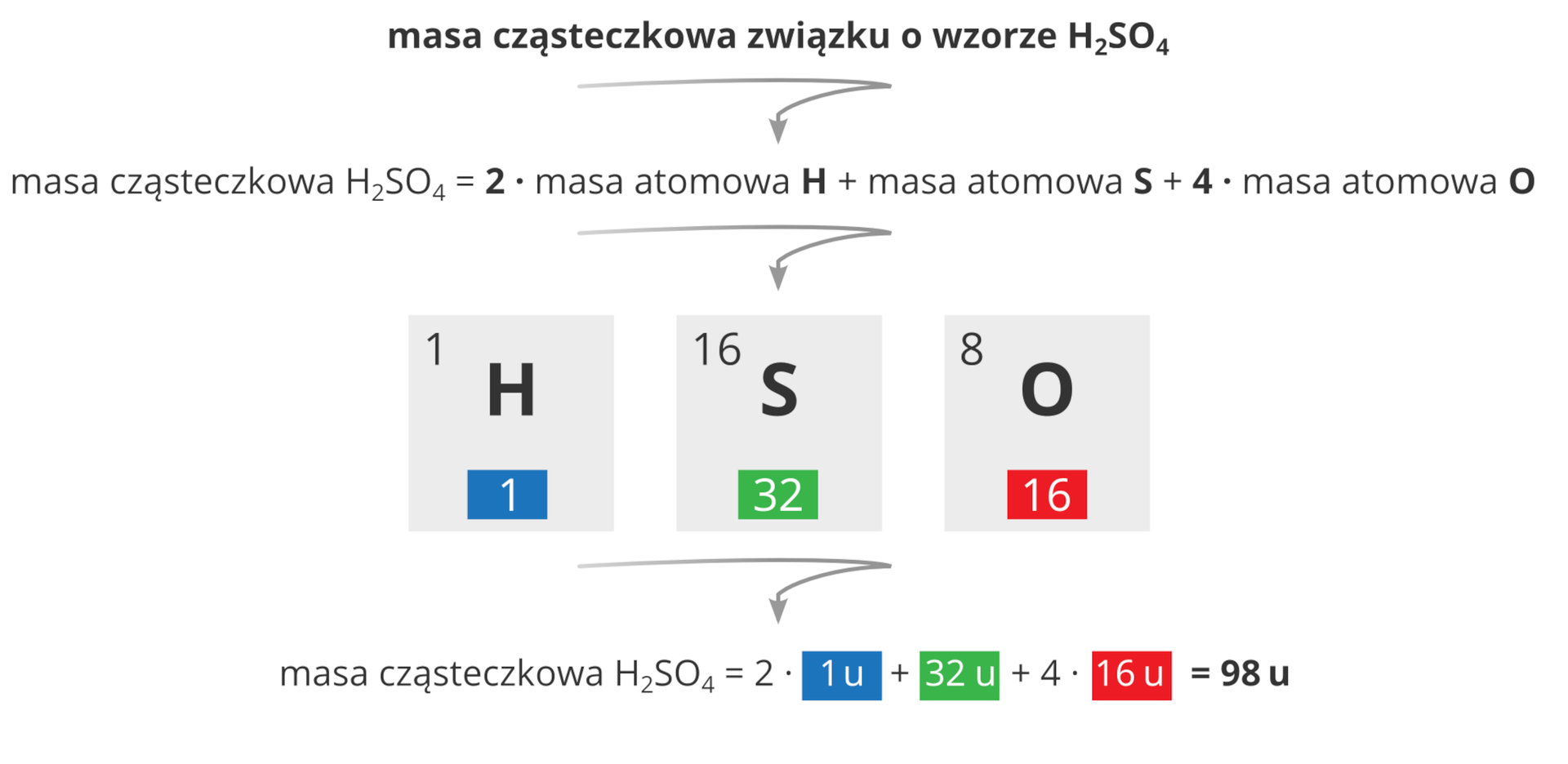
Masa cząsteczkowa to masa jednej cząsteczki (związku kowalencyjnego) bądź najmniejszego zbioru powtarzających się jonów (związek jonowy), wyrażona w atomowych jednostkach masy (unitach). Jest równa sumie mas atomowych pierwiastków, które wchodzą w skład najmniejszej struktury związku chemicznego, opisanej wzorem chemicznym związku.
7. Jak obliczamy stosunek masowy pierwiastków w związku chemicznym?
Stosunek masowy pierwiastków w związku chemicznym jest to stosunek mas atomów poszczególnych pierwiastków, które wchodzą w skład związku chemicznego.
Dla związku o wzorze ogólnym:
stosunek masowy pierwiastków jest następujący:

8. Jak obliczamy procentową zawartość pierwiastka w związku chemicznym?
Zawartość procentowa to udział masowy, jaki ma pierwiastek w całej masie związku chemicznego. Można ją obliczyć ze wzoru:



9. Prawo zachowania masy
Prawo zachowania masy mówi, że w układzie zamkniętym (w którym produkty reakcji nie opuszczają tego układu) łączna masa substratów jest równa sumie mas produktów. Oznacza to, że z tej samej masy substratów powstaje taka sama masa produktów – czyli podczas przemiany chemicznej masa substancji w niej uczestniczących nie ulega zmianie.

W reakcji spalania magnezu powstało tlenku magnezu. Oblicz masę tlenu, jaką zastosowano do procesu spalania, wiedząc, że spaleniu uległo magnezu.
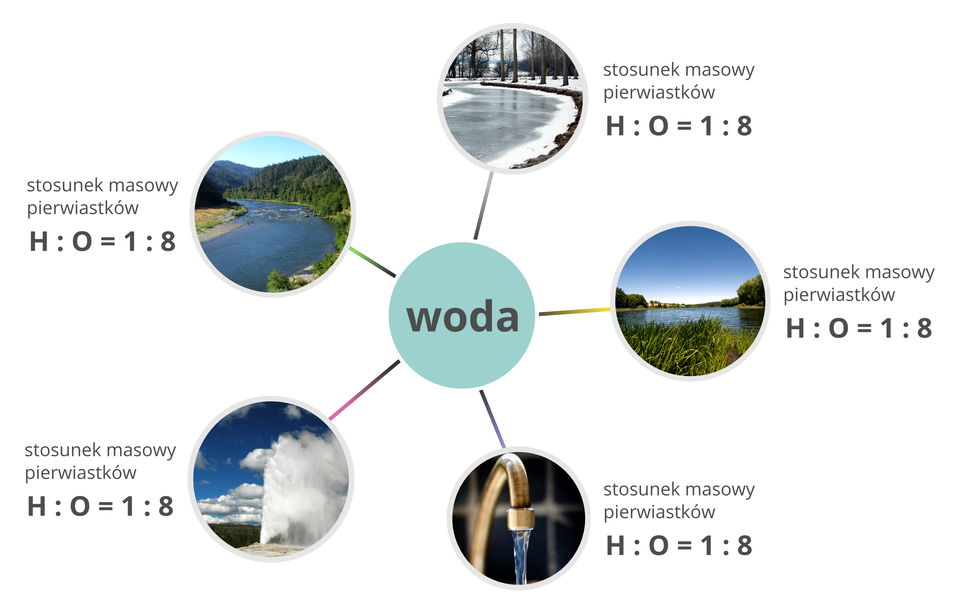
10. Czy związki chemiczne zawsze mają taki sam skład?
Zgodnie z prawem stałości składu stosunek mas pierwiastków tworzących związek chemiczny jest stały dla danego związku i nie zależy od miejsca oraz sposobu jego otrzymywania.
Cząsteczka wody zbudowana jest z dwóch atomów wodoru, których masa atomowa wynosi oraz atomu tlenu, którego masa atomowa wynosi .

Niektóre związki chemiczne nie mają zawsze takiego samego składu. Wobec tego nie spełniają prawa stałości składu związku chemicznego. Takie związki nazywamy bertolidami, czego przykładem może być tlenek żelaza o wzorze sumarycznym . W rzeczywistości stechiometria tego związku to . Przyczyną zmiennych składów niektórych związków chemicznych mogą być defekty sieci krystalicznych.
Ćwiczenia
Przyporządkuj i wstaw określenia w odpowiednie miejsce w poniższym równaniu reakcji.
, 1. reagenty, 2. substraty, 3. produkty
, , , 1. reagenty, 2. substraty, 3. produkty
Tlen reaguje z siarką, a w wyniku tej reakcji powstaje tlenek siarki. Na podstawie podanej informacji, zapisz równanie tej reakcji na dwa sposoby: pierwszy – stosując nazwy substratów i produktów; drugi – używając symboli i wzorów. Skorzystaj z podanych elementów.
luka do uzupełnienia tlen luka do uzupełnienia
Zapis za pomocą symboli i wzorów chemicznych:
luka do uzupełnienia luka do uzupełnienia
Które z poniższych przemian należą do fizycznych, a które do chemicznych? Dopasuj je do odpowiedniego miejsca w tabeli.
Do poniższych równań reakcji przyporządkuj ich typ.
reakcja egzotermiczna - 1. energia jest pobierana przez układ od otoczenia, 2. układ oddaję energię do otoczenia
Zapoznaj się z poniższym fragmentem artykułu, który dotyczy wybuchu w kopalni.
Przedstawiciele kopalni w czeskiej Karwinie podali, że w czwartek w tym zakładzie doszło do zapalenia się metanu, w konsekwencji czego na długości płonął jeden z chodników. Wskutek zdarzenia zginęło górników, w tym Polaków. Zakład Górniczy nr (dawna kopalnia „ČSM”) należy do koncernu OKD, jedynego producenta węgla kamiennego w Czechach.
Metan jest bezbarwnym gazem bez woni i smaku, lżejszym od powietrza. To główny składnik naturalnych gazów, często występujących w pokładach węgla. Pali się prawie nieświecącym płomieniem z błękitną aureolą. Tworzy z powietrzem wybuchową mieszaninę; wybucha, gdy jego stężenie w powietrzu mieści się w granicach od około do około .
Reakcja, która w takim przypadku zachodzi, jest reakcją: Możliwe odpowiedzi: 1. egzotermiczną., 2. endotermiczną.
While the dough was being prepared, yeast was mixed with sugar. The yeast slowly converted the sugar into other substances. After some time, it was noticed that the bowl with the mixture warmed up.
Check out the pancake recipe below.
Pour the flour into a bowl, add eggs, milk, water and salt.
Blend to a smooth dough.
Add melted butter or vegetable oil and blend together.
Pour a portions of a dough into a hot pan.
Fry the pancakes on a well–heated pan. Turn over when the bottom of the pancake is nicely browned.
Projekt badawczy
Twoim zadaniem będzie realizacja projektu badawczego, który możesz przeprowadzić samodzielnie lub w grupie. W tym celu ustal dokładny harmonogram eksperymentu, który pozwoli Ci na zweryfikowanie postawionej hipotezy. Zgromadź potrzebne materiały i sprzęt. Wyniki przedstaw w postaci dowolnej metody prezentacji – może być to krótki film, infografika, artykuł, plakat czy prezentacja multimedialna. Na samym końcu opisz, czego nowego dowiedziałaś/-łeś się podczas doświadczenia.
Tytuł projektu | Reakcje egzotermiczne | |
Temat projektu | Badanie zależności ilości energii wydzielonej w reakcji egzotermicznej od ilości (masy) użytych substratów | |
Hipoteza | Ilość energii wydzielanej podczas reakcji chemicznej jest stała i niezależna od ilości użytych w reakcji substratów. Ilość energii wydzielanej podczas reakcji chemicznej zmienia się i zależy od ilości użytych w reakcji substratów. Im więcej substratów bierze udział w reakcji egzotermicznej, tym więcej energii wydzieli się do otoczenia. | |
Materiały źródłowe | Doświadczenie własne | |
Uczeń | Co mam zrobić, by sprawdzić, czy hipoteza jest prawdziwa? | Przygotować próbki papieru o różnej masie (można dokonać podziału ze względu na liczbę arkuszy). |
Każdą próbkę zgnieść, umieścić w naczyniu (parownicy lub szkiełku zegarkowym) i podpalić. | ||
Po spaleniu, zmierzyć temperaturę naczynia od spodu z drugiej strony. | ||
Porównać temperatury z ilością użytego papieru. | ||
Podczas badania pamiętać, aby temperatura naczyń użytych do spalenia kartek była zawsze jednakowa, a sprawdzanie temperatury odbywało się zaraz po wypaleniu kartki. | ||
Co muszę przygotować, by zweryfikować hipotezę? | Papier jednego rodzaju, jednakowe parownice lub szkiełka zegarkowe, termometr do pomiaru temperatury na podczerwień (do badania temperatury ciała – czoła, w uchu). | |
Co będę obserwować (mierzyć)? | Temperatura naczynia, w którym przeprowadzano spalenie próbek papieru. | |
Jak długo prowadzić obserwacje? | Kilka godzin | |
W jaki sposób przedstawić wyniki? | Przygotowanie prezentacji w postaci plakatu lub w innej formie | |
Wniosek | ||
Czego się nauczyłem podczas projektu? |
Bibliografia
Kulawik J., Kulawik T., Litwin M., Podręcznik do chemii dla klasy siódmej szkoły podstawowej, Warszawa 2020.
Kulawik J., Kulawik T., Litwin M., Podręcznik do chemii dla klasy ósmej szkoły podstawowej, Warszawa 2020.
Łasiński D., Sporny Ł., Strutyńska D., Wróblewski P., Podręcznik dla klasy siódmej szkoły podstawowej, Kielce 2020.
Łasiński D., Sporny Ł., Strutyńska D., Wróblewski P., Podręcznik dla klasy ósmej szkoły podstawowej, Kielce 2021.
