Rozpuszczalność substancji – zadania
Wiedza na temat rozpuszczalności pozwala przewidzieć, ile maksymalnie gramów związku chemicznego może rozpuścić się w podanej ilości rozpuszczalnika (najczęściej wody), w danej temperaturze i pod stałym ciśnieniem. Umiejętność sporządzania roztworów nasyconych, nienasyconych i przesyconych jest wykorzystywana nie tylko w laboratorium chemicznym, ale także w życiu codziennym, choćby i przez cukierników, w czasie procesu wytwarzania znanych Ci zapewne cukierków – krówek.

w laboratorium chemicznym, jak i w codziennym życiu
definicję rozpuszczalnościrozpuszczalności;
pojęcie krzywej rozpuszczalności i sposób jej interpretacji;
sposób zmiany rozpuszczalności substancji w wyniku wzrostu temperatury.
interpretować krzywe rozpuszczalności w celu określenia rozpuszczalności substancji lub rodzaju roztworu (nasycony, nienasycony);
wykorzystywać dane zawarte na wykresach rozpuszczalności substancji do określania rodzaju roztworu (nasycony, nienasycony);
obliczać masę substancji, potrzebną do sporządzenia jej roztworu nasyconego w określonej temperaturze;
obliczać masę składników (substancji rozpuszczonej i rozpuszczalnika) roztworu nasyconego w ustalonej temperaturze.
1. Odczytywanie i interpretacja danych z wykresu rozpuszczalności
Na podstawie wykresu rozpuszczalności danej substancji (tzw. krzywej rozpuszczalności) możemy określić, ile gramów tej substancji rozpuści się w wody i utworzy roztwór nasycony w zadanych warunkach temperatury i ciśnienia. Możemy też przewidzieć, czy podana masa substancji może rozpuścić się w określonej masie wody.
Na liniowym wykresie interaktywnym przedstawiono rozpuszczalność podanych soli (w na wody). Krzywe rozpuszczalności dla każdej z soli zostały oznaczone innym kolorem.
azotan() potasu (linia pomarańczowa):
–
–
–
–
–
–
–
–
–
–
–
jodek potasu (linia żółta):
–
–
–
–
–
–
–
–
–
–
–
chlorek sodu (sól kuchenna) (linia żółtozielona):
–
–
–
–
–
–
–
–
–
–
–
chlorek potasu (linia jasnozielona):
–
–
–
–
–
–
–
–
–
–
–
azotan() sodu (linia zielona):
–
–
–
–
–
–
–
–
–
–
–
Na liniowym wykresie interaktywnym przedstawiono rozpuszczalność podanych soli (w na wody). Krzywe rozpuszczalności dla każdej z soli zostały oznaczone innym kolorem.
octan sodu (linia pomarańczowa):
–
–
–
–
–
–
sacharoza (cukier) (linia żółta):
–
–
–
–
–
–
szczawian amonu (linia zielona):
–
–
–
–
–
–
Ile gramów azotanu() sodu należy rozpuścić w wody, aby w temperaturze otrzymać roztwór nasycony?
Ile gramów azotanu() sodu należy rozpuścić w wody, aby w temperaturze otrzymać roztwór nasycony (taki, w którym w podanej ilości rozpuszczalnika, rozpuszczono maksymalną liczbę gramów substancji, jaka wynika z jej rozpuszczalności w danej temperaturze)?
Skorzystaj z poniższych wartości rozpuszczalności substancji w danej temperaturze.
Rozpuszczalność (w na wody)
azotan() potasu:
–
–
–
–
–
–
–
–
–
–
–
jodek potasu:
–
–
–
–
–
–
–
–
–
–
–
chlorek sodu (sól kuchenna):
–
–
–
–
–
–
–
–
–
–
–
chlorek potasu:
–
–
–
–
–
–
–
–
–
–
–
azotan() sodu:
–
–
–
–
–
–
–
–
–
–
–
Oblicz, w jakim stosunku masowym występują octan sodu i woda, w nasyconym roztworze, w temperaturze 20 °C.
Oblicz, w jakim stosunku masowym występują octan sodu i woda, w nasyconym roztworze, w temperaturze .
Skorzystaj z poniższych wartości rozpuszczalności w danej temperaturze, a następnie zaznacz poprawną odpowiedź.
Rozpuszczalność (w na wody)
octan sodu:
–
–
–
–
–
–
sacharoza (cukier):
–
–
–
–
–
–
szczawian amonu:
–
–
–
–
–
–
Korzystając z krzywej rozpuszczalności azotanu(V) potasu, określ, w jakiej temperaturze nasycony roztwór azotanu(V) potasu zawiera 169 g tej substancji i 100 g wody. Następnie obejrzyj film zamieszczony poniżej i zweryfikuj swoją odpowiedź.
Korzystając z wartości rozpuszczalności substancji w danej temperaturze, określ, w jakiej temperaturze nasycony roztwór azotanu() potasu zawiera tej substancji i wody. Następnie zapoznaj się z filmem zamieszczonym poniżej i zweryfikuj swoją odpowiedź.
Rozpuszczalność (w na wody)
azotan() potasu:
–
–
–
–
–
–
–
–
–
–
–
jodek potasu:
–
–
–
–
–
–
–
–
–
–
–
chlorek sodu (sól kuchenna):
–
–
–
–
–
–
–
–
–
–
–
chlorek potasu:
–
–
–
–
–
–
–
–
–
–
–
azotan() sodu:
–
–
–
–
–
–
–
–
–
–
–

Film dostępny pod adresem /preview/resource/RtuU3IX7he4AC
Zadanie <math aria‑label="trzecie">
Korzystając z krzywej rozpuszczalności azotanu(V) potasu, określ, czy
w 100 g wody, w temperaturze 20 °C, można rozpuścić 40 g azotanu(V) potasu. Następnie obejrzyj film zamieszczony poniżej i zweryfikuj swoją odpowiedź.
Korzystając z wartości rozpuszczalności substancji w danej temperaturze, określ, czy w wody, w temperaturze , można rozpuścić azotanu() potasu. Następnie zapoznaj się z filmem zamieszczonym poniżej i zweryfikuj swoją odpowiedź.
Rozpuszczalność (w na wody)
azotan() potasu:
–
–
–
–
–
–
–
–
–
–
–
jodek potasu:
–
–
–
–
–
–
–
–
–
–
–
chlorek sodu (sól kuchenna):
–
–
–
–
–
–
–
–
–
–
–
chlorek potasu:
–
–
–
–
–
–
–
–
–
–
–
azotan() sodu:
–
–
–
–
–
–
–
–
–
–
–

Film dostępny pod adresem /preview/resource/RZYuvctxIW0nA
Zadanie <math aria‑label="czwarte">
2. Obliczanie ilości substancji, którą można rozpuścić w określonej ilości wody
Z wykresu krzywej rozpuszczalności możemy odczytać, ile gramów substancji należy rozpuścić w wody, aby otrzymać roztwór nasycony w określonej temperaturze. Dokonując dalszych obliczeń, uzyskamy informację na temat masy substancji, którą można rozpuścić w dowolnej masie wody w podanej temperaturze.
Oblicz, ile gramów chlorku sodu należy odważyć, aby po rozpuszczeniu go w 250 g wody o temperaturze 90 °C, otrzymać nasycony roztwór tej substancji. Następnie obejrzyj poniższy film i zweryfikuj swoją odpowiedź.
Oblicz, ile gramów chlorku sodu należy odważyć, aby po rozpuszczeniu go w wody o temperaturze otrzymać nasycony roztwór tej substancji. Następnie zapoznaj się z poniższym filmem i zweryfikuj swoją odpowiedź.
Rozpuszczalność (w na wody)
azotan() potasu:
–
–
–
–
–
–
–
–
–
–
–
jodek potasu:
–
–
–
–
–
–
–
–
–
–
–
chlorek sodu (sól kuchenna):
–
–
–
–
–
–
–
–
–
–
–
chlorek potasu:
–
–
–
–
–
–
–
–
–
–
–
azotan() sodu:
–
–
–
–
–
–
–
–
–
–
–

Film dostępny pod adresem /preview/resource/R1XByAzkuNbKn
Zadanie <math aria‑label="piąte">
W oparciu o odpowiednie obliczenia, określ, czy roztwór chlorku sodu, który zawiera 74 g tej substancji w 200 g wody, w temperaturze 50 °C, jest roztworem nasyconym. Następnie obejrzyj film zamieszczony poniżej i zweryfikuj swoją odpowiedź.
W oparciu o odpowiednie obliczenia, określ, czy roztwór chlorku sodu, który zawiera tej substancji w wody, w temperaturze , jest roztworem nasyconym. Następnie zapoznaj się z filmem zamieszczonym poniżej i zweryfikuj swoją odpowiedź.
Rozpuszczalność (w na wody)
azotan() potasu:
–
–
–
–
–
–
–
–
–
–
–
jodek potasu:
–
–
–
–
–
–
–
–
–
–
–
chlorek sodu (sól kuchenna):
–
–
–
–
–
–
–
–
–
–
–
chlorek potasu:
–
–
–
–
–
–
–
–
–
–
–
azotan() sodu:
–
–
–
–
–
–
–
–
–
–
–
w temperaturze 50 °C jest roztworem nasyconym
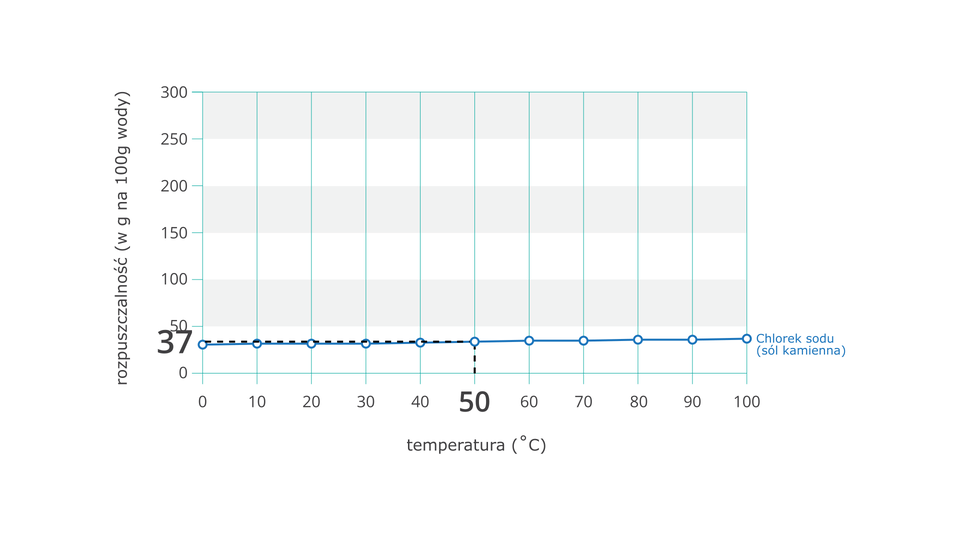
Film dostępny pod adresem /preview/resource/R1UPjamJR0Lfp
w temperaturze 50 °C jest roztworem nasyconym
Zadanie <math aria‑label="szóste">
3. Obliczanie ilości substancji znajdującej się w określonej masie roztworu nasyconego
Znając rozpuszczalność substancji w wodzie, możemy łatwo określić stosunki masowe między substancją rozpuszczoną a rozpuszczalnikiem w roztworze nasyconym, a także stosunki masowe pomiędzy substancją rozpuszczoną a samym roztworem. To z kolei pozwala nam obliczyć ilość substancji obecnej w dowolnej masie roztworu nasyconego, w określonej temperaturze.
Oblicz masę nasyconego roztworu chlorku potasu w temperaturze 60 °C, jeśli do jego sporządzenia użyto 100 g wody.
Oblicz masę nasyconego roztworu chlorku potasu w temperaturze , jeśli do jego sporządzenia użyto wody. Zaznacz poprawną odpowiedź.
Oblicz masę nasyconego roztworu cukru (sacharozy) w temperaturze 20 °C, jeśli do jego sporządzenia użyto 150 g wody.
Oblicz masę nasyconego roztworu cukru (sacharozy) w temperaturze , jeśli do jego sporządzenia użyto 150 g wody, a rozpuszczalnosć sacharozy w wodzie w temperaturze wynosi na 100 g wody.
Oblicz, ile gramów siarczanu(VI) miedzi(II) oraz wody znajduje się
w 241,4 g nasyconego roztworu tej substancji w temperaturze 20 °C, jeśli jej rozpuszczalność w tej temperaturze wynosi 20,7 g w 100 g wody. Następnie obejrzyj film zamieszczony poniżej i zweryfikuj swoją odpowiedź.
Oblicz, ile gramów siarczanu() miedzi() oraz wody znajduje się w nasyconego roztworu tej substancji w temperaturze , jeśli jej rozpuszczalność w tej temperaturze wynosi w wody. Następnie obejrzyj film zamieszczony poniżej i zweryfikuj swoją odpowiedź.

Film dostępny pod adresem /preview/resource/RklTC64DsZsmv
Zadanie <math aria‑label="dziewiąte">
Podsumowanie
Na podstawie znajomości rozpuszczalności substancji można:
określić ilość substancji, która rozpuści się w wody i dowolnej masie wody, tworząc w danej temperaturze roztwór nasycony;
ocenić, czy podana ilość substancji może rozpuścić się w określonej masie wody;
określić rodzaj otrzymanego roztworu (nasycony, nienasycony).
Znajdź w internecie informacje na temat zawartości cukru w popularnego napoju typu cola. Załóż, że dysponujesz wodnym roztworem cukru o objętości i masie , w którym znajduje się taka sama ilość cukru, jak w napoju typu cola. Oblicz, ile gramów cukru należałoby dodatkowo użyć na etapie przygotowywania roztworu, aby uzyskać nasyconego roztworu cukru w temperaturze .
Po odszukaniu w internecie odpowiedniej informacji, zadanie możesz rozwiązać analogicznie do poniższego przykładu.
Słownik
zdolność substancji do tworzenia z inną substancją (rozpuszczalnikiem) roztworu (mieszaniny jednorodnej); w tym materiale rozpuszczalność należy rozumieć jako maksymalną liczbę gramów substancji rozpuszczonej, jaką można rozpuścić w wody w zadanych warunkach temperatury (i ciśnienia)
wykres obrazujący zależność rozpuszczalności substancji od temperatury
roztwór (mieszanina jednorodna), w którym znajduje się maksymalna ilość (liczba gramów) substancji rozpuszczonej, jaka wynika z jej rozpuszczalności w podanych warunkach temperatury (i ciśnienia)
roztwór, w którym w danej temperaturze można rozpuścić jeszcze pewną ilość (liczbę gramów) substancji
roztwór, w którym znajduje się więcej substancji rozpuszczonej, niż wynika to z jej rozpuszczalności w danej temperaturze; roztwór przesycony jest niestabilny (nietrwały) – nadmiar substancji rozpuszczonej łatwo krystalizuje (wytrąca się z roztworu w postaci osadu), np. podczas wstrząsu, dlatego też otrzymanie roztworu przesyconego jest bardzo trudne; przykładem roztworu przesyconego jest miód
Ćwiczenia
Jaką maksymalną ilość gramów azotanu(V) sodu można rozpuścić w 100 g wody w temperaturze 100°C? Wskaż prawidłową odpowiedź.
- 180 g
- 280 g
- 100 g
- 246 g
- 73 g
Jaką maksymalną ilość gramów azotanu(V) potasu można rozpuścić w 300 g wody w temperaturze 90°C? Wskaż prawidłową odpowiedź.
- 606 g
- 202 g
- 404 g
- 162 g
- 302 g
Jaką masę ma nasycony roztwór chlorku potasu powstały po rozpuszczeniu odpowiedniej ilości tej substancji w 400 g wody w temperaturze 10°C? Wskaż poprawną odpowiedź.
- 524 g
- 124 g
- 31 g
- 131 g
- 431 g
W jakim stosunku masowym są wobec siebie woda i siarczan(VI) miedzi(II) w nasyconym roztworze tej substancji w temperaturze 30°C? Rozpuszczalność tej soli w tych warunkach wynosi 25 g w 100 g wody.
Uporządkuj substancje według ich rosnącej rozpuszczalności w podanych roztworach:
– roztwór chlorku sodu w temperaturze 90°C,
– roztwór chlorku potasu w temperaturze 70°C,
– roztwór siarczanu(VI) miedzi(II) w temperaturze 60°C,
– roztwór azotanu(V) potasu w temperaturze 30°C,
– roztwór azotanu(V) sodu w temperaturze 0°C.
- roztwór azotanu(V) potasu
- roztwór chlorku potasu
- roztwór azotanu(V) sodu
- roztwór chlorku sodu
- roztwór siarczanu(VI) miedzi(II)
Oblicz, ile gramów cukru znajduje się w 1216 g nasyconego roztworu tej substancji w temperaturze 20°C. Wskaż prawidłową odpowiedź.
- 816 g
- 400 g
- 1216 g
- 204 g
- 304 g
Oblicz, ile gramów wody znajduje się w 584 g nasyconego roztworu jodku potasu w temperaturze 80°C. Wskaż prawidłową odpowiedź.
- 200 g
- 100 g
- 192 g
- 384 g
- 484 g
Calculate, in which solution is more water: in of sodium chloride solution at or in potassium chloride solution at .
Przeczytaj poniższy tekst i odpowiedz na pytanie, w jaki sposób można wykorzystać roztwory przesycone w farmacji. W razie potrzeby skorzystaj ze słownika znajdującego się w podpowiedzi.
„(...) The characteristics of supersaturation have practical applications in terms of pharmaceuticals. By creating a supersaturated solution of a certain drug, it can be ingested in liquid form. The drug can be made driven into a supersaturated state through any normal mechanism and then prevented from precipitating out by adding precipitation inhibitors. Drugs in this state are referred to as „supersaturating drug delivery services”, or „SDDS”. Oral consumption of a drug in this form is simple and allows for the measurement of very precise dosages. Primarily, it provides a means for drugs with very low solubility to be made into aqueous solutions (...)”.
Źródła:
Bevernage, Jan; Brouwers, Joachim; Brewster, Marcus E.; Augustijns, Patrick (2013). „Evaluation of gastrointestinal drug supersaturation and precipitation: Strategies and issues”. International Journal of Pharmaceutics (1): 25–35, 453.
Brouwers, Joachim; Brewster, Marcus E.; Augustijns, Patrick (Aug 2009). „Supersaturating drug delivery systems: the answer to solubility‑limited oral bioavailability?”. Journal of Pharmaceutical Sciences (8): 2549–2572, 98.
Augustijns (2011). „Supersaturating drug delivery systems: Fast is not necessarily good enough”. Journal of Pharmaceutical Sciences (1): 7–9, 101.
Bibliografia
Encyklopedia PWN.
Kaznowski K., Pazdro K. M., Chemia. Podręcznik do liceów i techników, cz. 1, Warszawa 2019.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1. Chemia ogólna i nieorganiczna. Zakres rozszerzony, Warszawa 2012.