Sprawdź się
Zaznacz poprawne odpowiedzi.
W cząsteczkach kwasów karboksylowych występuje polarna grupa karboksylowa, w której skład wchodzi:
- grupa karbonylowa
- grupa hydroksylowa
- grupa amidowa
- grupa ketonowa
Zaznacz poprawną odpowiedź.
W celu określenia mocy kwasu organicznego używa się:
- stałej dysocjacji.
- pH-metru.
- oznaczenia elektroujemności.
Poniżej zamieszczono tabelę zawierającą informacje na temat właściwości fizycznych wybranych, nasyconych kwasów jednokarboksylowych.
Nazwa zalecana | Temperatura wrzenia [°C] | Temperatura topnienia [°C] | Gęstość [] | Rozpuszczalność [] |
|---|---|---|---|---|
Kwas mrówkowy | 101 | 8 | 1,21 | nieograniczona |
Kwas octowy | 118 | 18 | 1,04 | nieograniczona |
Kwas butanowy | 163 | -5 | 0,95 | nieograniczona |
Kwas pentanowy | 187 | -35 | 0,94 | 3,7 |
Analizując dane w tabeli oraz na podstawie posiadanych informacji, uzupełnij zdanie:
wzrasta, cieczy, maleje, gazów, maleje, wzrasta, maleje, ciał stałych, wzrasta
W szeregu homologicznym, ze wzrostem liczby atomów węgla w cząsteczce, zmienia się stan skupienia od ............................ do ............................, ............................ temperatura wrzenia, ............................ gęstość, a także ............................ rozpuszczalność w wodzie i ............................ reaktywność.
Poniższa tabela przedstawia temperatury topnienia i wrzenia wybranych kwasów karboksylowych.
Nazwa kwasu | Wzór kwasu | Temperatura topnienia [°C] | Temperatura wrzenia [°C] |
|---|---|---|---|
Kwas octowy | 16,6 | 117,9 | |
Kwas stearynowy | 69,3 | 360,0 (rozkłada się) | |
Kwas oleinowy | 16,2 | 360,0 |
Na podstawie tabeli określ stan skupienia każdego z kwasów w temperaturze 25°C.
Przedstaw, za pomocą równań reakcji, przemiany zaznaczone na poniższym schemacie:
Przedstaw, za pomocą równań reakcji, przemiany opisane na schemacie.

Uczniowie otrzymali do identyfikacji następujące kwasy: oleinowy, mrówkowy, szczawiowy. W probówce nr 1 znajduje się kwas, który tworzy biały osad z roztworem . W probówce nr 2 znajduje się kwas, powodujący odbarwienie roztworu bromu. W probówce nr 3 znajduje się kwas, który w temperaturze pokojowej jest cieczą, dobrze rozpuszczalną w wodzie. Na podstawie powyższych informacji zidentyfikuj kwasy, pisząc odpowiednie równania reakcji (informacja nr 1 i 2). Uszereguj te kwasy wg zmniejszającego się ich charakteru kwasowego, do porównania mocy wykorzystaj wartości stałych dysocjacji kwasów.
, , , , , kwas oleinowy, kwas mrówkowy, kwas szczawiowy, , , , kwas oleinowy, kwas mrówkowy, kwas szczawiowy
Probówka 1. ................................................
Równanie reakcji:
................................................ ................................................ ................................................ ................................................ ................................................
Probówka 2. ................................................
Równanie reakcji:
................................................ ................................................ ................................................
Probówka 3. ................................................
Malejący charakter kwasowy tych związków:
................................................ > ................................................ > ................................................
Przeprowadzono doświadczenie opisane schematycznym rysunkiem:
Przeprowadzono doświadczenie. Zapoznaj się z opisem ilustracji.
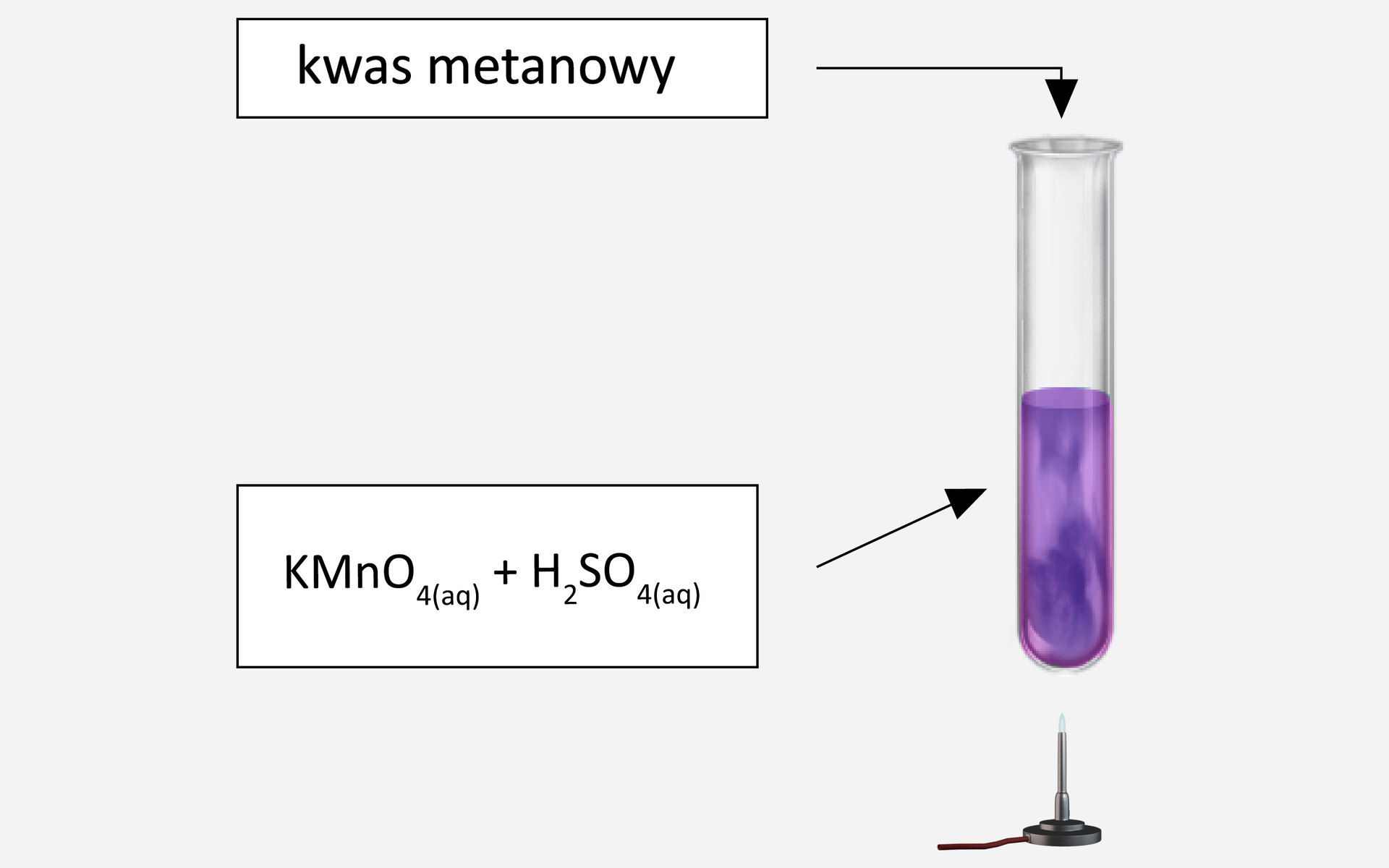
Obserwacje: fioletowy roztwór ulega odbarwieniu, wydziela się bezbarwny gaz.
Analizując budowę cząsteczki kwasu metanowego, wyjaśnij jakie jego właściwości spowodowały przebieg reakcji w doświadczeniu.
Przeprowadzono doświadczenie przedstawione schematycznym rysunkiem:
Przeprowadzono doświadczenie. Zapoznaj się z jego opisem.
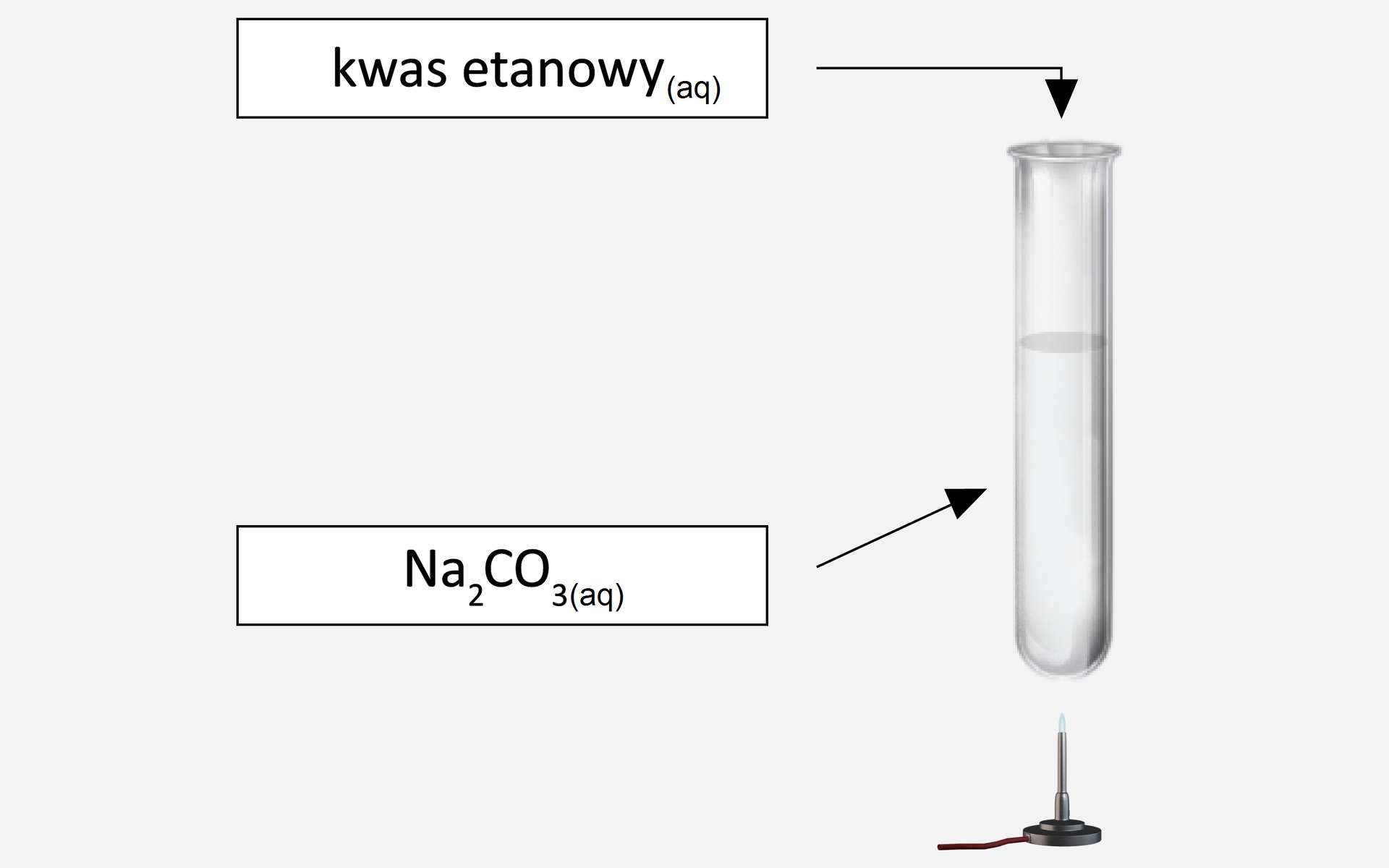
Podaj obserwacje i wnioski. Zapisz równanie zachodzącej reakcji chemicznej lub zaznacz, że reakcja nie zachodzi.
, gaz, , , , bezbarwny, , , ostry, , , , , , , charakterystyczny
Obserwacje:
Wydziela się .................................., bezwonny ...................................
Wnioski:
Zachodzi reakcja zgodnie z równaniem:
.................................. .................................. .................................. .................................. .................................. ...................................