Sprawdź się
Zaznacz poprawną odpowiedź.
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9.
Manganian() potasu wykorzystywany jest do laboratoryjnego otrzymywania tlenu. Zapisz sumaryczne równanie reakcji tej metody.
Ustal, które z przedstawionych poniżej równań reprezentują reakcje utleniania‑redukcji. W każdym z równań dobierz współczynniki stechiometryczne, przy czym w równaniach reakcji utleniania‑redukcji zastosuj metodę bilansu jonowo‑elektronowego.
W pracowni chemicznej chlor otrzymuje się, działając kwasem solnym na manganian() potasu (metoda ) lub na tlenek manganu() (metoda ). Napisz równania reakcji otrzymywania chloru opisanymi metodami, dobierając współczynniki metodą bilansu jonowo‑elektronowego.
W laboratoriach chemicznych związki manganu wykorzystywane są do oznaczeń analitycznych wielu substancji – do tzw. miareczkowania manganometrycznego. Za pomocą manganianu() potasu, w środowisku kwasowym, można oznaczyć stężenie, np. nadtlenku wodoru czy kwasu szczawiowego.
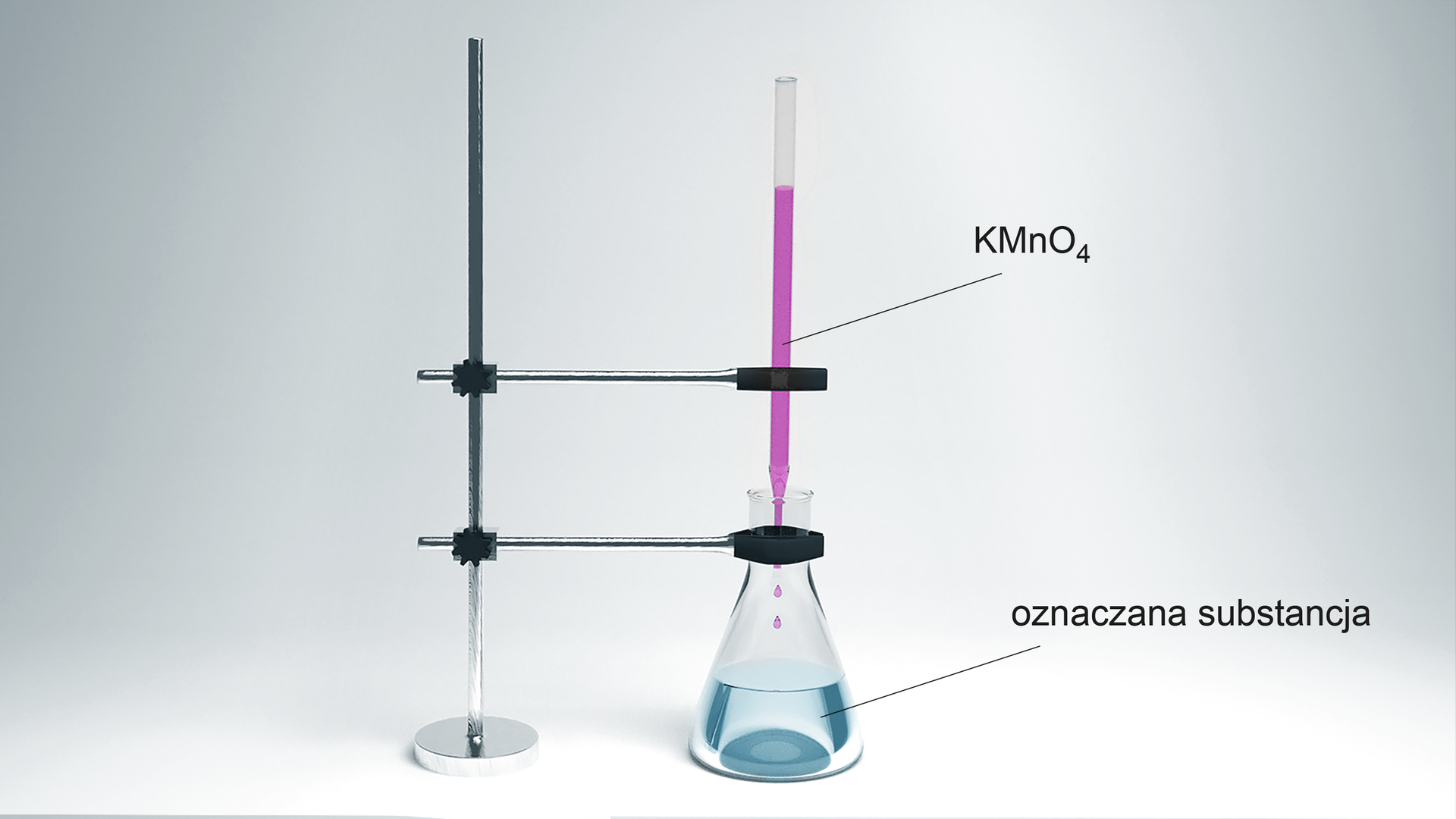
Poniższe równania reakcji obrazują metody analitycznego oznaczania nadtlenku wodoru i kwasu szczawiowego. Metodą bilansu jonowo‑elektronowego dobierz współczynniki stechiometryczne w podanych równaniach reakcji.
W celu określenia stężenia roztworu azotanu() sodu, roztwór ten zakwaszono i poddano procesowi miareczkowania manganometrycznego. Napisz, jaka wizualna zmiana pozwoli na określenie punktu końcowego miareczkowania w tym układzie.

Eten z manganianem() potasu w roztworze obojętnym tworzy glikol etylenowy, tlenek manganu() oraz wodorotlenek potasu. Zapisz równanie zachodzącej reakcji chemicznej w formie cząsteczkowej. Współczynniki dobierz metodą bilansu jonowo‑elektronowego.