Sprawdź się
Szybkość reakcji chemicznej opisywana jest przez zmianę stężenia substratów lub zmianę stężenia produktów w jednostce czasu.
Zamknięty pojemnik o objętości 2 dmIndeks górny 33 wypełniono 0,28 g wodoru i chlorem. W czasie 10 s masa wodoru zmniejszyła się do 0,024 g. Oblicz szybkość reakcji.
Opisz, jak wpływa zmiana stężenia substratów na szybkość reakcji chemicznej.
Oblicz, jak zmieni się szybkość reakcji chemicznej, która przebiega wg równania kinetycznego , jeżeli wartości stężeń substratów zmaleją trzykrotnie.
Poniżej zamieszczono wykres, na którym przedstawiono zależności objętości wydzielającego się wodoru od czasu przebiegu pewnych reakcji w wodnych roztworach kwasu siarkowego(VI). Reakcje były przeprowadzane dla dwóch różnych stężeń tego kwasu.
Opisano wykres, na którym przedstawiono zależności wydzielającego się wodoru od czasu przebiegu pewnych reakcji w roztworach kwasu siarkowego(VI). Reakcje były przeprowadzane dla dwóch różnych stężeń tego kwasu.
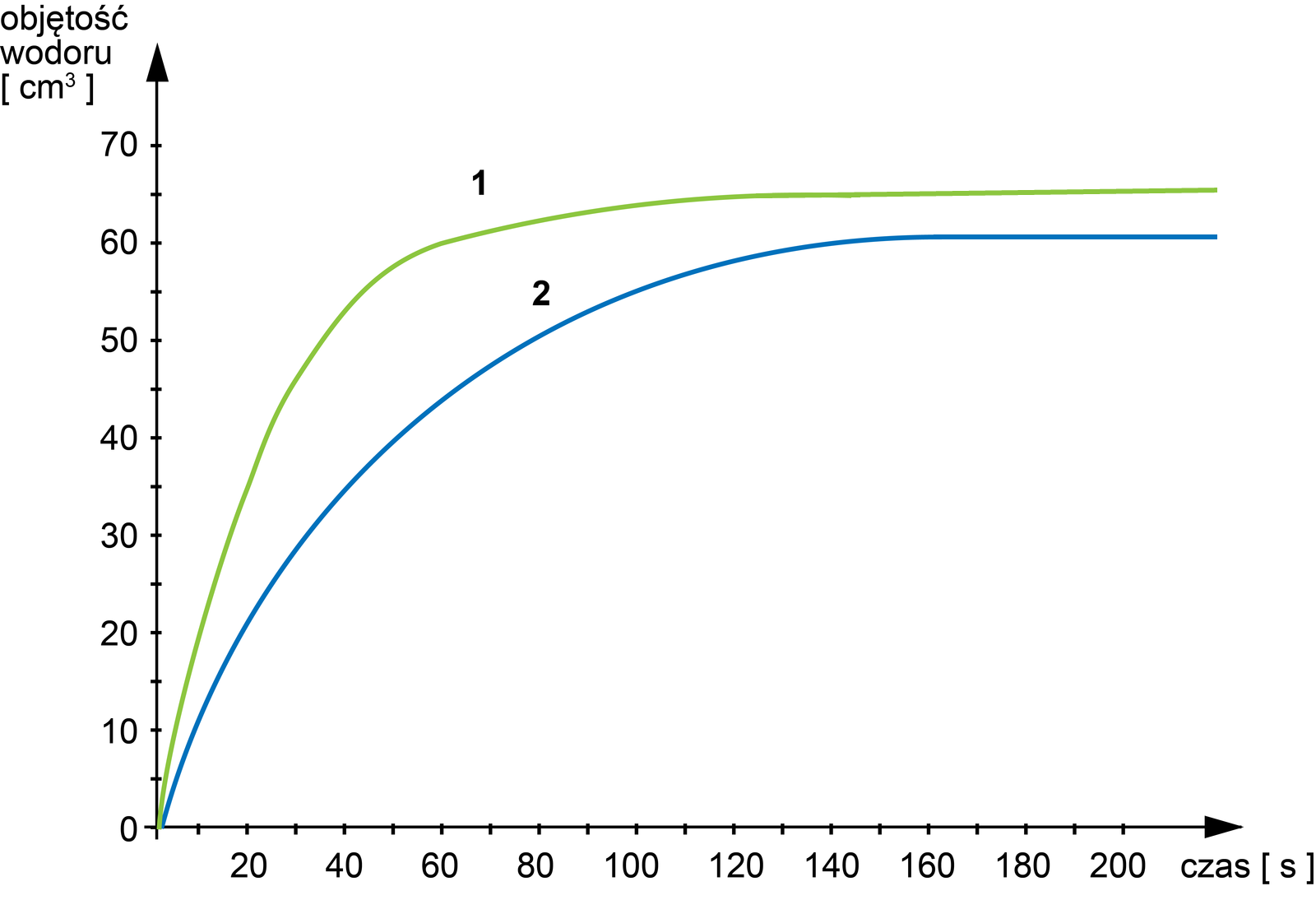
Na podstawie analizy przebiegu krzywych wskaż i uzasadnij, który z wykresów (1. czy 2.) przedstawia zmianę objętości wydzielającego się wodoru w roztworze kwasu o większym stężeniu oraz wyjaśnij, czym spowodowany jest taki kształt krzywych.
Podczas zajęć studenci przeprowadzili doświadczenie, które jest zilustrowane poniższym rysunkiem.
Podczas zajęć studenci przeprowadzili doświadczenie. Zapoznaj się z jego opisem.

Studenci zaobserwowali, że w probówce nr 3 gaz wydziela się intensywniej niż w probówce nr 2 i nr 1. Najwolniejsze wydzielanie gazu zaobserwowali w probówce nr 1.
Na podstawie podanych informacji napisz, jaki czynnik i w jaki sposób wpłynął na szybkość reakcji.
Zaprojektuj doświadczenie ukazujące wpływ stężenia reagentów na szybkość reakcji chemicznej. Zanotuj obserwacje, wnioski oraz jeśli to możliwe zachodzącą reakcje chemiczną.
Do dyspozycji masz:
trzy probówki zawierające po kwasu chlorowodorowego o stężeniach kolejno , , ;
wstążka magnezowa;
termometr.
Równanie kinetyczne pewnej reakcji chemicznej przebiegającej w fazie gazowej, w temperaturze pokojowej ma postać:
Reakcja ta przebiega zgodnie z równaniem: .
Początkowe stężenie substratu A było równe , a początkowa szybkość opisanej reakcji, zachodzącej w temperaturze pokojowej, wynosiła . Wyznacz chwilowe stężenia substratu A i produktu C oraz chwilowe wartości szybkości reakcji w czasie 10 sekund od jej rozpoczęcia. W tym celu uzupełnij poniższą tabelę. Wszystkie wartości stężeń i szybkości reakcji podaj z dokładnością do trzeciego miejsca po przecinku.