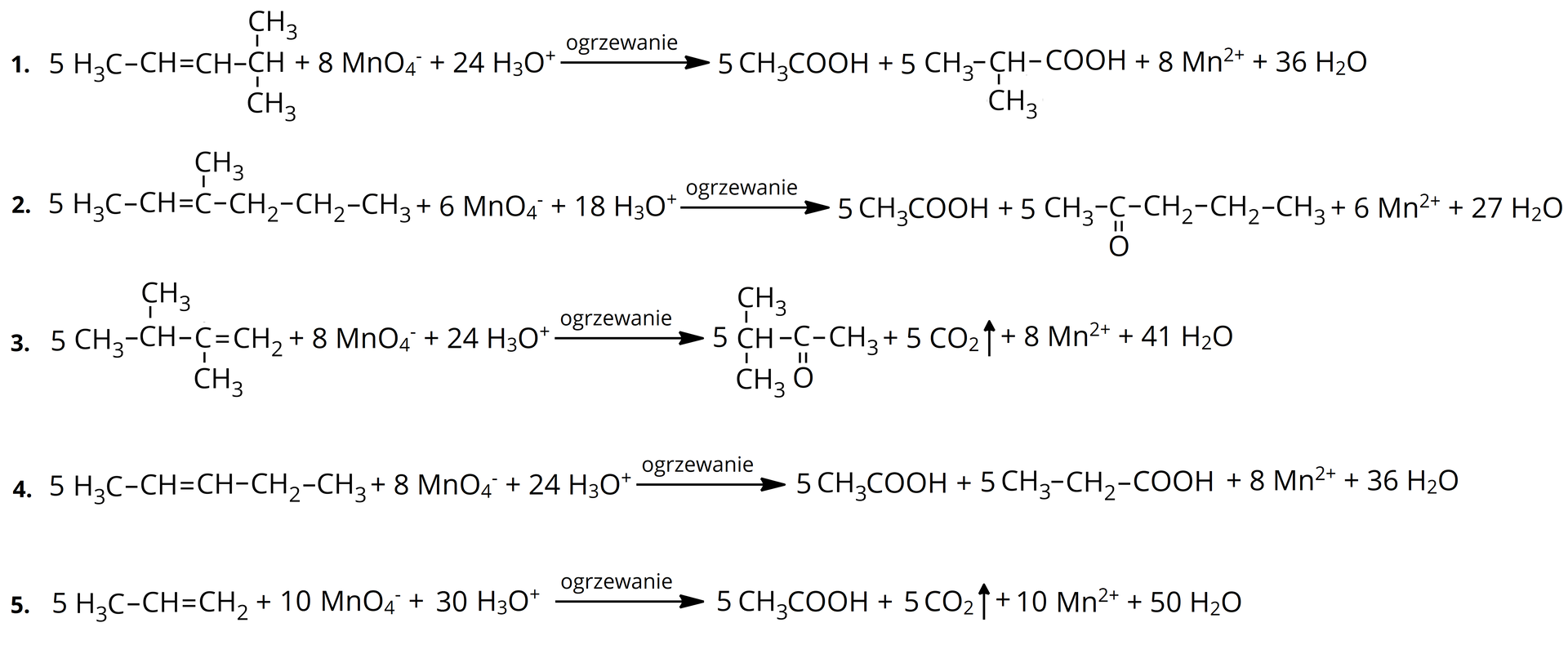
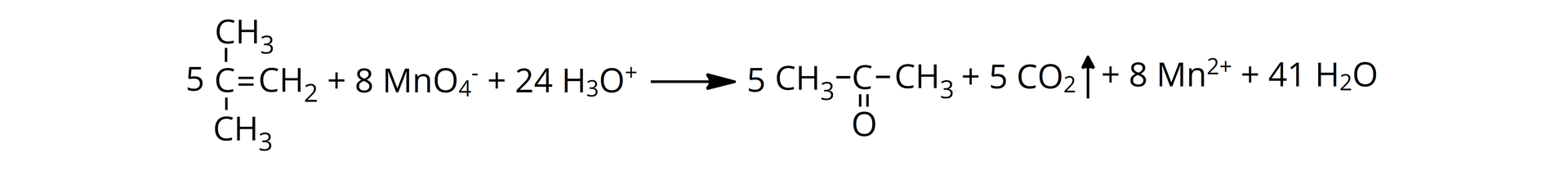
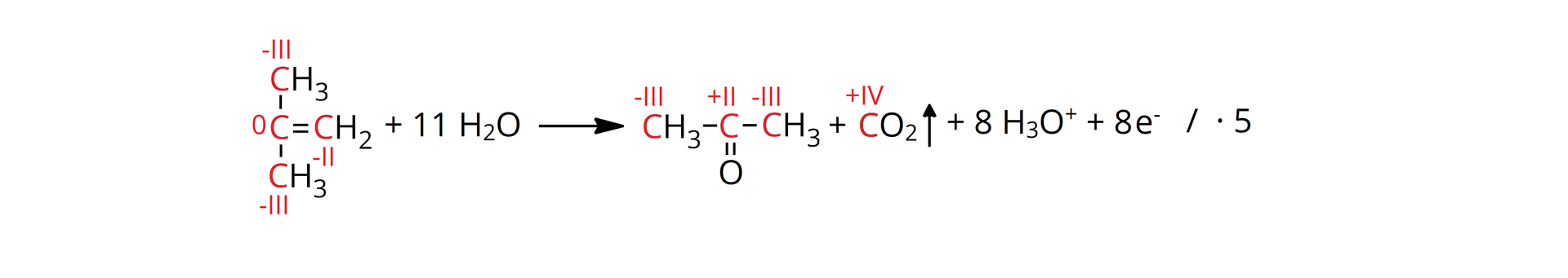Sprawdź się
Zaznacz informacje, które dotyczą reakcji chemicznej z udziałem substancji zaznaczonych na grafie.
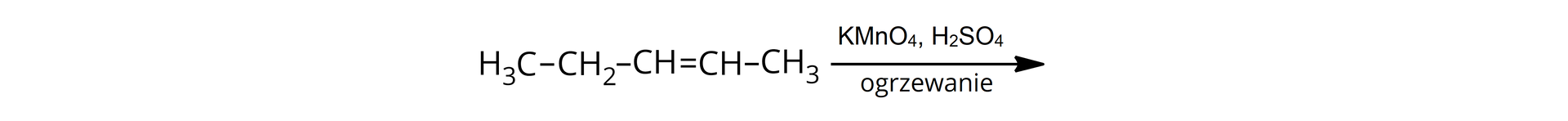
Narysuj wzór półstrukturalny i podaj nazwę systematyczną alkenu, jaki poddano utlenieniu roztworem wodnym , skoro otrzymanym produktem organicznym był pentan-,-diol.
Opisz wzór półstrukturalny i podaj nazwę systematyczną alkenu, jaki poddano utlenieniu roztworem wodnym , skoro otrzymanym produktem organicznym był pentan-,-diol.
Uzupełnij równania reakcji chemicznych alkenów z roztworem w formie jonowej skróconej. Narysuj wzory półstrukturalne odpowiednich produktów organicznych.

Podaj nazwy produktów reakcji alkenów z roztworem w środowisku kwasowym w podwyższonej temperaturze.
- Substrat: -metylopent--en.
Produkty: Tu uzupełnij oraz Tu uzupełnij. - Substrat: -metyloheks--en.
Produkty: kwas etanowy oraz Tu uzupełnij. - Substrat: ,-dimetylobut--en.
Produkty: Tu uzupełnij oraz -metylobutan--on. - Substrat: pent--en.
Produkty: Tu uzupełnij oraz Tu uzupełnij. - Substrat: propen.
Produkty: Tu uzupełnij oraz Tu uzupełnij.
Jedną z ogólnych metod określania struktury związku jest degradacja, czyli rozpad cząsteczki związku o nieznanej strukturze na kilka mniejszych cząsteczek, łatwiejszych do zidentyfikowania. Metoda ta jest wykorzystywana do określania położenia podwójnego wiązania w cząsteczkach alkenów. Stosowane jest wówczas ich utlenianie, np. za pomocą roztworu prowadzone w środowisku kwasowym w podwyższonej temperaturze. Podczas tej reakcji, w zależności od budowy cząsteczki alkenu, mogą powstać kwasy karboksylowe, ketony i tlenek węgla().
Z ugrupowania powstaje keton, z ugrupowania powstaje kwas, a tlenek węgla() powstaje z ugrupowania .
Pewien alken, utleniany nadmiarem w środowisku kwasowym w podwyższonej temperaturze, daje dwa różne kwasy karboksylowe, zaś w reakcji
mola tego alkenu z molem wodoru powstaje heksan. Podaj nazwy dwóch kwasów karboksylowych zalecanych przez IUPAC, powstałych podczas utleniania tego alkenu, oraz narysuj wzór półstrukturalny tego alkenu.
Indeks górny źródło: CKE, Egzamin maturalny z chemii. Poziom rozszerzony, maj 2011*.* Indeks górny koniecźródło: CKE, Egzamin maturalny z chemii. Poziom rozszerzony, maj 2011*.*
Jedną z ogólnych metod określania struktury związku jest degradacja, czyli rozpad cząsteczki związku o nieznanej strukturze na kilka mniejszych cząsteczek, łatwiejszych do zidentyfikowania. Metoda ta jest wykorzystywana do określania położenia podwójnego wiązania w cząsteczkach alkenów. Stosowane jest wówczas ich utlenianie, np. za pomocą roztworu , prowadzone w środowisku kwasowym w podwyższonej temperaturze. Podczas tej reakcji, w zależności od budowy cząsteczki alkenu, mogą powstać kwasy karboksylowe, ketony i tlenek węgla().
Z ugrupowania powstaje keton, z ugrupowania powstaje kwas, a tlenek węgla() powstaje z ugrupowania .
W dwóch nieoznakowanych kolbach znajdowały się dwa alkeny (każdy w innym naczyniu). Wiadomo, że jednym związkiem był -metylopropen, a drugim but--en. W celu odróżnienia -metylopropenu od but--enu, przeprowadzono doświadczenie, podczas którego do obu naczyń dodano zakwaszony, wodny roztwór W trakcie doświadczenia w kolbie nr wyczuwalny był zapach acetonu, natomiast w kolbie nr wyczuwalny był zapach octu.
Indeks górny źródło: CKE, Egzamin maturalny z chemii Poziom rozszerzony, maj 2011. Indeks górny koniecźródło: CKE, Egzamin maturalny z chemii Poziom rozszerzony, maj 2011.
Korzystając z powyższych informacji, zaproponuj problem badawczy i hipotezę. Uzasadnij obserwowane zmiany w kolbach i sformułuj wnioski. Następnie zapisz równania reakcji w formie jonowej, pamiętając o uwzględnieniu współczynników stechiometrycznych.