Sprawdź się
Wiązanie w cząstecze fluoru jest krótsze od wiązania w anionie nadtlenkowym (). Co jest tego przyczyną? Wskaż prawidłową odpowiedź.
- Wyższy rząd wiązania w niż .
- Ładunek ujemny anionu nadtlenkowego.
- Mniejszy promień atomowy fluoru niż tlenu.
- Większa liczba elektronów w niż .
Cząsteczki/jony, które posiadają taką samą liczbę elektronów walencyjnych i analogiczną budowę, określa się jako izoelektronowe, np. i . Zaznacz, która cząsteczka/jon jest cząsteczką izoelektronową/jonem izoelektronowym do cząsteczki azotu ().
Wskaż zdania prawdziwe, określające orbitale niewiążące.
- To każdy orbital, który jest nieobsadzony elektronami w stanie podstawowym cząsteczki.
- Są utworzone z orbitali atomowych, które nie nałożyły się z orbitalami pochodzącymi z drugiego atomu.
- Ich obsadzenia nie uwzględnia się przy liczeniu rzędu wiązania.
- We wzorze Lewisa odpowiadają wolnym parom elektronowym.
W reakcji tlenu z bardzo silnym utleniaczem może dojść do oderwania jednego elektronu od cząsteczki , co prowadzi do utworzenia kationu dioksygenylu o wzorze . Wybierz prawidłowe odpowiedzi w oparciu o diagram energetyczny.
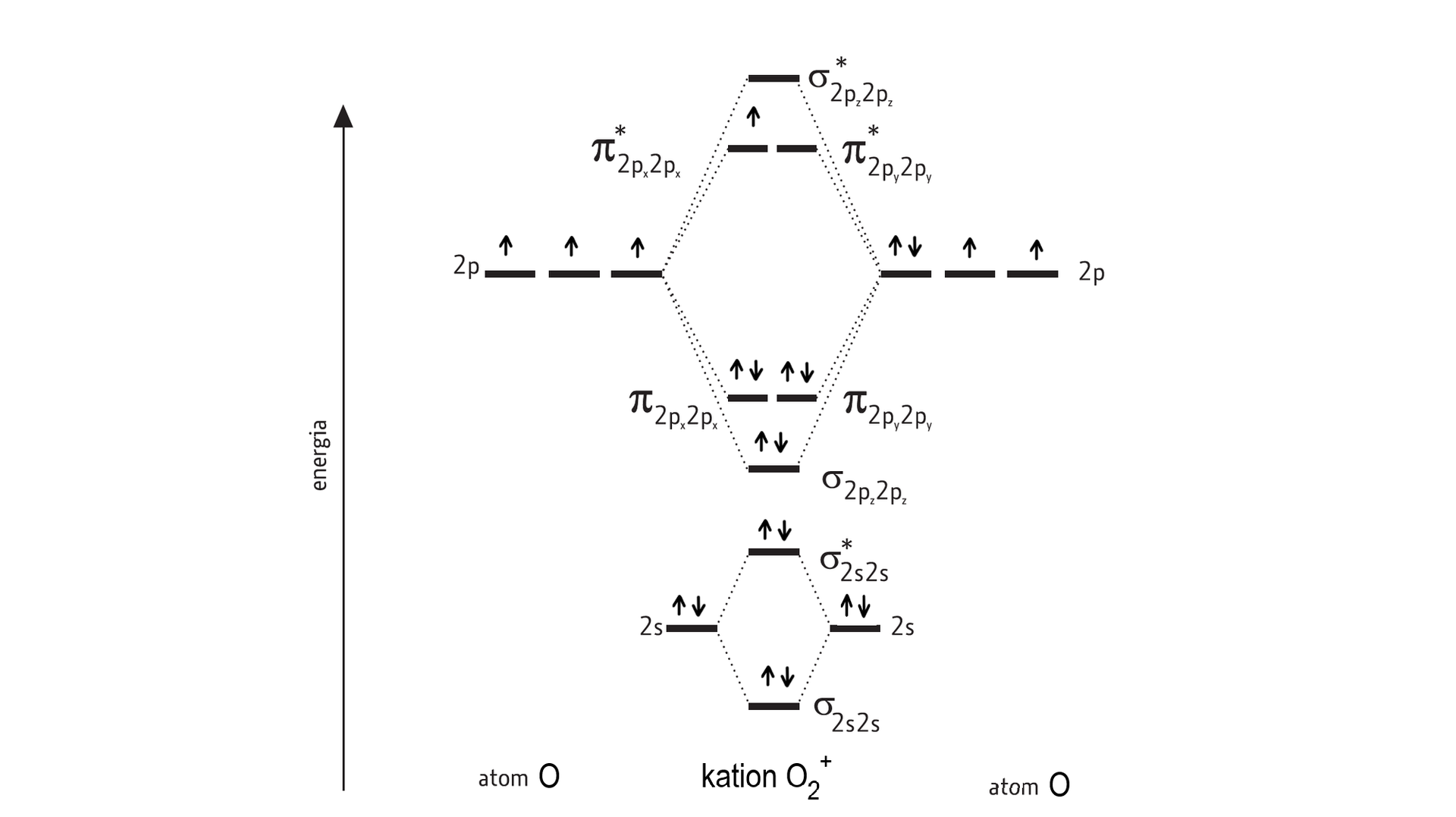
Kation dioksygenylu posiada {parzystą}{#nieparzystą} liczbę elektronów, natomiast rząd wiązania wynosi {1,5}{2}{#2,5}.
Uzupełnij poniższy tekst w oparciu o diagram energetyczny.
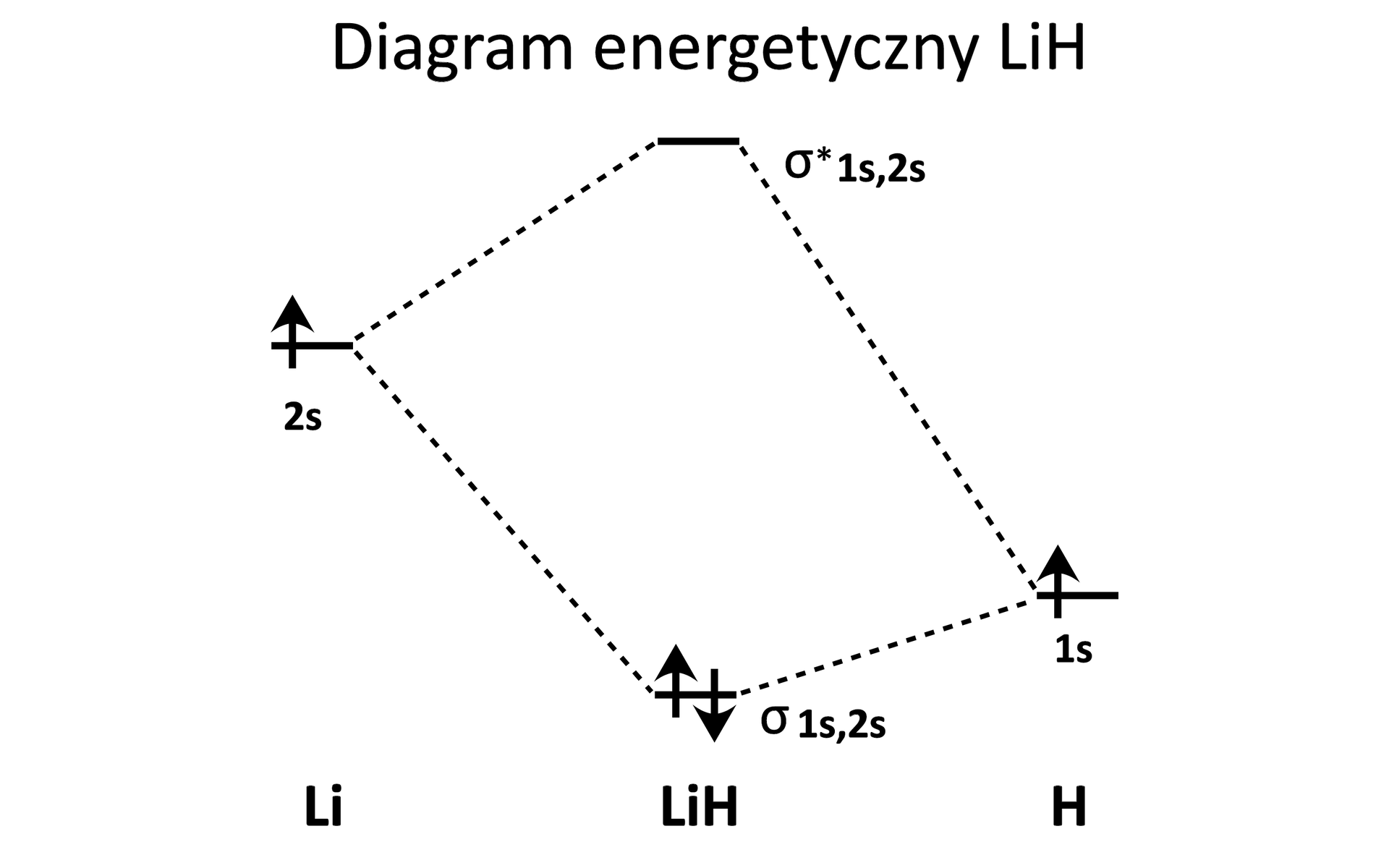
W cząsteczce orbital wiążący jest określony jako {} {#} {} {} i posiada większy udział orbitalu walencyjnego {wodoru} {#fluoru}, przez co para wiążąca jest przesunięta w stronę atomu {wodoru} {#fluoru}. Liczba elektronów na orbitalu antywiążącym w cząsteczce wynosi {#0} {1} {2}.
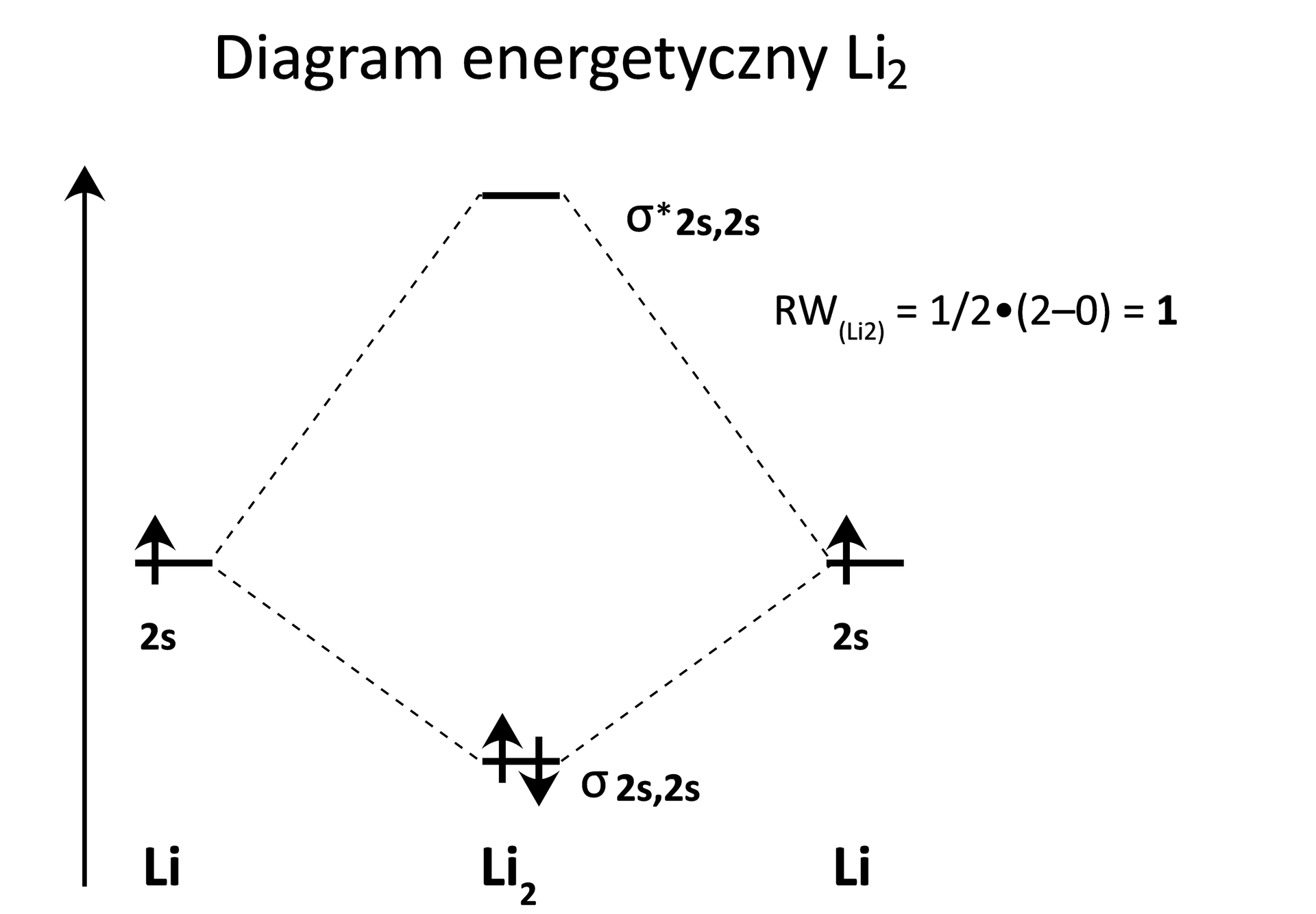
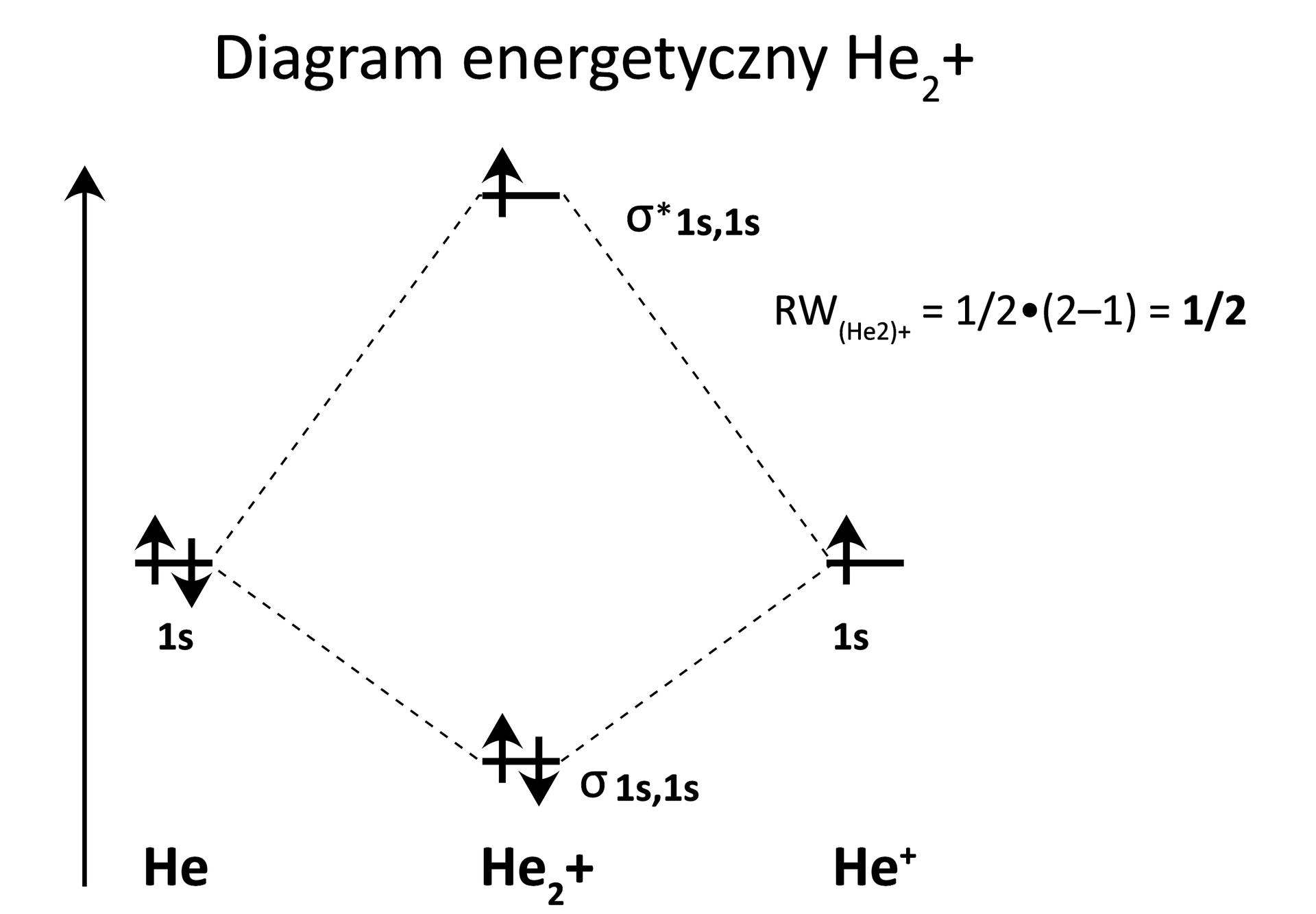
W oparciu o diagram energetyczny określ, czy może istnieć jon . Odpowiedź uzasadnij, obliczając rząd wiązania.
W fazie gazowej lit może tworzyć cząsteczki dwuatomowe. Narysuj diagram energetyczny cząsteczki .
Charakter wiązania w cząsteczkach heteroatomowych zmienia się płynnie, w zależności od udziału wiązania jonowego – od kowalencyjnego poprzez kowalencyjne spolaryzowane do jonowego. W rzeczywistości nie ma ścisłego kryterium, które wyznaczałoby, kiedy wiązanie jest jonowe. Można więc obliczyć udział wiązania jonowego wzrastającego z różnicą elektroujemności, ale zależy to także od wartości elektroujemności połączonych atomów. Stosując wzór:
można wyliczyć, że nawet dla charakter jonowy wiązania wynosi ok. .
Oblicz udział jonowy wiązania w i skonstruuj diagram energetyczny, uwzględniając przyczynek kowalencyjny.