Sprawdź się
Uzupełnij rysunek, wstawiając odpowiednie słowa w wykropkowane miejsca.
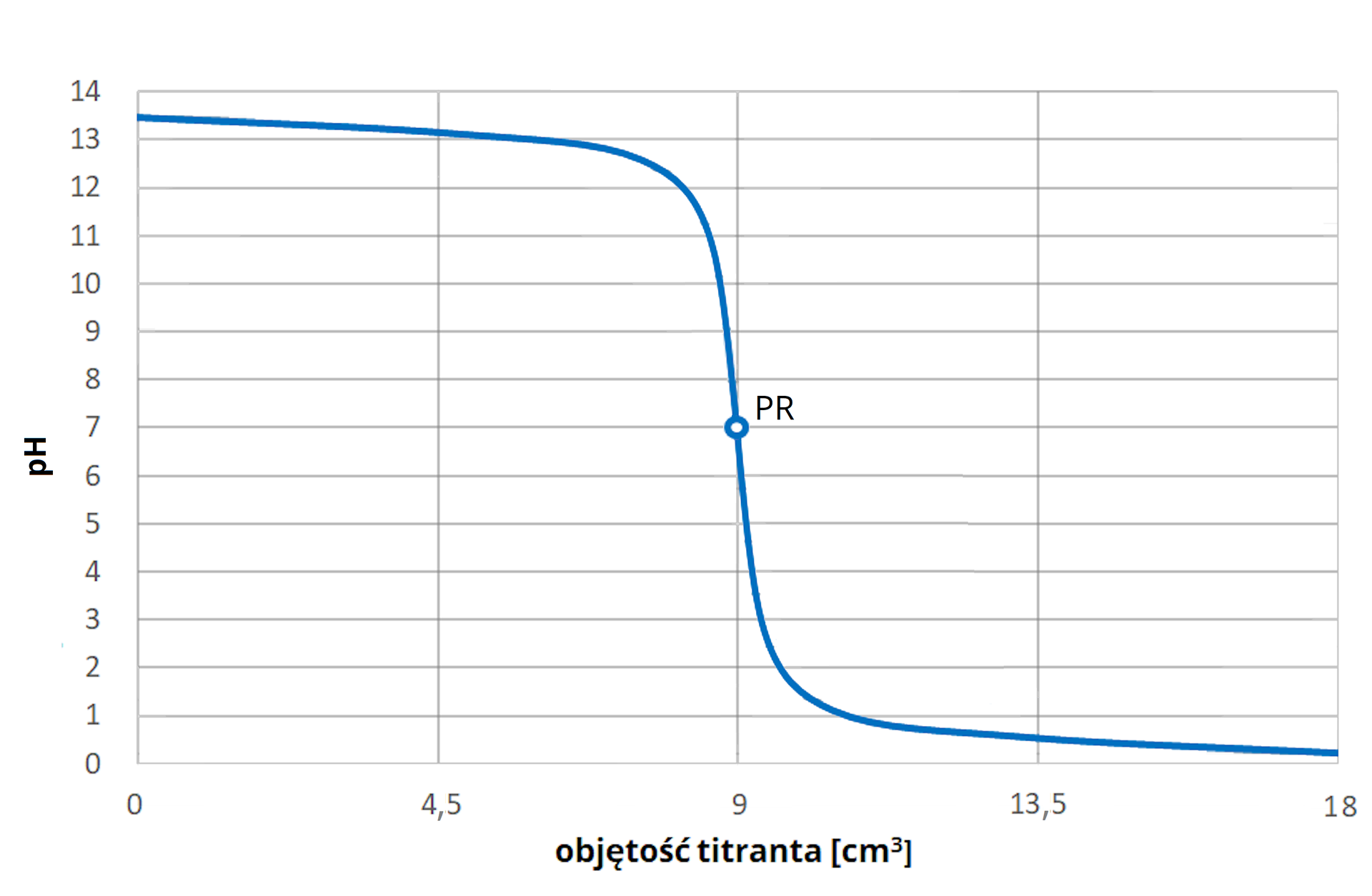
Przeprowadzono dwukrotnie proces miareczkowania roztworu przy pomocy roztworu jako titranta, a krzywa miareczkowania została przedstawiona poniżej. Określ, jaki kolor posiadał roztwór na początku i na końcu miareczkowania, jeśli w pierwszym przypadku użyto czerwieni metylowej jako wskaźnika , a w drugim tymoloftaleiny.
Przeprowadzono dwukrotnie proces miareczkowania roztworu za pomocą jako titranta, a krzywa miareczkowania została opisana. Jaki kolor posiadał roztwór na początku i na końcu miareczkowania, jeśli w pierwszym przypadku użyto czerwieni metylowej jako wskaźnika , a w drugim tymoloftaleiny? Zapoznaj się z opisem poniższego wykresu, aby poznać odpowiedź na postawione pytanie, a następnie uzupełnij na jego podstawie tabelę.
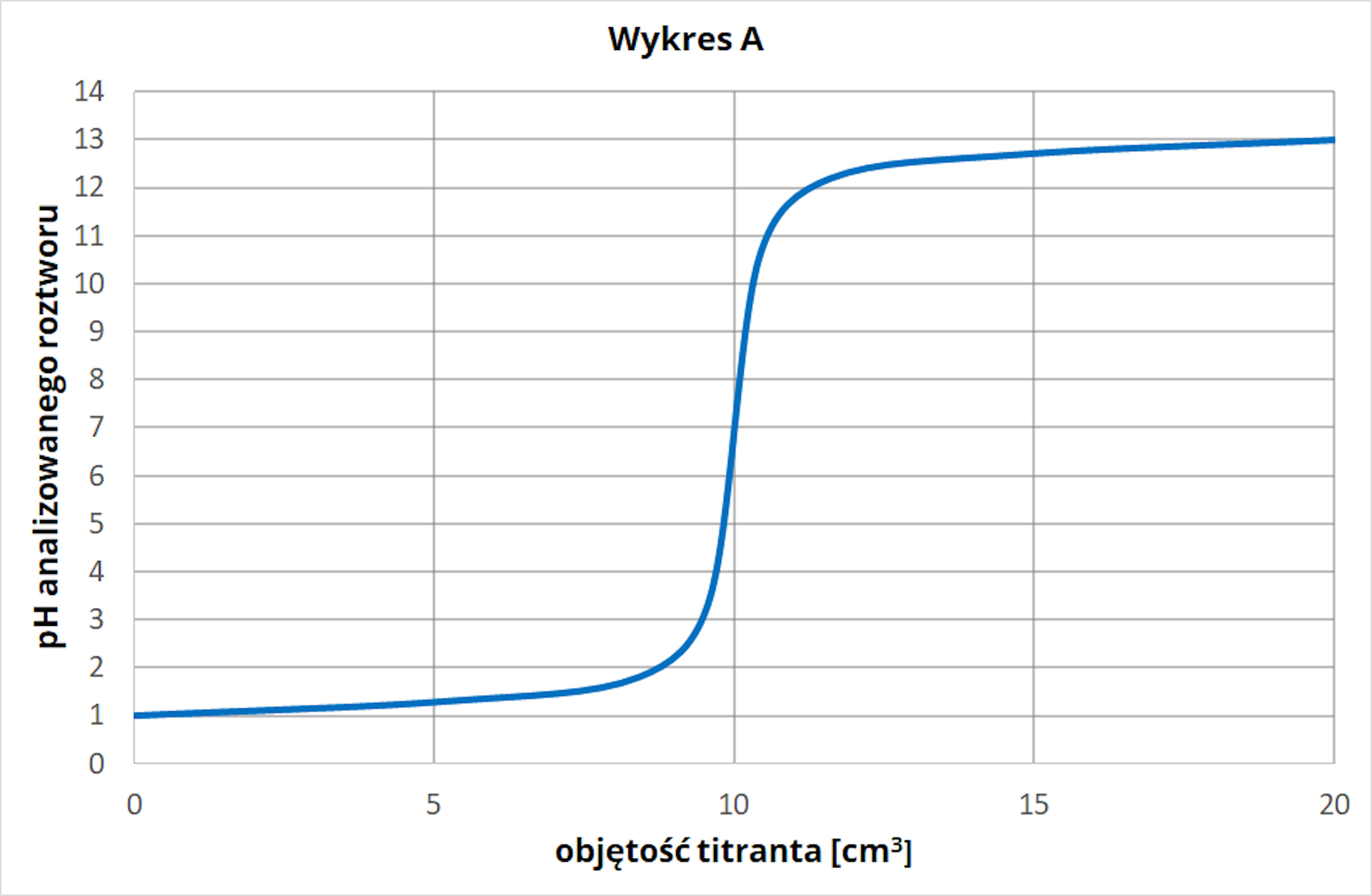
Dwóch uczniów przeprowadziło analizy miareczkowe, które opisano poniżej.
Uczeń :
Do kolby stożkowej, zawierającej kwasu octowego () o stężeniu , dodano kilka kropli błękitu bromotylowego. Tak przygotowany roztwór miareczkowano mianowanym roztworem wodorotlenku sodu () o stężeniu . Za pomocą pehametru sprawdzano mieszaniny reakcyjnej. Miareczkowanie wykonano razy, stosując za każdym razem tą samą objętość analitu.
Uczeń :
Do kolby stożkowej, zawierającej kwasu chlorowodorowego () o stężeniu , dodano kilka kropli oranżu metylowego. Tak przygotowany roztwór miareczkowano mianowanym roztworem wodorotlenku sodu () o stężeniu . Za pomocą pehametru sprawdzano mieszaniny reakcyjnej. Miareczkowanie wykonano razy, stosując za każdym razem tą samą objętość analitu.
Otrzymane podczas doświadczeń wyniki uczniowie przedstawili na wykresach A i B:
Wykonano doświadczenie:
Do kolby stożkowej, zawierającej kwasu octowego () o stężeniu , dodano kilka kropli błękitu bromotymolowego. Tak przygotowany roztwór miareczkowano mianowanym roztworem wodorotlenku sodu () o stężeniu . Za pomocą pehametru sprawdzano mieszaniny reakcyjnej.
a) Co zaobserwuje osoba wykonująca doświadczenie w punkcie końcowym podczas miareczkowania kwasu octowego wodnym roztworem ?
b) Wyjaśnij, jaką rolę pełni wskaźnik w opisanym doświadczeniu.
c) Jakie obserwacje zanotowałby uczeń, gdyby zamiast błękitu bromotymolowego użył fenoloftaleiny?
Zapisz w formie cząsteczkowej równanie reakcji zachodzącej podczas eksperymentu:
Do kolby stożkowej, zawierającej kwasu etanowego () o stężeniu , dodano kilka kropli błękitu bromotylowego. Tak przygotowany roztwór miareczkowano wodnym roztworem wodorotlenku sodu () o stężeniu . Za pomocą pehametru sprawdzano mieszaniny reakcyjnej.
Następnie udowodnij, pisząc odpowiednie równanie reakcji w formie jonowej skróconej, że odczyn wodnego roztworu w momencie osiągniecia punktu równoważnikowego miareczkowania jest zasadowy.
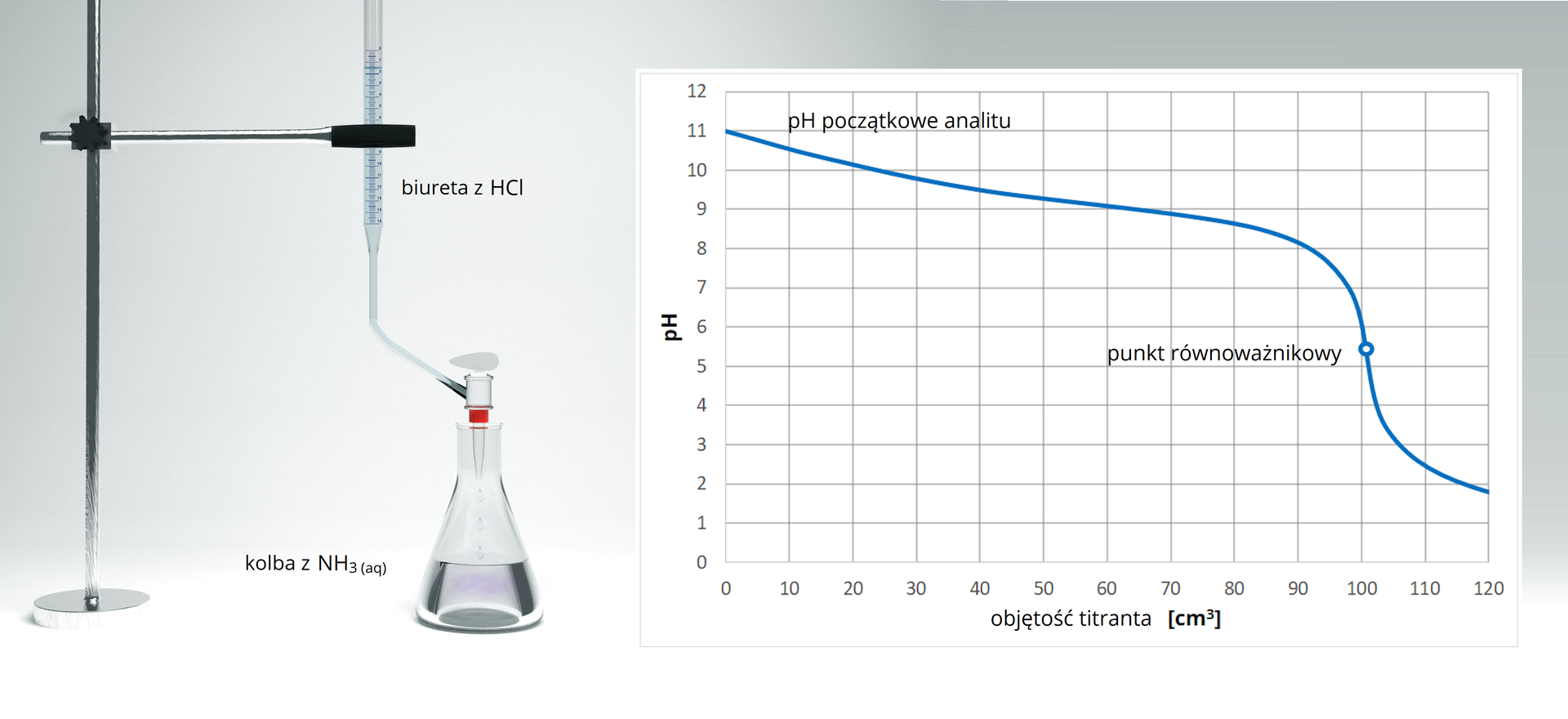
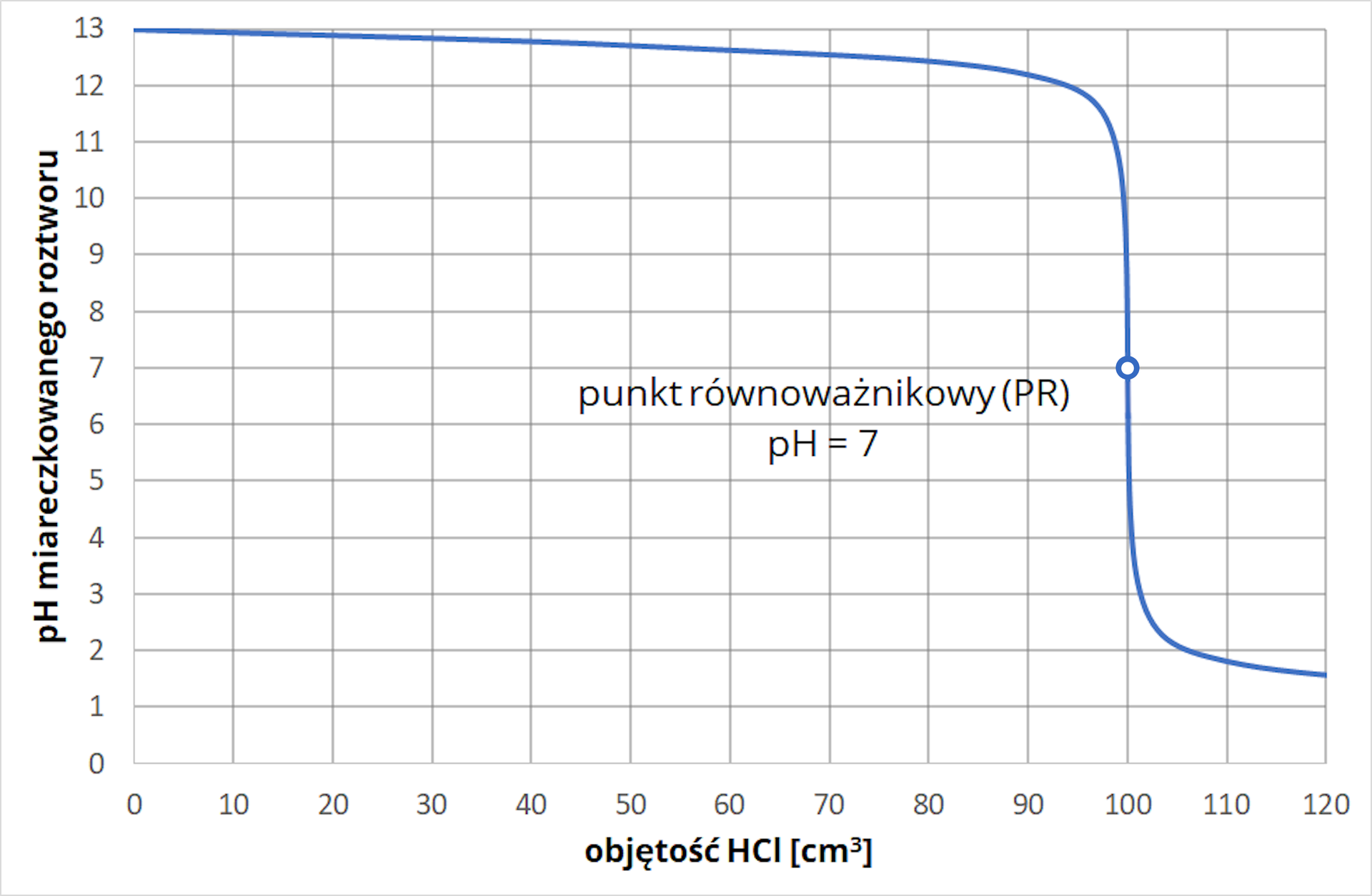
Prowadzono proces miareczkowania wodnego roztworu wodorotlenku sodu o nieznanym stężeniu przy pomocy kwasu solnego. Wiedząc, że stężenie titranta wykorzystanego do procesu miareczkowania wynosiło , oblicz stężenie roztworu analitu.