Sprawdź się
Wybierz nukleofile spośród podanych niżej drobin:
Wybierz reakcje (jedną lub więcej), zachodzące wg mechanizmu nukleofilowego:
Wybierz prawdziwe określenia spośród podanych w nawiasach.
zasadą, Lewisa, kwasem, Brønsteda
Nukleofil jest .................... wg teorii ...................., ponieważ przekazuje wolną parę elektronową do centrum elektrofilowego.
Wskaż nukleofil w równaniu reakcji.
{} {#} {} {}
Na poniższym rysunku przedstawiono równanie reakcji, która przebiegała wg mechanizmu nukleofilowego. Określ rodzaj reakcji – addycja, substytucja, eliminacja – oraz nazwij grupę nukleofilową.

Rozpuszczalniki protyczne, czyli takie, które mogą wymieniać, oddawać lub przyjmować protony, wykazują tendencję do tworzenia wiązań wodorowych z atakującym nukleofilem, co będzie utrudniać reakcje substytucji nukleofilowej
. Wynika to z faktu, że nukleofil będzie musiał pozbyć się cząsteczek rozpuszczalnika przed atakiem na centrum nukleofilowe. Zastosowanie rozpuszczalników nieprotycznych (aprotycznych), czyli niewymieniających protony, jest jednym z czynników przyspieszających reakcje, które zachodzą według mechanizmu .
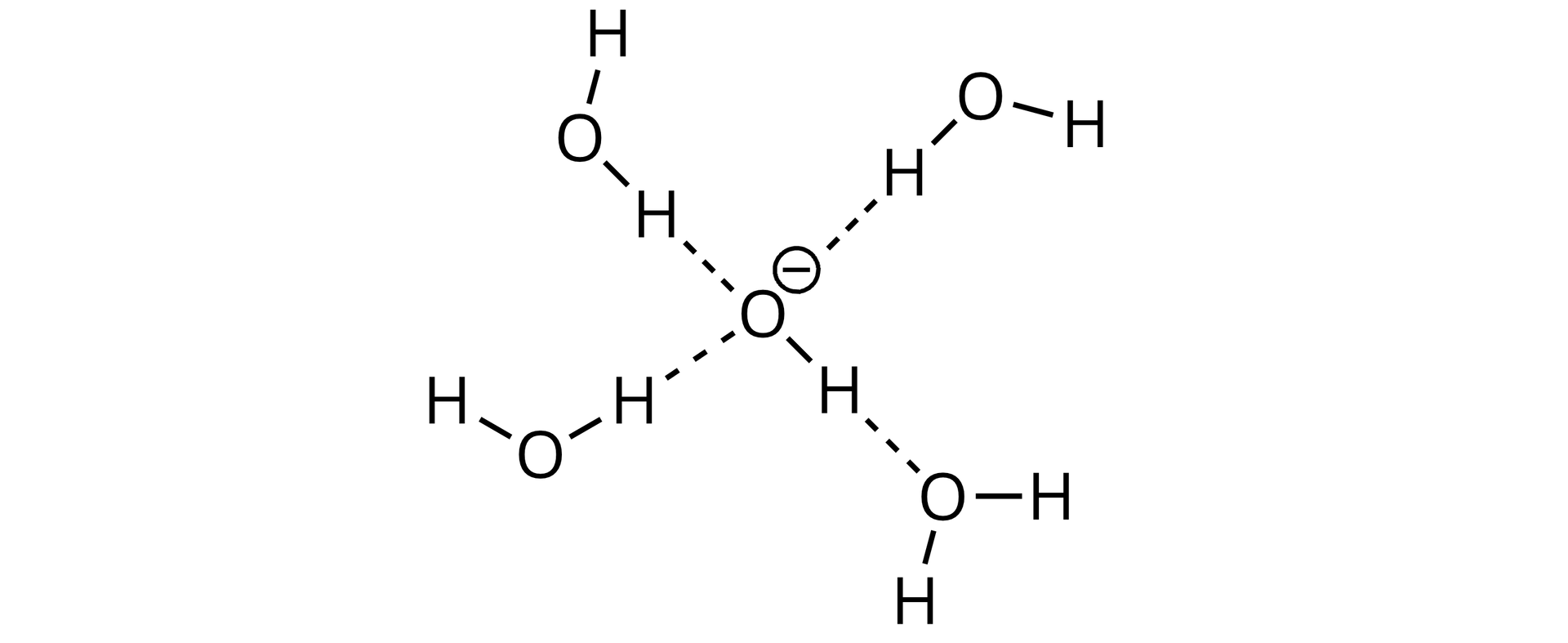
Na podstawie powyższej informacji, uzupełnij zdania.
protycznym, mniejsza, aprotycznym, większa
Szybkość reakcji , przeprowadzanej w acetonitrylu, będzie ...................... niż w etanolu, ponieważ acetonitryl – w odróżnieniu od etanolu – jest rozpuszczalnikiem .......................
Na szybkość reakcji ma wpływ zasadowy charakter grupy opuszczającej. „Dobra“ grupa opuszczająca w reakcji to taka, która łatwo ulega substytucji. Według tego mechanizmu jest słabą zasadą, wykazując tendencję do występowania w postaci anionowej. Często są to aniony słabych zasad, które pochodzą od sprzężonych z nimi mocnych kwasów.
Na podstawie powyższej informacji, uzupełnij zdania.
, , , , ,
Lepszą grupą opuszczającą w reakcji jest ............, ponieważ jest to słabsza zasada niż ............. Lepsza grupa opuszczająca jest zasadą sprzężoną z mocniejszym kwasem .............
