Sprawdź się
Na podstawie podanego schematu, uzupełnij tekst.
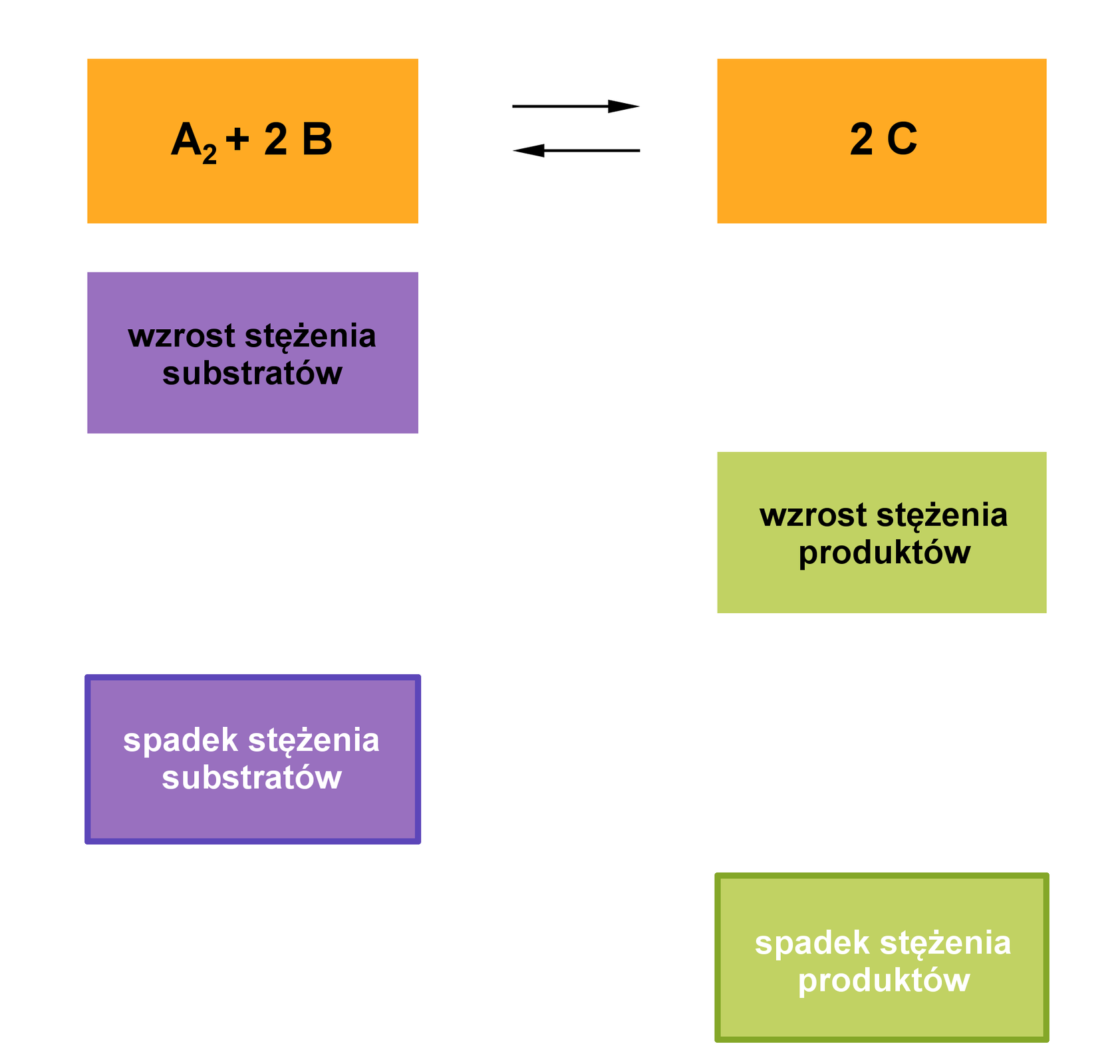
Na podstawie opisanego schematu, uzupełnij tekst.
prawo, lewo, prawo, prawo, prawo, lewo, lewo, lewo
Wzrost stężenia substratów powoduje przesunięcie położenia równowagi w ............. Wzrost stężenia produktów powoduje przesunięcie położenia równowagi w ............. Spadek stężenia substratów powoduje przesunięcie położenia równowagi w ............. Spadek stężenia produktów powoduje przesunięcie położenia równowagi w .............
Zaznacz zdania, które są prawdziwe.
- Reakcje nieodwracalne, to reakcje biegnące do samego końca.
- W przypadku reakcji otrzymywania tlenku azotu(II), ochłodzenie układu reakcyjnego spowoduje zmniejszenie wydajności tworzenia tlenku azotu(II).
- Temperatura ma podobny wpływ na położenie stanu równowagi dla syntezy amoniaku, jak i dla tlenku azotu(II).
- W przypadku reakcji egzotermicznej, dostarczenie ciepła do układu reakcyjnego powoduje przesunięcie równowagi w prawo.
- Jeśli zmniejszymy temperaturę tworzenia wody w układzie reakcyjnym, to jej wydajność zmaleje.
Wymień czynniki, które mogą wpływać na przesunięcie stanu równowagi dynamicznej dla poniższej reakcji.
Następnie wyjaśnij:
A. w jaki sposób zmiana temperatury wpływa na wydajność powstawania jodowodoru?
B. jak zmieni się położenie stanu równowagi chemicznej, jeśli do układu reakcyjnego zostanie dostarczone większe stężenie jodu?
Podaj trzy sposoby na przesunięcie stanu równowagi dynamicznej w prawo dla poniższej reakcji.
Czy ciśnienie może wpływać na położenie stanu równowagi dla powyższej reakcji?
Odpowiedz, jak na położenie stanu równowagi poniższej reakcji wpływa zastosowanie wymienionych czynników.
Dodanie do mieszaniny reakcyjnej katalizatora.
Dodanie wodoru do mieszaniny reakcyjnej.
Odebranie części tlenku węgla(II) z mieszaniny reakcyjnej.
Zwiększenie ciśnienia w układzie reakcyjnym.
Zmniejszenie temperatury w układzie reakcyjnym.
Na przykładzie reakcji otrzymywania amoniaku (deltaH>0), odpowiedz na poniższe pytania.
Jak zmieni się położenie stanu równowagi, jeśli do układu reakcyjnego zostanie dostarczone ciepło?
Jak zmieni się położenie stanu równowagi, jeśli do układu reakcyjnego zostanie dostarczony amoniak?
Jak przesunie się położenie równowagi, jeśli z układu reakcyjnego usunie się część wodoru?
Oblicz stężenie tlenku węgla(IV) w stanie równowagi dla poniższej reakcji:
wiedząc, że stężenia równowagowe pozostałych reagentów wynosiły:
,
,
.
a stała równowagi dla tej reakcji wynosi 9,6.
Reakcja rozkładu jodowodoru przebiega w układzie zamkniętym i w podwyższonej temperaturze, a stała szybkości reakcji wynosi . Między reagentami ustala się stan równowagi dynamicznej. Oblicz stężenia reagentów w stanie równowagi.
Uzupełnij poniższą tabelę.
I2, H2, HI, 0,1, 0,2, 1, 2+x, 1+x, x, 2x, 0,2+x, 0,1+x
| Reagent | Stan początkowy | Przereagowane | Stan równowagowy |
|---|---|---|---|
| I2 | 0,1 | ||
| H2 | 0,2 | ||
| HI | 1 |
