Sprawdź się
Pokaż ćwiczenia:
Ćwiczenie 1
Ćwiczenie 2
Ćwiczenie 3
Ćwiczenie 4
Ćwiczenie 5
Zapoznaj się z wartościami stałych dysocjacji zasadowej z tabeli dla substancji o wzorach podanych w zadaniu. Następnie uszereguj zasady od najsłabszej do najsilniejszej.
Zasada | Stała dysocjacji |
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Ćwiczenie 6
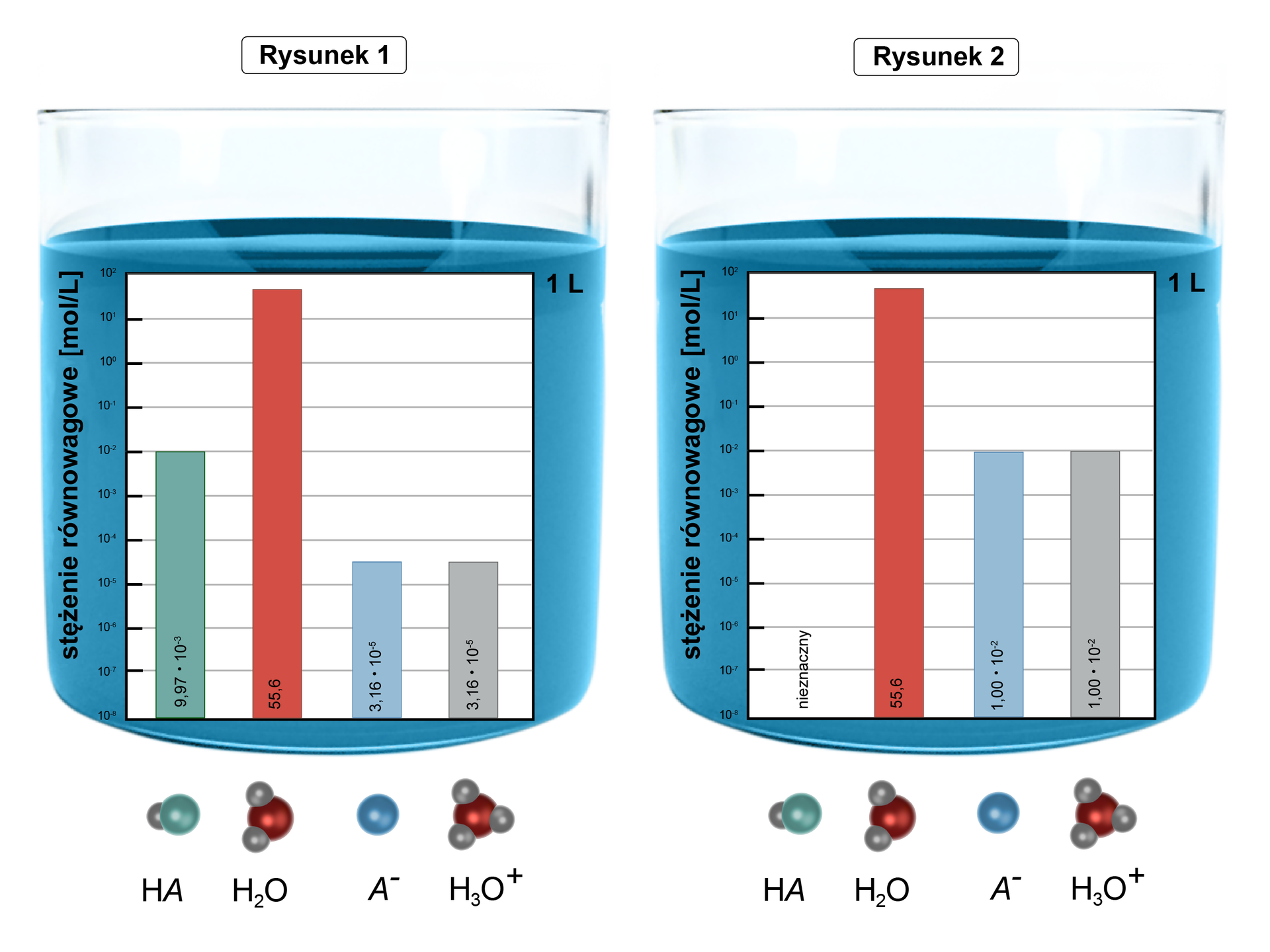
Rysunek dla zadania
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Ćwiczenie 7
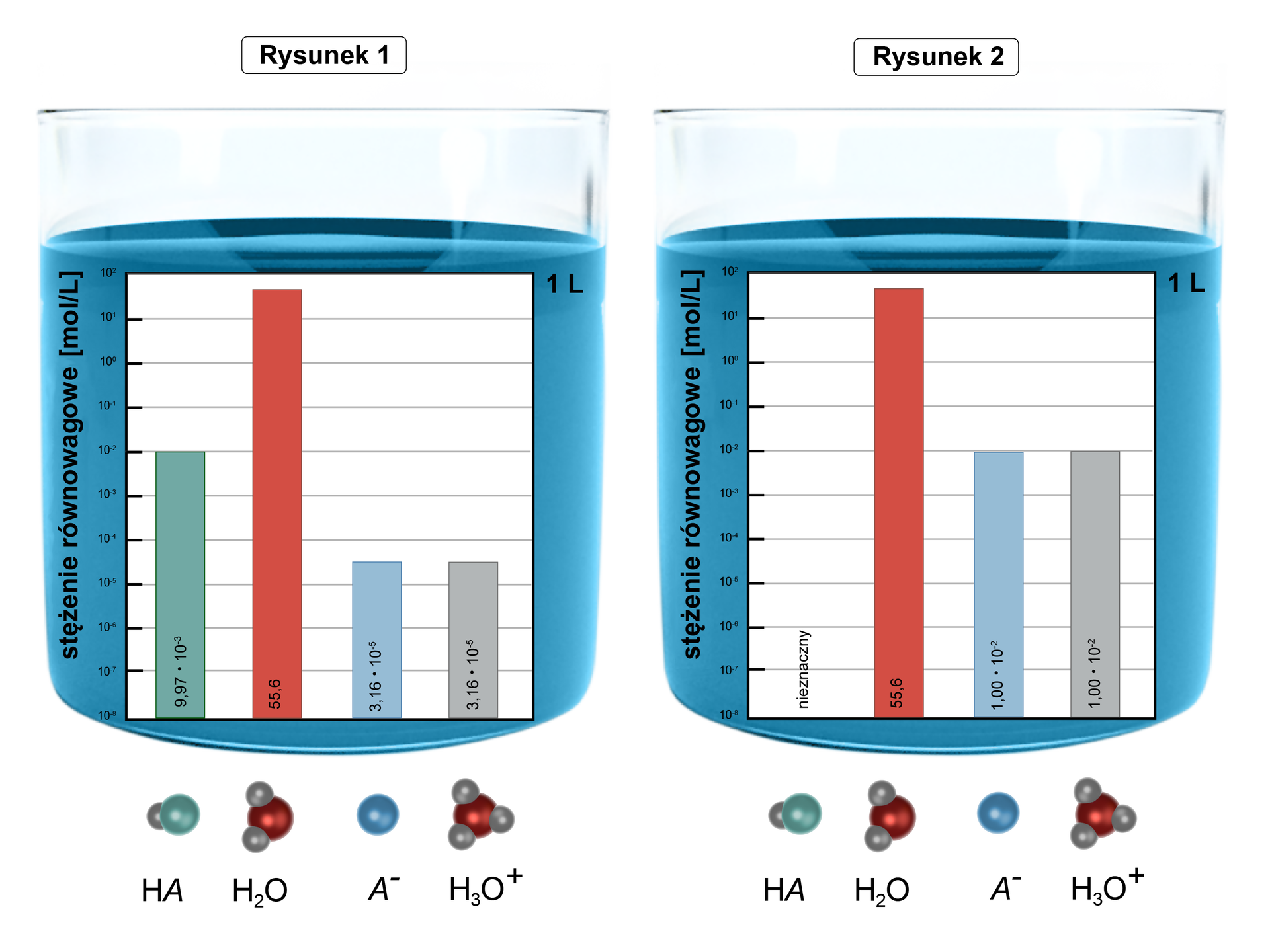
Rysunek dla zadania
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Ćwiczenie 8
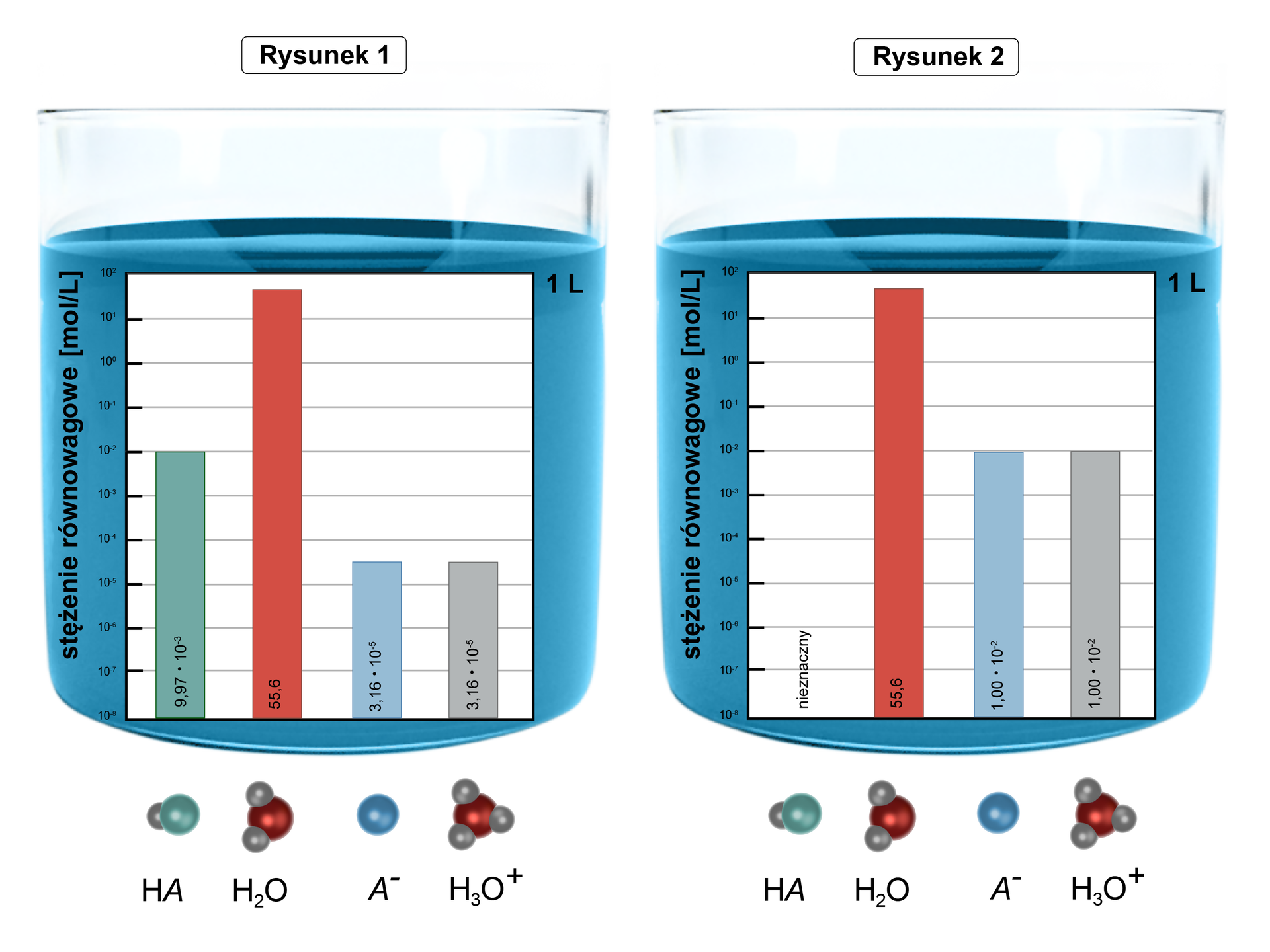
Rysunek dla zadania
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
