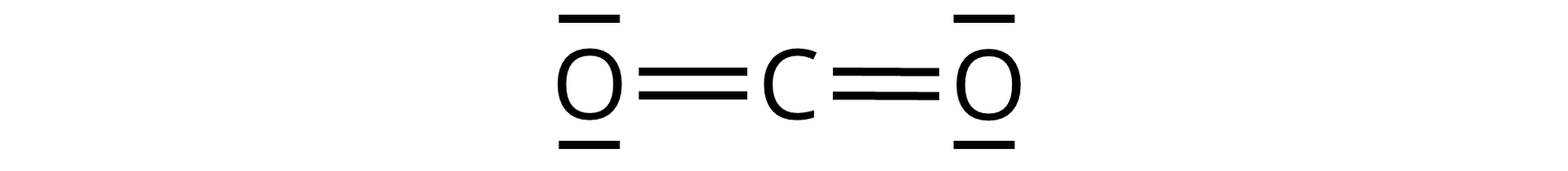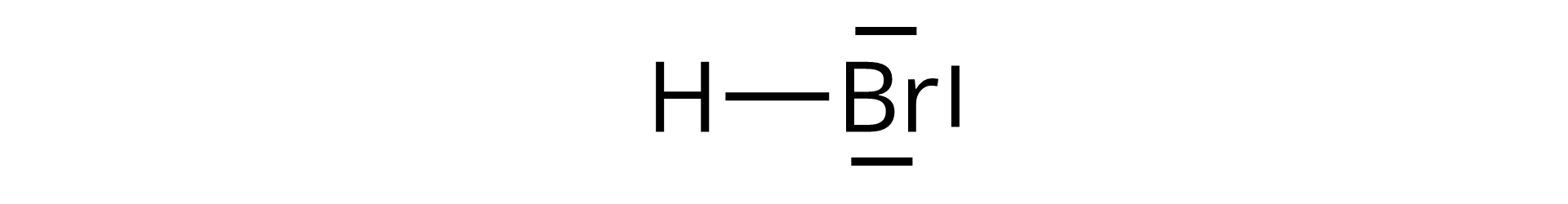Sprawdź się
Uzupełnij tekst.
izolowana, konfiguracje elektronowe, atomami metali, stabilizowana, hybrydyzacji, nakładać, oddalać, przyjmowana, jądrami atomowymi, konfiguracji elektronowej, elektronami, uwalniana, orbitale walencyjne, atomami niemetali
Wiązanie kowalencyjne niespolaryzowane powstaje pomiędzy ................................................... Dla przykładowej cząsteczki A2, powstałej z atomów o .................................................. , powstaje ono w następujący sposób: początkowo dwa oddzielne atomy A zbliżają się do siebie, a ich .................................................. () zaczynają się .................................................., następnie każdy z pojedynczych elektronów atomów A oddziałuje z obydwoma .................................................., zajmując tym samym przestrzeń wokół obu atomów. Tak powstała cząsteczka jest .................................................. poprzez silne przyciąganie elektronów do jąder atomów. W czasie tworzenia tego wiązania, energia jest ...................................................
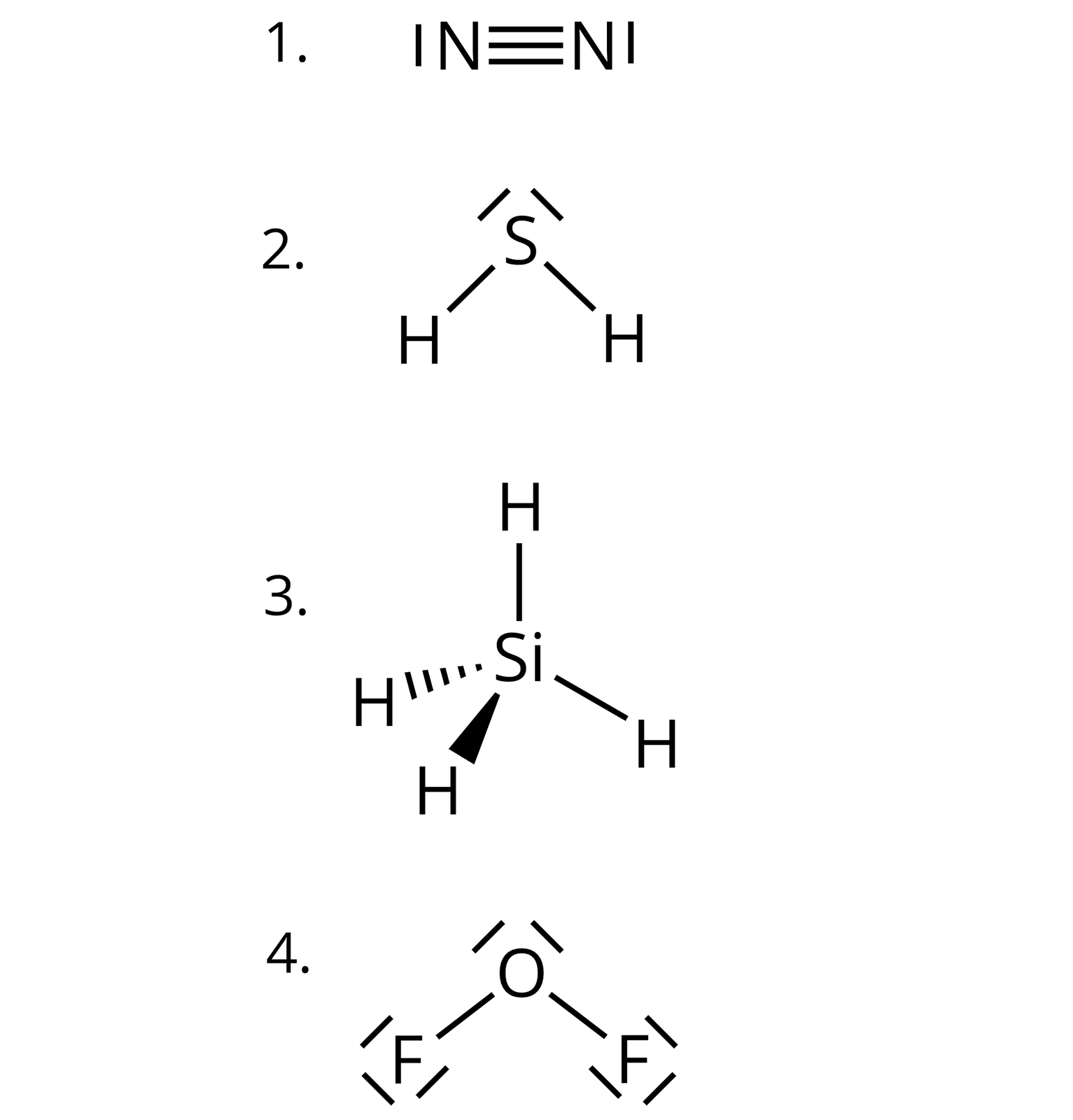
Narysuj wzory elektronowe Lewisa dla poniższych cząsteczek:
Opisz wzory elektronowe Lewisa dla poniższych cząsteczek:
;
;
;
.
Zaznacz, czy zdania są prawdziwe, czy fałszywe.
| Zdanie | Prawda | Fałsz |
| W wiązaniu kowalencyjnym niespolaryzowanym zawsze wiążąca para elektronów należy w takim samym stopniu do obydwu atomów. | □ | □ |
| Wiązanie potrójne jest tworzone przez trzy elektrony. | □ | □ |
| Atomy w stanie wolnym charakteryzują się wyższą energią niż te, które tworzą wiązanie. | □ | □ |
| Najwyższa energia potencjalna decyduje o długości wiązania. | □ | □ |
| Proces tworzenia wiązania jest procesem egzotermicznym. | □ | □ |
| Im większa różnica w elektroujemności, tym bardziej spolaryzowany jest rozkład elektronów i tym większe są ładunki cząstkowe atomów. | □ | □ |
Zdecyduj, jaki rodzaj wiązania występuje w poniższych cząsteczkach. Przesuń wzory cząsteczek na odpowiednie pola.
<span aria-label="HI" role="math"><math><mi>HI</mi></math></span>, <span aria-label="NH indeks dolny, trzy" role="math"><math><msub><mi>NH</mi><mn>3</mn></msub></math></span>, <span aria-label="CO indeks dolny, dwa" role="math"><math><msub><mi>CO</mi><mn>2</mn></msub></math></span>, <span aria-label="N indeks dolny, dwa" role="math"><math><msub><mi mathvariant="normal">N</mi><mn>2</mn></msub></math></span>, <span aria-label="Br indeks dolny, dwa" role="math"><math><msub><mi>Br</mi><mn>2</mn></msub></math></span>, <span aria-label="S indeks dolny, osiem" role="math"><math><msub><mi mathvariant="normal">S</mi><mn>8</mn></msub></math></span>, <span aria-label="CBr indeks dolny, cztery" role="math"><math><msub><mi>CBr</mi><mn>4</mn></msub></math></span>, <span aria-label="H indeks dolny, dwa, Se" role="math"><math><msub><mi mathvariant="normal">H</mi><mn>2</mn></msub><mi>Se</mi></math></span>
| Wiązanie kowalencyjne spolaryzowane | |
|---|---|
| Wiązanie kowalencyjne niespolaryzowane |
W oparciu o zasadę dążenia do korzystnej energetycznie konfiguracji oraz wartości elektroujemności, zaproponuj wzór sumaryczny i elektronowy dla cząsteczki zbudowanej z:
węgla i tlenu;
wodoru i bromu.
Polarność wiązań to jedna z właściwości, które pozwalają określić strukturę białek. Opierając się na wartościach elektroujemności poszczególnych atomów, uszereguj wiązania występujące w aminokwasach wg rosnącej polarności.

, , , ,
| Wiązanie występujące w aminokwasach | ΔE |
|---|---|
Określ typ wiązania w poniższych cząsteczkach i jonach oraz podaj nazwę gazu szlachetnego, którego konfigurację elektronową uzyskały atomy pierwiastków w cząsteczkach.
Wartości wpisz z dokładnością do jednego miejsca po przecinku. Do określenia rodzaju wiązań, skorzystaj z wyrażeń: kowalencyjne niespolaryzowane, jonowe lub kowalencyjne spolaryzowane.
1. Dla O3 wartość ΔE wynosi ............. Jest to wiązanie ...........................................................
2. Dla CaF2 wartość ΔE wynosi ............. Jest to wiązanie .............
3. Dla MnO2 wartość ΔE wynosi ............. Jest to wiązanie .............
4. Dla NO3- wartość ΔE wynosi ............. Jest to wiązanie .....................................................
5. Dla CO2 wartość ΔE wynosi ............. Jest to wiązanie .....................................................
6. Dla H2S wartość ΔE wynosi ............. Jest to wiązanie .....................................................
7. Dla OH- wartość ΔE wynosi ............. Jest to wiązanie .....................................................
8. Dla K2S wartość ΔE wynosi ............. Jest to wiązanie .............
9. Dla S8 wartość ΔE wynosi ............. Jest to wiązanie ...........................................................
Podaj nazwę gazu szlachetnego, którego konfigurację elektronową uzyskały atomy pierwiastków w cząsteczkach.
Na podstawie przedstawionych poniżej konfiguracji elektronowych atomów pierwiastków:
A.
B.
C.
D.