Sprawdź się
Wskaż, który zestaw (bądź które zestawy) zawiera tylko siarczki tzw. metali lekkich (metali o gęstości mniejszej niż ).
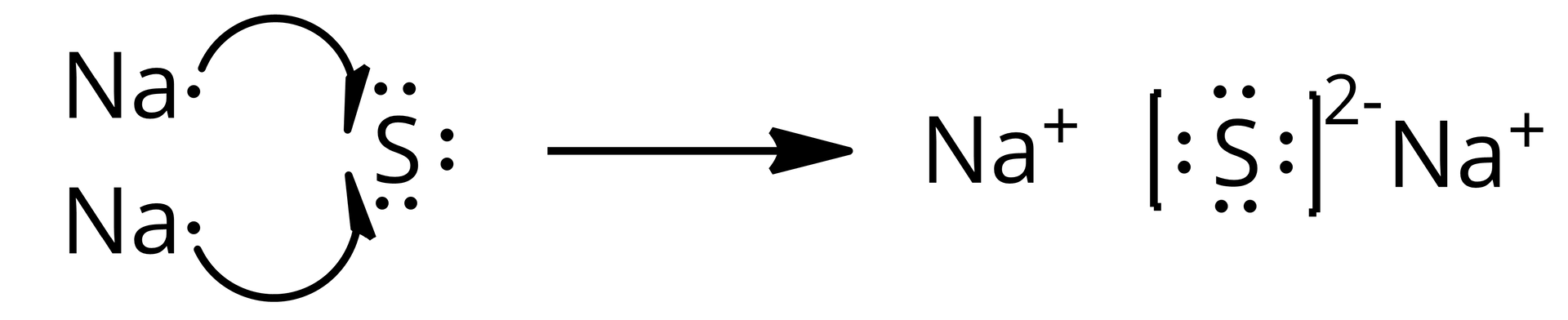
Tworzenie się chlorku sodu można przedstawić następującym schematem:
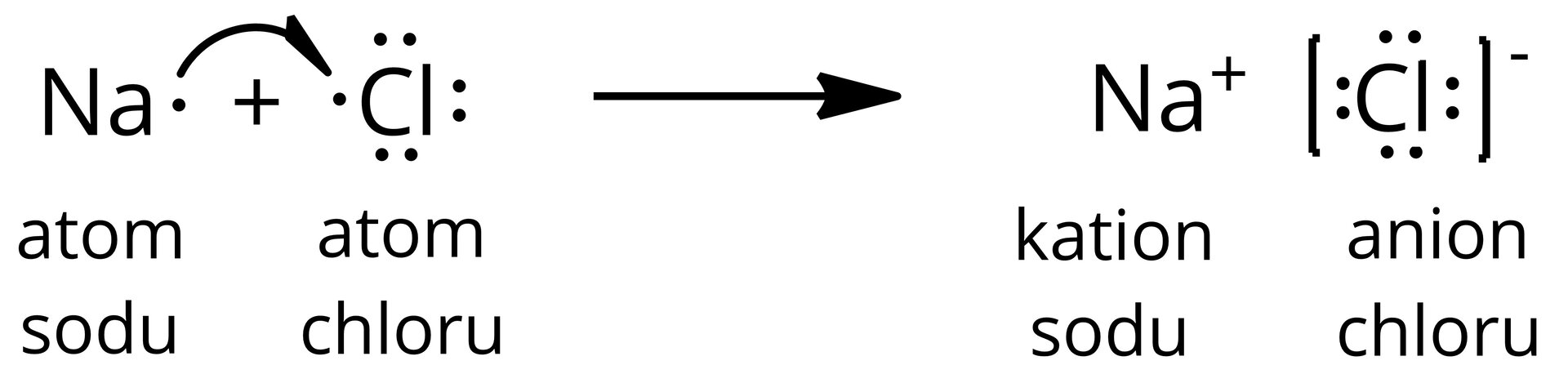
Narysuj analogiczny schemat tworzenia się .
W wyniku reakcji żelaza i siarki powstaje siarczek żelaza(). Oblicz masę żelaza niezbędną do przeprowadzenia reakcji z siarki przy założeniu, że reakcja ta zachodzi ze wydajnością.
Czy reakcja syntezy siarczku żelaza() jest reakcją utleniania i redukcji? Odpowiedź uzasadnij uzupełniając poniższe zapisy. W poniższym równaniu uzupełnij stopnie utlenienia. Zapisz równania procesów utleniania i redukcji. Wskaż utleniacz i reduktor.
Proces utlenienia: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8.
Proces redukcji: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8.
Utleniacz: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8.
Reduktor: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8.
Czy jon ma większy promień od jonu ? Odpowiedz i uzasadnij.
Rtęć jest substancją bardzo trującą, a opary z pozostawionego metalu mogą ulatniać się przez długi czas. Dlatego też rozlana rtęć powinna być możliwie szybko zutylizowana. W celu utylizacji rtęci stosuje się siarkę (w gospodarstwie domowym może to być np. siarka granulowana stosowana w ogrodnictwie).
Oblicz, ile minimalnie gramów siarki należy użyć w celu zutylizowania rtęci. Załóż, że należy zastosować co najmniej nadmiar siarki (procent masowy). Wynik podaj z dokładnością do drugiego miejsca po przecinku.