Sprawdź się
Zaznacz prawidłowe stwierdzenie. Może być więcej niż jedna poprawna odpowiedź.
- Katalizator jest to substancja chemiczna, której dodatek do układu reakcyjnego powoduje przyspieszenie reakcji chemicznej, a po zakończeniu reakcji jest w całości odzyskiwana.
- Katalizatory homogeniczne są w takiej samej fazie co substraty.
- Katalizatory heterogeniczne są w innej fazie niż substraty.
- Katalizator jest to substancja chemiczna, której dodatek do układu reakcyjnego powoduje spowolnienie reakcji chemicznej, a po zakończeniu reakcji jest w całości odzyskiwana.
- Katalizatory homogeniczne są w innej fazie niż substraty.
- Katalizatory heterogeniczne są w tej samej fazie co substraty.
Połącz pojęcia z definicją.
najmniejsza ilość energii, jaką muszą mieć cząsteczki substratów do utworzenia kompleksu aktywnego., substancja chemiczna w innej fazie niż substraty – jej dodatek do reakcji powoduje przyspieszenie reakcji chemicznej, a po zakończeniu reakcji jest w całości odzyskiwana., energia danego układu termodynamicznego, na którą składa się energia potencjalna i energia kinetyczna., substancja chemiczna w takiej samej fazie co substraty – jej dodatek do reakcji powoduje przyspieszenie reakcji chemicznej, a po zakończeniu reakcji jest w całości odzyskiwana.
| Energia aktywacji | |
| Katalizator homogeniczny | |
| Katalizator heterogeniczny | |
| Energia wewnętrzna |
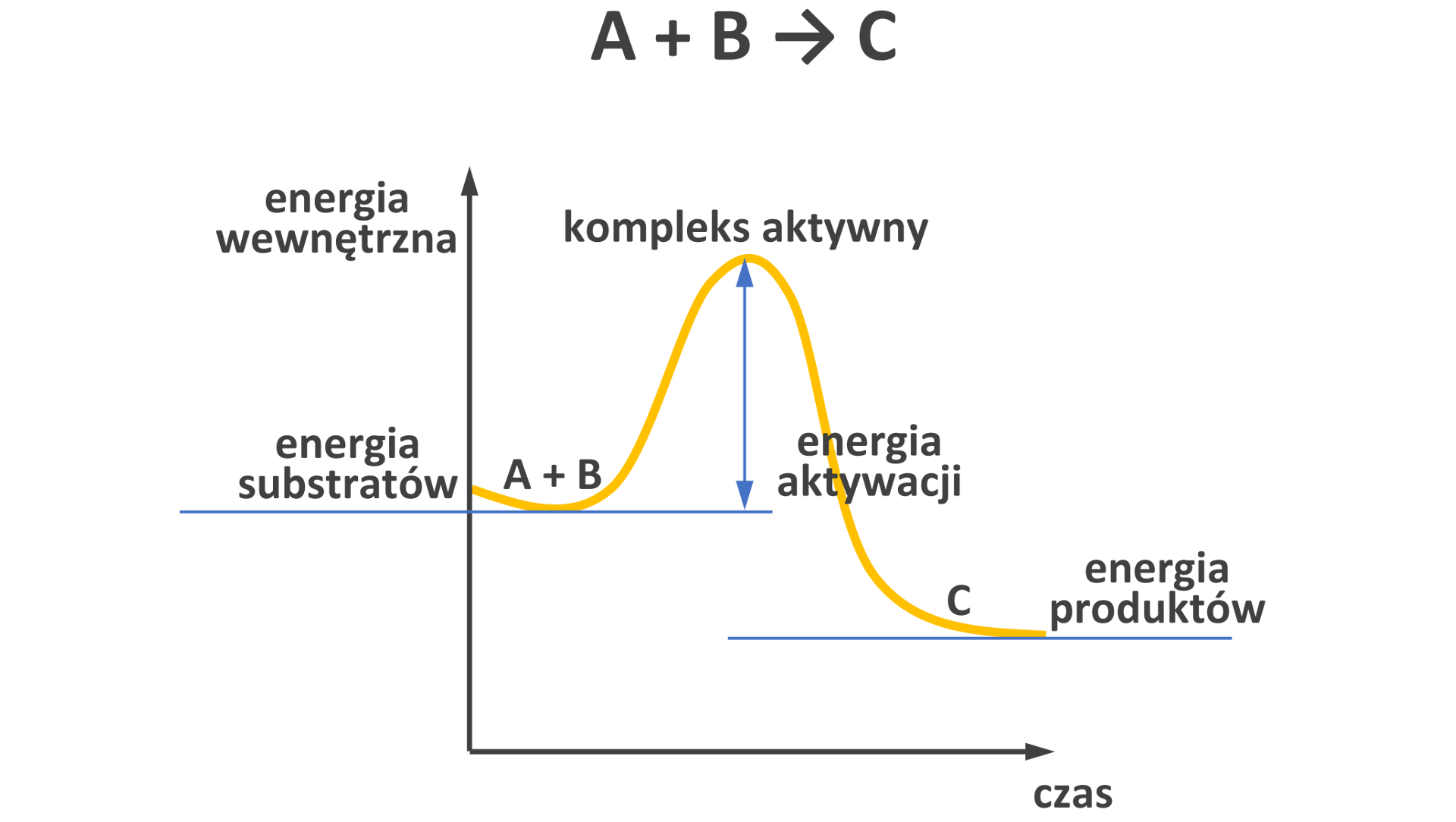
Naszkicuj wykres zależności energii wewnętrznej od czasu dla podanej reakcji. Uwzględnij wszystkie ważne opisy charakteryzujące ten wykres.
Przeprowadzono doświadczenie, zgodnie ze schematem zaprezentowanym na poniższym rysunku.
Przeprowadzono doświadczenie. Zapoznaj się z opisem schematu.
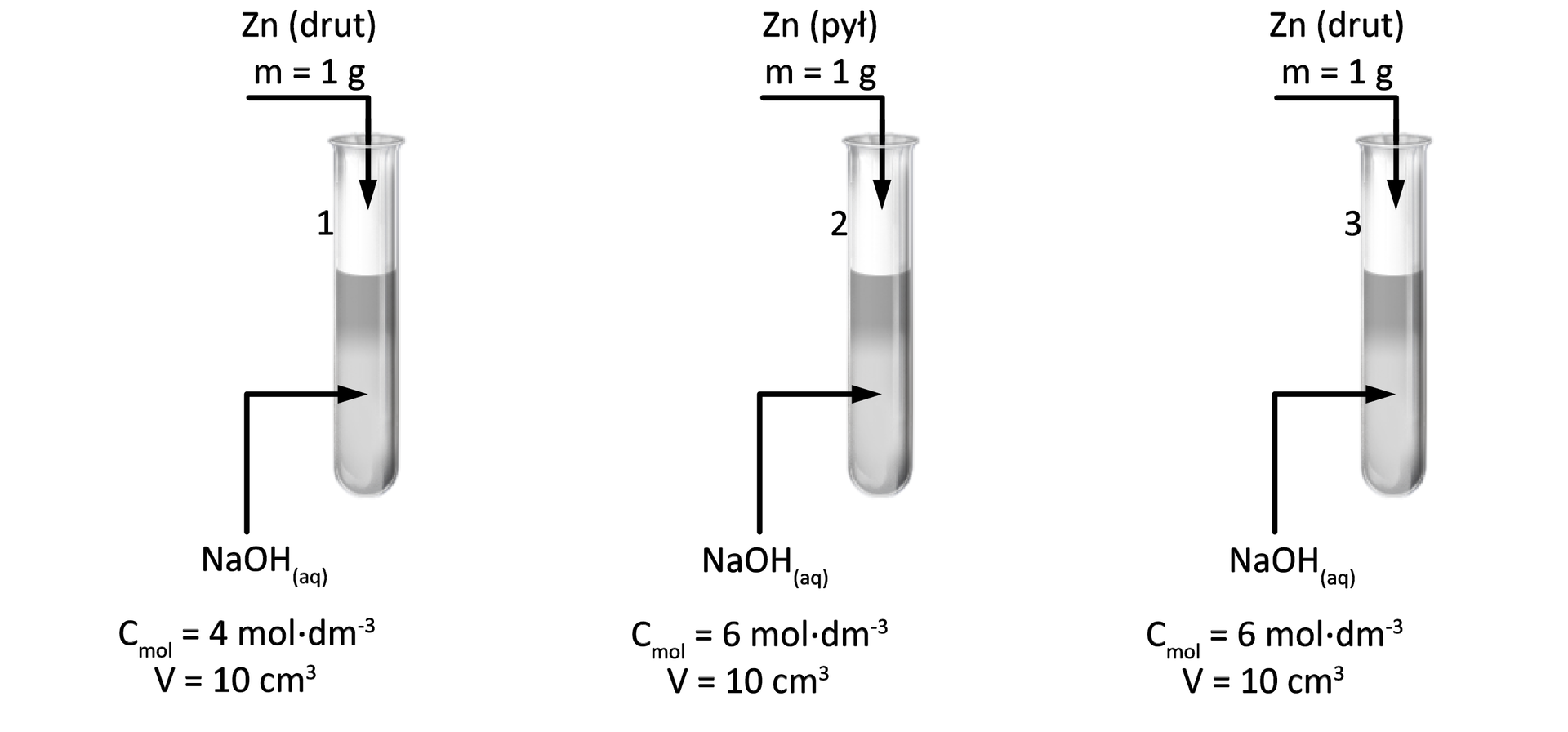
W każdej z probówek zachodzi ta sama reakcja chemiczna:
Zmianę stężeń anionu w czasie w probówkach – obrazują krzywe na poniższym uproszczonym wykresie:
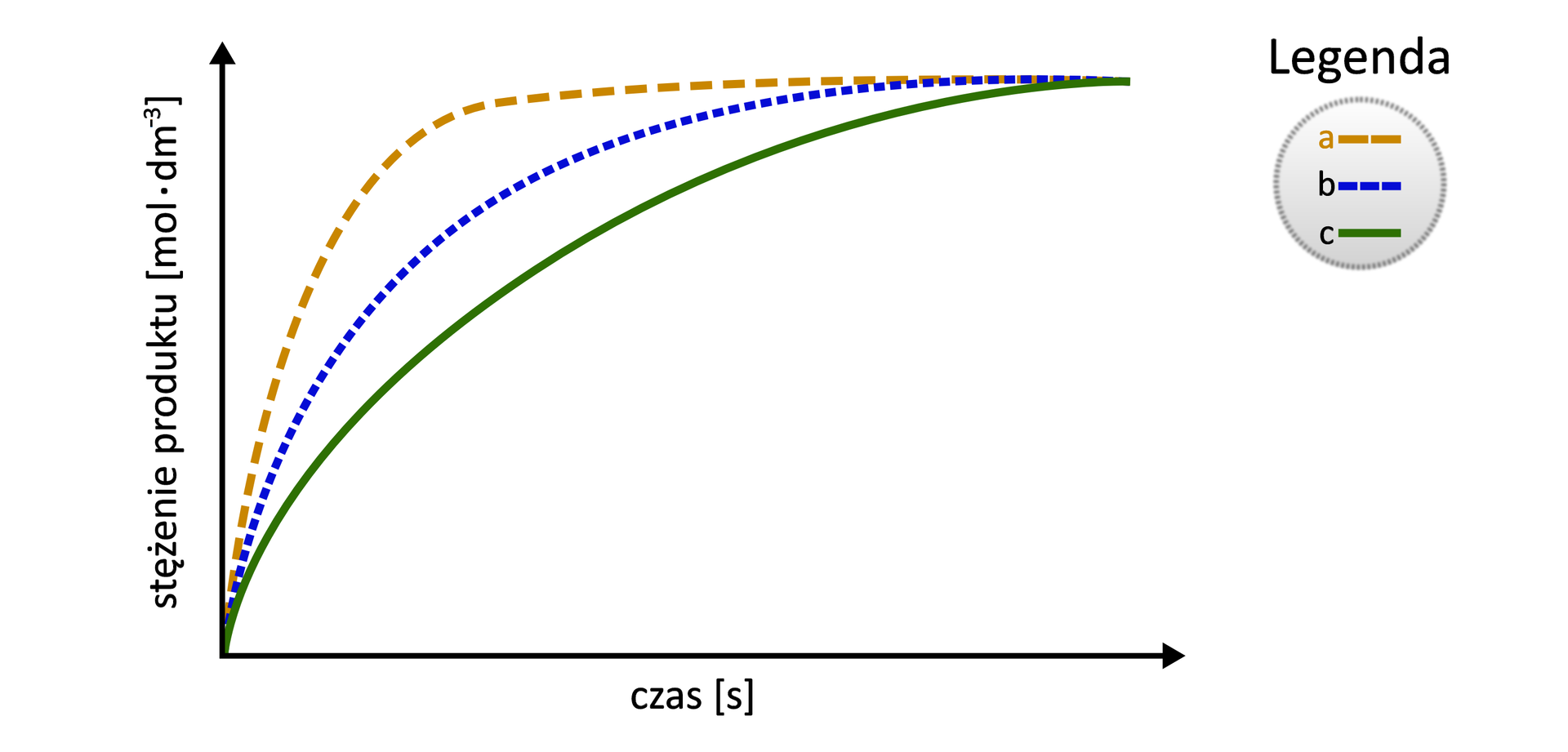
Krzywym – przypisz odpowiadające im probówki –, tak aby wykres prawidłowo opisywał różnicę w zmianach stężeń anionu . W tym celu uzupełnij poniższą tabelę, wstawiając numery probówek –.
a, b, c
| Krzywa na wykresie | Numer probówki |
|---|---|
| a | |
| b | |
| c |
Przeprowadzono poniższe doświadczenie.
W pierwszej kolbie stożkowej umieszczono stężony roztwór nadtlenku wodoru (), który pozostawiono na tydzień otwarty. Po tym czasie okazało się, że w kolbie jest woda (). W drugiej kolbie stożkowej umieszczono stężony roztwór nadtlenku wodoru (), a następnie dodano nasycony roztwór wodny . Mieszanina przybrała pomarańczową barwę i zaobserwowano po chwili wydzielanie się gazu, który spowodował, że łuczywo zapaliło się.
Porównaj reakcje, które miały miejsce w kolbach i napisz odpowiednie równania reakcji dla każdej z nich.
W reaktorze zmieszano znane ilości wodoru i jodu.
Utrzymując odpowiednie warunki reakcji, mierzono zmiany stężeń reagentów i produktu, aż do ustalenia stanu równowagi dla tego procesu. Wybierz wykres, który zobrazuje najkorzystniejsze warunki dla tego procesu. Wyjaśnij dlaczego ten.

W reaktorze zmieszano znane ilości wodoru i jodu, z których zgodnie z równaniem reakcji powstał jodowodór.
Utrzymując odpowiednie warunki reakcji, mierzono zmiany stężeń reagentów i produktu, aż do ustalenia stanu równowagi dla tego procesu. Wybierz wykres, która z podanych energii aktywacji odpowiada najkorzystniejszym warunkom dla tego procesu.
- 184 kilodżule na mol
- 105 kilodżuli na mol
- 59 kilodżuli na mol
- 201 kilodżuli na mol
- 184 kilodżule na mol
- 105 kilodżuli na mol
- 59 kilodżuli na mol
- 201 kilodżuli na mol
Przeprowadzono doświadczenie: do dwóch probówek dodano takie same ilości kwasu solnego o takim samym stężeniu oraz metalicznego cynku. Do jednej z nich dodatkowo dodano wodny roztwór siarczanu() miedzi() o stężeniu . Zauważono wydzielanie gazu z obu probówek.
W której probówce reakcja zachodzi szybciej?
Dlaczego tak się dzieje?
Co stanie się z siarczanem() miedzi() po przebiegu reakcji?
Jaką rolę w tej reakcji pełni sól miedzi()?
Na podstawie równań reakcji ustal:
Wzór katalizatora.
Wzór produktu przejściowego.
Równanie reakcji bez katalizatora.
Etap
Etap
Przeprowadzono doświadczenie, zgodnie ze schematem zaprezentowanym na poniższym rysunku.
Przeprowadzono doświadczenie. Zapoznaj się z opisem rysunku.
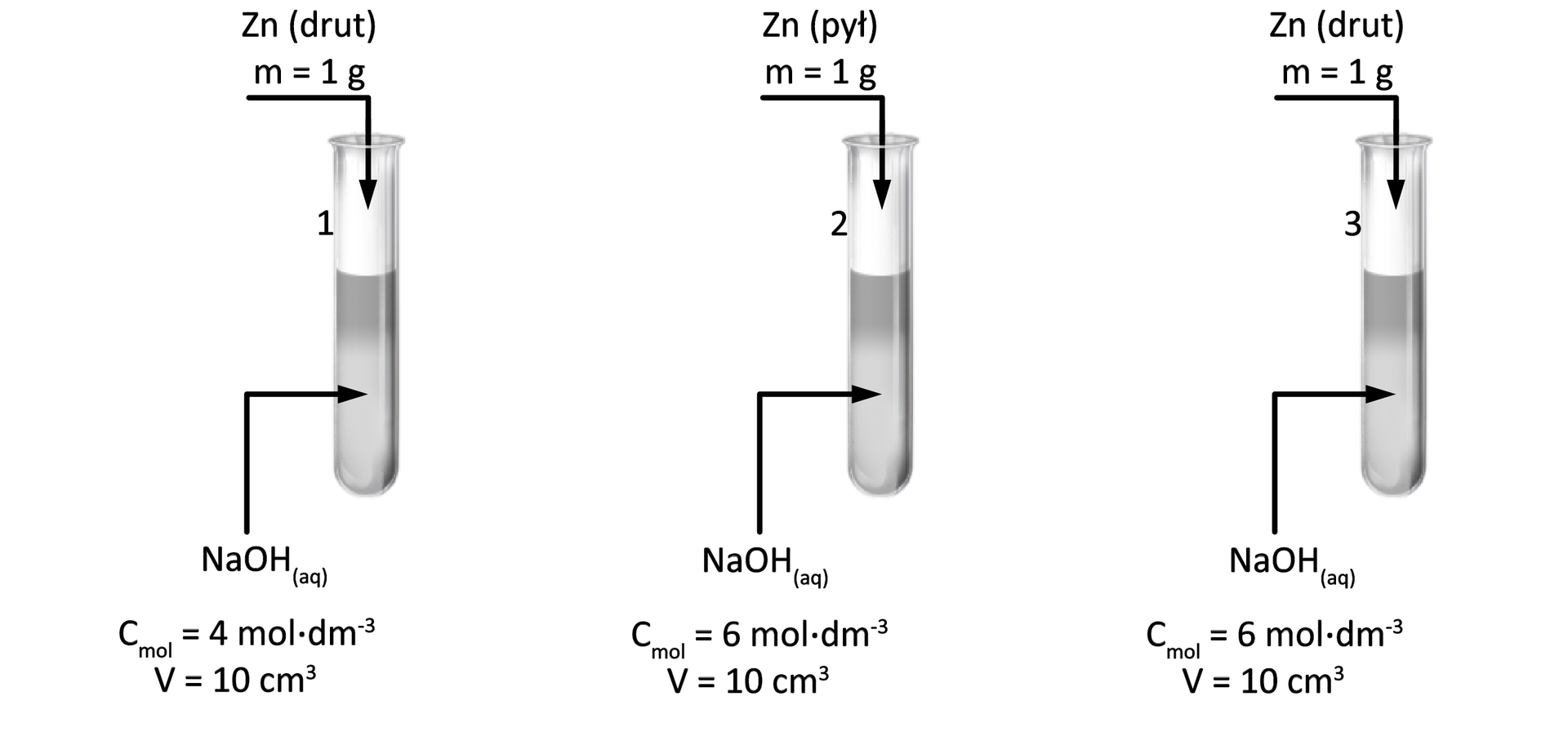
W każdej z probówek zachodzi ta sama reakcja chemiczna:
Napisz, jakie dodatkowe czynniki, które nie pojawiają się na rysunku w informacji wprowadzającej, można zastosować, aby zwiększyć szybkość reakcji chemicznej.