Substancje proste i złożone
Poniższy materiał stanowi uzupełnienie treści znajdujących się w materiale: https://zpe.gov.pl/a/substancje-i-ich-wlasciwosci–podsumowanie/D1Fn8eONk
Czy pamiętasz, że wszystko, co nas otacza nazywamy materią? Składają się na nią różnego rodzaju substancje, które charakteryzują się odmiennymi właściwościami zarówno fizycznymi, jak i chemicznymi. Praca chemika bardzo często opiera się na badaniu ich. Czy wiesz, jak je odróżnić? Z pracą z rożnymi substancjami wiąże się również ogromne ryzyko, ze względu na zagrożenia, jakie mogą powodować. Dlatego niezwykle istotne jest właściwie rozpoznanie znaków ostrzegawczych i stosowanie się do nich podczas wykonywania doświadczeń chemicznych, nawet tych najprostszych.
podstawowe szkło i sprzęt laboratoryjny;
sposób opisu doświadczeń chemicznych;
różnice pomiędzy substancją prostą a złożoną.
podawać przykłady substancji prostych i złożonych;
odróżniać właściwości fizyczne od chemicznych;
rozpoznawać piktogramy ostrzegawcze.
Znasz już najważniejsze substancjesubstancje, którymi zarówno otaczamy się na co dzień, jak i te, z którymi dopiero spotykamy się w laboratorium chemicznym. Przypomnijmy sobie kilka podstawowych wiadomości.
1. Substancje proste i złożone – mapa pojęć
Substancje dzielą się na proste oraz złożone. Substancje prosteSubstancje proste, czyli pierwiastki stanowią zbiór atomów o tej samej liczbie atomowej i charakteryzują się tym, że za pomocą prostych metod nie możemy ich rozłożyć na prostsze. Należy pamiętać, że substancje proste mogą również występować jako cząsteczki homoatomowe, np. , czy . Natomiast substancje złożonesubstancje złożone można rozłożyć na prostsze za pomocą stosunkowo prostych metod. Są to związki chemiczne, które stanowią zbiór atomów co najmniej dwóch pierwiastków, połączonych ze sobą za pomocą wiązania chemicznego.
Skonstruuj mapę pojęć wokół słowa „substancje”. W tym celu skorzystaj z haseł takich jak „proste”, „złożone”, dodatkowo scharakteryzuj je oraz podaj po dwa przykłady substancji prostych i złożonych występujących w różnych stanach skupienia (gazowym, ciekłym lub stałym).
Opisz substancje proste oraz substancje złożone. Podaj ich charakterystykę oraz po dwa przykłady substancji prostych i złożonych występujących w różnych stanach skupienia (gazowy, ciekły i stały)
Zastanów się i odpowiedz na pytanie – czy mieszaninę fosforu i siarki możemy nazwać substancją złożoną? Swoją odpowiedź uzasadnij.
2. Właściwości fizyczne i chemiczne substancji
Wszystkie substancje mają pewne charakterystyczne właściwości, które dzielimy na właściwości fizycznefizyczne oraz chemicznechemiczne.
Znajdź podobieństwa i różnice we właściwościach fizycznych następujących substancji: soli kuchennej, cukru, mąki, węgla, żelaznego drutu, oliwy z oliwek. Porównaj ich barwy, stan skupienia, rozpuszczalność w wodzie.
W tym celu wykonaj poniższe doświadczenie.
Poznaj podobieństwa i różnice we właściwościach fizycznych następujących substancji: soli kuchennej, cukru, mąki, węgla, żelaznego drutu, oliwy z oliwek. Zapoznaj się z poniższym doświadczeniem.
Problem badawczy: W jaki sposób można zidentyfikować właściwości fizyczne substancji i ich mieszanin?
Hipoteza: Właściwości fizyczne substancji i ich mieszanin można zidentyfikować za pomocą zmysłu wzroku.
Co było potrzebne:
sól kuchenna;
cukier;
mąka;
węgiel;
oliwa z oliwek;
żelazny drut;
sześć szalek Petriego;
sześć zlewek;
sześć pręcików szklanych.
Przebieg doświadczenia:
Na czterech szalkach Petriego umieszczono kolejno po łyżeczce soli kuchennej, cukru, mąki oraz oliwy z oliwek. Na piątej szalce położono kawałek żelaznego drutu, a na szóstej kawałek węgla. Następnie określono stan skupienia oraz barwę badanych substancji. Do zlewek wlano wodę do połowy ich objętości, dodano badane substancje z szalek Petriego i wymieszano pręcikiem szklanym. Na końcu określono rozpuszczalność substancji w wodzie.
Obserwacje:
Substancja | Stan skupienia | Barwa | Rozpuszczalność w wodzie |
|---|---|---|---|
sól kuchenna | stały | biała | bardzo dobrze rozpuszcza się w wodzie |
cukier | stały | biała | bardzo dobrze rozpuszcza się w wodzie |
mąka | stały | biała | bardzo słabo rozpuszcza się w wodzie/nie rozpuszcza się w wodzie |
węgiel | stały | czarna | nie rozpuszcza się w wodzie |
oliwa z oliwek | ciekły | żółta | bardzo słabo rozpuszcza się w wodzie/nie rozpuszcza się w wodzie |
żelazny drut | stały | srebrzystoszara | nie rozpuszcza się w wodzie |
Wykonaj doświadczenie chemiczne, które polega na zbadaniu palności magnezu.
Problem badawczy: Czy magnez ulega spalaniu?
Hipoteza: Magnez jest substancją palną.
Co było potrzebne:
wstążka magnezowa;
papier ścierny;
palnik;
szczypce metalowe;
ciemne okulary ochronne.
Przebieg doświadczenia:
Niewielki kawałek wstążki magnezowej dokładnie oczyszczono za pomocą papieru ściernego. Następnie chwycono, za pomocą metalowych szczypiec, wstążkę i utrzymywano w płomieniu palnika.
Obserwacje: Wstążka magnezowa spala się jasnym, oślepiającym płomieniem. Po spaleniu, na szczypcach metalowych pozostaje biały proszek.
Wnioski: Magnez ulega reakcji spalania. Wyjaśnienie: magnez spala się charakterystycznym, oślepiającym płomieniem do tlenku magnezu, czyli białego osadu pozostałego na metalowych szczypcach. Równanie reakcji spalania magnezu:
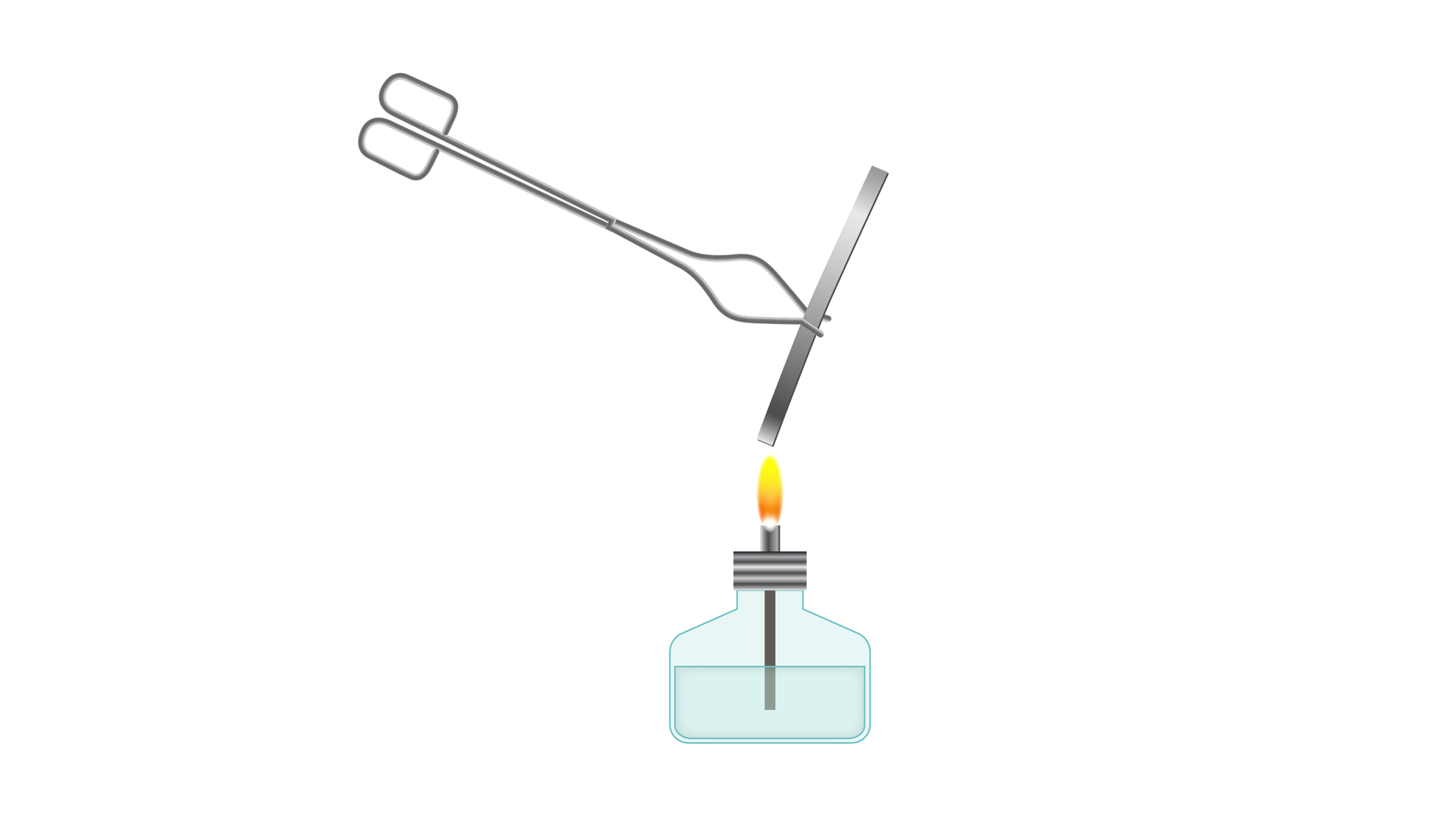

Odpowiedz, dlaczego podczas spalania substancji należy pamiętać o założeniu okularów ochronnych? Uzasadnij swoją odpowiedź.
3. Znaki ostrzegawcze (piktogramy)
Na opakowaniach substancji chemicznych możemy zauważyć pewne charakterystyczne symbole graficzne. Symbole te stosowane są w oznaczaniu odczynników chemicznych i informują one o różnych rodzajach zagrożeń, z jakimi możemy mieć do czynienia w bezpośrednim kontakcie z tymi substancjami. Znaki te nazywamy piktogramami ostrzegawczymipiktogramami ostrzegawczymi.
4. Stany skupienia materii
W określonej temperaturze i przy odpowiednim ciśnieniu substancje występują w jednym z trzech podstawowych stanów skupienia: stałym, ciekłym oraz gazowym. W odpowiednich warunkach, mogą one zmieniać stan skupienia, np. z ciekłego na stały czy ze stałego na gazowy.
Wykonaj doświadczenie chemiczne polegające na obserwacji procesu sublimacji.
Problem badawczy: Na czym polega zjawisko sublimacji?
Hipoteza: Sublimacja to proces przejścia substancji ze stanu stałego w stan gazowy, z pominięciem stanu ciekłego.
Co było potrzebne:
suchy lód (zestalony tlenek węgla;
duży krystalizator;
woda wodociągowa.
Przebieg doświadczenia: Do krystalizatora wsypano suchy lód. Następnie powoli wlewano wodę wodociągową.
Obserwacje: Podczas wlewania wody do krystalizatora, pojawiają się kłęby gazu.
Wnioski: Zestalony tlenek węgla uległ sublimacji do gazowego tlenku węgla. Temperatura sublimacji wynosi i osiągana jest w momencie polewania suchego lodu wodą. Bez ogrzewania, suchy lód w temperaturze pokojowej sublimuje do kilku godzin, w zależności o wielkości bloków.
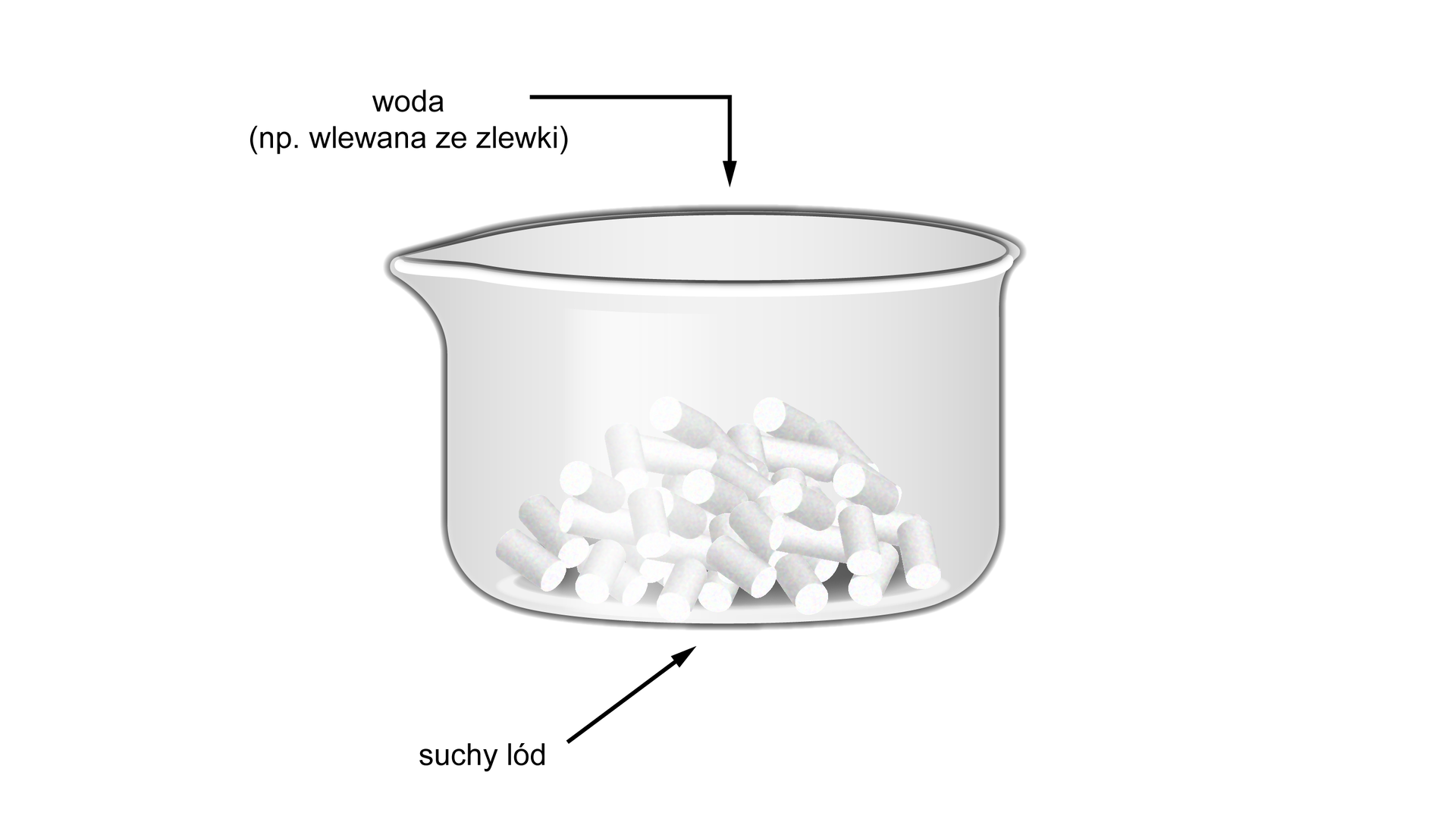

Napisz, czym jest sublimacja.
Słownik
rodzaj jednorodnej materii (o stałym składzie chemicznym) o określonych właściwościach (cechach charakterystycznych, np. stan skupienia, w danych warunkach, barwa, twardość, palność), np. woda, żelazo, miedź, glin
pierwiastki, które stanowią zbiór atomów o tej samej liczbie atomowej i charakteryzują się tym, że za pomocą prostych metod nie możemy ich rozłożyć na prostsze
związki chemiczne stanowiące zbiór atomów co najmniej dwóch pierwiastków połączonych ze sobą za pomocą wiązania chemicznego; można je rozłożyć na prostsze za pomocą prostych metod
cechy substancji, które można określić na podstawie jej zachowania wobec innych substancji; do właściwości chemicznych zaliczamy między innymi: palność, reaktywność, zapach, smak
charakterystyczne cechy danej substancji, takie jak: stan skupienia, barwa, rozpuszczalność (rozpuszczanie to zjawisko fizyczne), przewodnictwo elektryczne, przewodnictwo cieplne, temperatury wrzenia i topnienia, twardość, kruchość, kowalność, połysk, gęstość, właściwości magnetyczne
znaki wskazujące na rodzaj zagrożenia spowodowanych przez niebezpieczne substancje chemiczne; umieszczane na butelkach i opakowaniach substancji chemicznych i mieszanin
Ćwiczenia
Z tą zmianą stanu skupienia mamy do czynienia przy powstawaniu porannej rosy. — 1. krzepnięcie, 2. topnienie, 3. wrzenie, 4. resublimacja, 5. sublimacja, 6. skraplanie
Ta zmiana stanu skupienia wykorzystywania jest podczas pierwszego etapu destylacji. — 1. krzepnięcie, 2. topnienie, 3. wrzenie, 4. resublimacja, 5. sublimacja, 6. skraplanie
Z tą zmianą stanu skupienia mamy do czynienia podczas chłodzenia par jodu lub naftalenu. — 1. krzepnięcie, 2. topnienie, 3. wrzenie, 4. resublimacja, 5. sublimacja, 6. skraplanie
Z tą zmianą stanu skupienia mamy do czynienia w pierwszym etapie ogrzewania siarki na łyżce do spalań nad palnikiem spirytusowym. — 1. krzepnięcie, 2. topnienie, 3. wrzenie, 4. resublimacja, 5. sublimacja, 6. skraplanie
Z tą zmianą stanu skupienia mamy do czynienia podczas ogrzewania suchego lodu lub naftalenu. — 1. krzepnięcie, 2. topnienie, 3. wrzenie, 4. resublimacja, 5. sublimacja, 6. skraplanie
Poniżej przedstawiono opis pewnej substancji chemicznej.
W początkowych latach substancja ta była bardzo problematyczna w użyciu, ponieważ była ogromnie wrażliwa na niewielkie bodźce mechaniczne i nawet gdy dochodziło do miejscowego przegrzania, kończyło się to niekontrolowaną eksplozją. Z tego też powodu substancja ta była źródłem wielu wypadków.
Poniżej przedstawiono opis pewnej substancji chemicznej.
W początkowych latach substancja ta była bardzo problematyczna w użyciu, ponieważ była ogromnie wrażliwa na niewielkie bodźce mechaniczne i nawet gdy dochodziło do miejscowego przegrzania, kończyło się to niekontrolowaną eksplozją. Z tego też powodu substancja ta była źródłem wielu wypadków.
Zaznacz, jaki piktogram mówi o opisanym zagrożeniu.
Zaznacz przykłady reakcji, w której z dwóch substancji prostych powstaje substancja złożona.
Zaznacz przykłady reakcji w której z substancji złożonej otrzymuje się dwie substancje proste.
Bibliografia
Kulawik J., Kulawik T., Litwin M., Podręcznik do chemii dla klasy siódmej szkoły podstawowej, Warszawa 2020.
Łasiński D., Sporny Ł., Strutyńska D., Wróblewski P., Podręcznik dla klasy siódmej szkoły podstawowej, Mac Edukacja 2020.