Terapia genowa
Młody człowiek, który od urodzenia traci wzrok, poddaje się terapii preparatem zawierającym wirusy z kopią genu niezbędnego do prawidłowej pracy fotoreceptorów. Gdy odwiedzamy go po 2 latach, rozpoznaje niektóre kształty i świecące obiekty. Po kolejnych kilku latach w znacznym stopniu odzyskuje zdolność widzenia. Czy to sceny z filmu science fiction, czy realne osiągnięcia biologii molekularnej?

rodzaje mutacji genowych i chromosomowych;
przykłady chorób wywołanych mutacjami, ich objawy i leczenie.
Wyjaśnisz istotę terapii genowej.
Przedstawisz szanse i zagrożenia wynikające z zastosowania terapii genowej.
Przedyskutujesz problemy społeczne i etyczne związane z rozwojem inżynierii genetycznej oraz sformułujesz własne opinie w tym zakresie.
1. Początki terapii genowej

Termin „terapia genowaterapia genowa” został wprowadzony w 1962 r. przez Wacława SzybalskiegoWacława Szybalskiego. Wraz z żoną, Elizabeth Szybalski, przeprowadził on jedną z pierwszych modyfikacji genetycznych komórek eukariotycznych. Udało mu się wprowadzić fragment prawidłowego ludzkiego DNA w miejsce zmutowanych genów w komórkach szpiku. W ten sposób po raz pierwszy dokonano naprawy nieprawidłowej nici DNA, co stanowiło podwaliny metodologii terapii genowej.
Terapia genowa to metoda leczenia chorób genetycznych polegająca na wprowadzeniu do komórek prawidłowej kopii genu, którego defekt jest przyczyną choroby. Celem terapii może być również włączenie lub wyłączenie funkcji danego genu albo wprowadzenie dodatkowego genu terapeutycznego.
Po raz pierwszy terapię genową u człowieka zastosowano we wczesnych latach 90. zeszłego stulecia w USA. Leczenie dotyczyło ciężkiego niedoboru odporności spowodowanego mutacją w genie deaminazy adenozynowej (ADA) i polegało na transferze prawidłowego genu ADA do limfocytówlimfocytów czteroletniej pacjentki. Choroba objawiała się małym przyrostem masy ciała, niskim wzrostem, częstymi, nawracającymi zakażeniami, m.in. zapaleniem płuc i sepsą. Dzieciom z nieleczonym ciężkim niedoborem odporności grozi śmierć, zwykle przed ukończeniem 2. roku życia. U dziewczynki poddanej terapii genowej po 5 latach od zabiegu zaobserwowano wzrost ilości brakującego enzymu, co poprawiło jej stan zdrowia.
Od tego wydarzenia do roku 2004 przeprowadzono ponad 900 prób klinicznych terapii genowej na całym świecie (większość z nich w USA, Wielkiej Brytanii, Niemczech i Szwajcarii), do roku 2007 było ich już 1200, a w roku 2016 – 1714. W 2023 roku na świecie toczy się ponad 405 tys. badań klinicznych w 220 krajach. Należy pamiętać, że terapia genowa mimo tak wielkiej liczby prób i doświadczeń nadal pozostaje eksperymentalną dziedziną medycyny. Większość strategii i metod transformacji komórek pozostaje na etapie doświadczeń laboratoryjnych.
Profesor Szybalski, studiując ponad 50 lat temu zagadnienia terapii genowej, przyrównywał uszkodzenia DNA i wynikające z nich problemy zdrowotne do psującego się auta. Twierdził, że jeśli przyczyną nieprawidłowego funkcjonowania organizmu jest wadliwy gen, to - tak jak w przypadku zepsutego mechanizmu samochodu - trzeba go wymienić na inny. Porównanie to zainspirowało naukowca do poszukiwań sposobów wymiany genów najpierw w wyizolowanych komórkach, a następnie u chorych ludzi.
2. Wektory terapii genowej
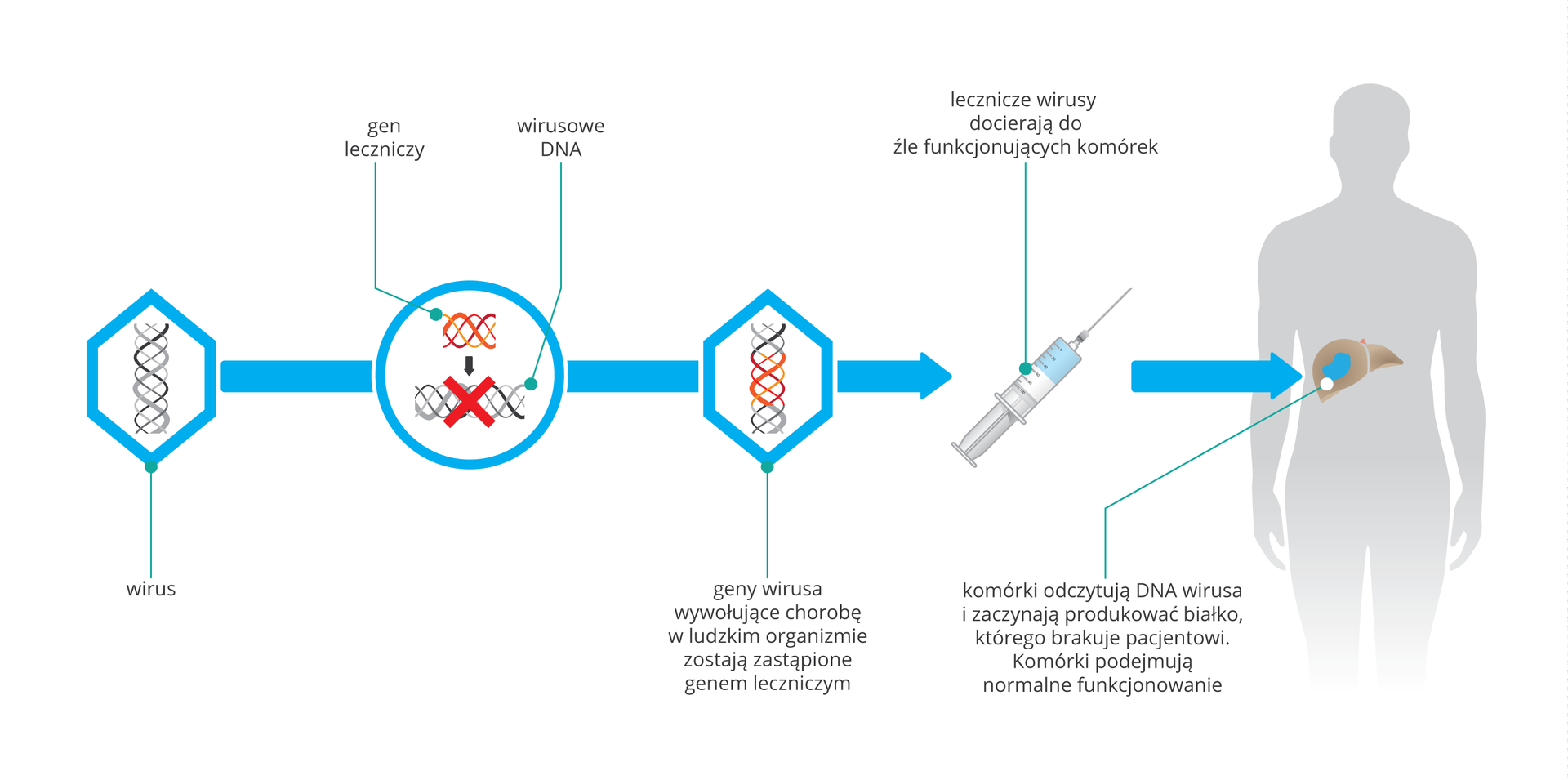
Wektory genetyczneWektory genetyczne są używane w celu wprowadzenia materiału genetycznego do komórek organizmu poddawanego terapii. Do najbardziej popularnych należą wektory wirusowe. W celach terapeutycznych stosuje się zmodyfikowane cząsteczki wirusów, które mogą wprowadzać DNA kodujące np. lecznicze białka.
Przykłady wektorów wirusowych:
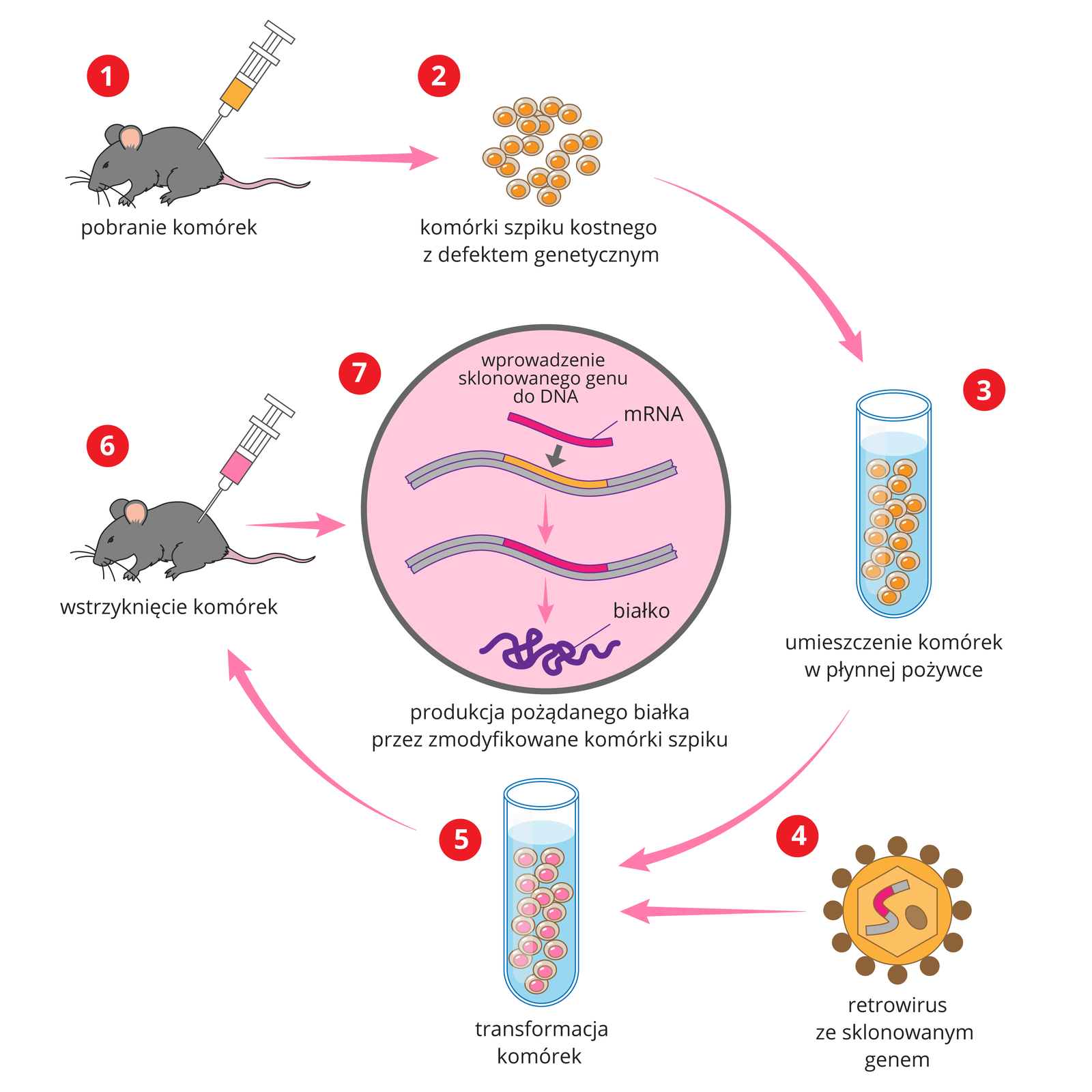
Wektory retrowirusoweretrowirusowe są jednym z najczęściej używanych narzędzi w transformacjitransformacji komórek. Materiał genetyczny retrowirusów stanowi RNA, które po przedostaniu się do komórki gospodarza zostaje „przepisane” na DNA, dzięki czemu ulega integracji z genomem. W konsekwencji wektory wyprodukowane na bazie retrowirusów warunkują stabilną ekspresję genu terapeutycznego. Ponadto wektory te łatwo się otrzymuje i modyfikuje.
Wektory adenowirusoweadenowirusowe mają materiał genetyczny w postaci liniowego, dwuniciowego DNA. Należą do najczęściej stosowanych i zarazem najbardziej uniwersalnych nośników wirusowych. Ich zaletą jest łatwość wnikania do większości tkanek. Dotyczy to wszystkich typów komórek, zarówno dzielących się, jak i niedzielących, a ich skuteczność in vitro często osiąga 100%.
Wirusy te nie mogą zakazić organizmu, ponieważ w wyniku przekształceń genetycznych zostały pozbawione genów niebezpiecznych dla człowieka. Dużą zaletą stosowania w terapii wektorów wirusowych jest fakt, że przenoszony przez nie kwas nukleinowy z prawidłowym genem może zostać trwale wbudowany do genomu komórek organizmu. Pozwala to na wytwarzanie substancji, kodowanych przez gen terapeutycznygen terapeutyczny, których do tej pory brakowało komórkom.
W terapii genowej można również stosować wektory niewirusowe. Są nimi np. liposomyliposomy tworzące kompleksy z odcinkami kwasów nukleinowych. Często dodaje się do nich białka pochodzące z wirusów albo inne substancje umożliwiające wniknięcie do komórki. Gdy taki kompleks dostaje się do cytoplazmy, następuje oddzielenie się DNA od liposomu. Wprowadzony w ten sposób kwas nukleinowy umożliwia podjęcie produkcji pożądanych substancji. Takim sposobem próbuje się leczyć np. mukowiscydozę. Liposomy rozpyla się w postaci sprayu i wprowadza do oskrzeli chorych, aby brakujący gen został wprowadzony do komórek nabłonka oskrzeli. Metoda ta musi zostać udoskonalona, ale wyniki pierwszych prób klinicznych są obiecujące.
3. Rodzaje i strategie terapii genowej
Terapia genowa składa się z szeregu złożonych metod biotechnologicznych umożliwiających leczenie poprzez naprawę, zamianę lub zablokowanie funkcji pojedynczego genu, odpowiedzialnego za wystąpienie danej jednostki chorobowej. Ze względu na rodzaj komórek wykorzystywanych w terapii genowej wyróżniamy:
Terapię genową dotyczącą komórek rozrodczych (płciowych), z których ma powstać nowy organizm lub komórek tworzących zarodek. Terapia zastosowana wobec zarodka umożliwia dziedziczenie wprowadzonej zmiany – zmiany zostaną przekazane potomstwu, stąd takie zabiegi wykonywane są tylko na zwierzętach. Zabiegi na komórkach rozrodczych człowieka, zarówno ze względu na ich złożoność, nieprzewidywalność skutków w odniesieniu do potomstwa (ryzyko wystąpienia nieprawidłowości w funkcjonowaniu zmienionego genomu lub na skutek nieprawidłowego zintegrowania się z obcym genem), jak i ze względów etycznych, nie powinny być wykonywane. Dlatego terapia komórek rozrodczych jest zabroniona.
Terapię genową komórek somatycznychkomórek somatycznych, czyli budujących organizm, w której zmiany nie są dziedziczone. Taka kuracja ma charakter zachowawczy – leczone są tylko objawy, a nie przyczyna choroby. Zmutowane geny pozostają nadal we wszystkich komórkach organizmu, a więc także w komórkach uczestniczących w wytwarzaniu gamet. Dlatego wadliwy gen jest przekazywany potomstwu, a wprowadzony do organizmu gen terapeutyczny – nie. Zabiegi przeprowadzane na komórkach somatycznych mogą dotyczyć korygowania zarówno defektów genetycznych, jak i niegenetycznych. Postępowanie może dotyczyć komórek, tkanek lub narządów nieprawidłowo funkcjonujących jedynie u danego osobnika poddanego terapii. Obecnie u pacjentów stosuje się wyłącznie terapię somatyczną.
W 2023 r. na terenie Europy terapia genowa jest wykorzystywana w leczeniu chorób takich jak:
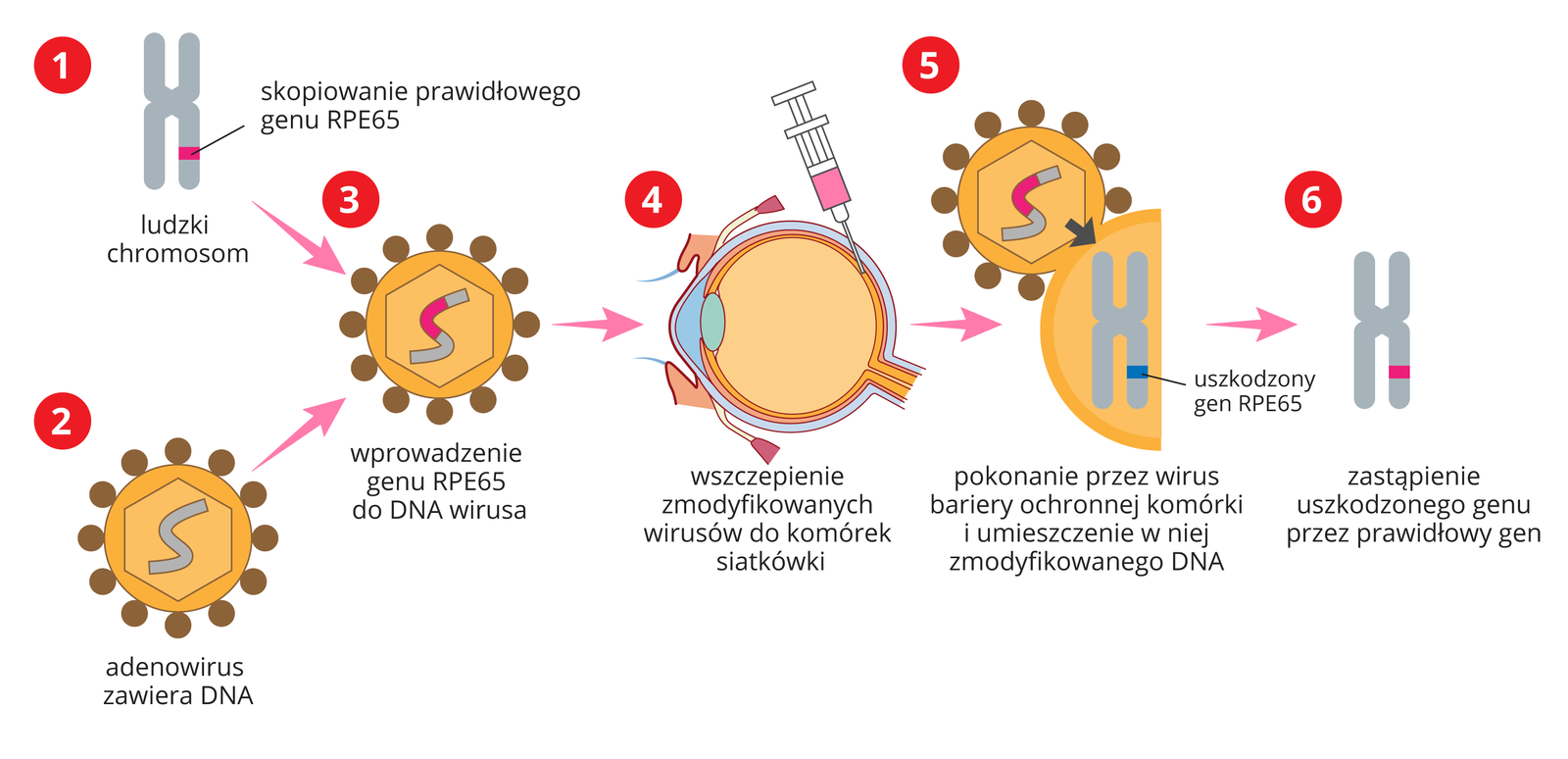
wrodzona ślepota Lebera – choroba autosomalna recesywna wywołana przez mutację jednego z genów kodujących białko niezbędne w procesie widzenia; objawy występują wkrótce po urodzeniu i polegają na stopniowym zaniku nabłonka i naczyń krwionośnych w siatkówce; w ciągu pierwszych 20 lat życia prowadzą do całkowitej ślepoty; na schorzenie to cierpi 1 na 50 tys. osób; od 2017 r. istnieje możliwość leczenia wrodzonej ślepoty Lebera lekiem Luxturna;
ciężki złożony niedobór odporności (zespół SCID) i inne wrodzone lub nabyte niedobory odporności;
niedokrwistości (anemie) spowodowane mutacjami genetycznymi i inne genetyczne choroby krwi – u osób będących homozygotami recesywnymi, niemających prawidłowych wersji danego genu, wprowadza się ich kopie; jeżeli dany gen nie funkcjonuje wystarczająco wydajnie, wprowadza się także kopie dodatkowe, by wzmocnić jego działanie;
czerniak (nowotwór skóry) – może być leczony za pomocą terapii genowej, atakującej komórki nowotworowe, przy jednoczesnym stymulowaniu układu immunologicznego tak, aby samodzielnie rozpoznawał i niszczył te komórki;
stwardnienie rozsiane – może być leczone za pomocą terapii CAR‑T;
SMA (rdzeniowy zanik mięśni) – w jego przypadku terapia genowa jest już dostępna w Polsce;
nowotwory krwi (białaczki, chłoniaki i szpiczak mnogi) – do komórek przeznaczonych do eliminacji wprowadza się geny kodujące białka, które powodują samozniszczenie komórek nowotworowych i nie są toksyczne dla innych składników organizmu; podczas terapii pobiera się białe krwinki pacjenta i „przeprogramowuje” je genetycznie, aby następnie ponownie wprowadzić je do organizmu.
Do tej pory podjęto również próby zastosowania terapii genowej do leczenia m.in.:
pląsawicy Huntingtona – w przypadku tej choroby ekspresja wadliwego genu prowadzi do powstawania białka zawierającego niepotrzebnie powielony ciąg glutamin; takie białko gromadzi się w komórkach nerwowych i je uszkadza, co skutkuje narastającymi niekontrolowanymi ruchami ciała i otępieniem; leczenie polega na zablokowaniu genu kodującego wadliwe białko np. za pomocą niekodujących fragmentów DNA;
niektórych chorób nowotworowych (np. glejaka wielopostaciowego);
chorób wywołanych przez mutacje jednogenowe, jak mukowiscydoza czy hemofilia;
chorób neurodegeneracyjnych.
Prowadzone są także badania nad leczeniem cukrzycy typu 1. Obecnie wykorzystuje się do nich myszy laboratoryjne z celowo wywołaną chorobą. Terapia polega na wprowadzeniu do trzustki chorych zwierząt genu odpowiadającego za produkcję insuliny. Doświadczenia przyniosły obiecujące rezultaty. Całkowita poprawa stanu zdrowia nastąpiła u połowy myszy biorących udział w eksperymencie. Ich trzustka zaczęła produkować hormon, dzięki czemu można było odstawić insulinę podawaną myszom jako lek.
Niestety, droga do leczenia cukrzycy tą metodą u ludzi jest jeszcze daleka. Główny problem stanowi konieczność identyfikacji osób zagrożonych zachorowaniem na cukrzycę przed wystąpieniem jej pierwszych objawów. Obecnie jest to bardzo trudne, ponieważ nie są jeszcze znane wszystkie czynniki aktywujące chorobę ani odpowiadające za jej postęp.
Chorym na rzadki wrodzony niedobór lipazy lipoproteinowej (choroba LPLD), mającym podwyższone stężenie cholesterolu i nawracające zapalenie trzustki, podawano w terapii genowej lek Glybera. Lek ten aplikowano w serii wstrzyknięć domięśniowych, a jedna dawka leku zawierała 1 × 10Indeks górny 1212 kopii genu. Koszt leczenia jednego pacjenta wynosił 1,2 mln euro. Ze względu na cenę i rzadkość choroby (około 1 osoba na milion) lek został wycofany w 2017 r. (po podaniu go 31 pacjentom).
4. Kontrowersje wokół terapii genowej
Wprowadzanie obcych cząsteczek DNA do ludzkiego organizmu rodzi liczne obawy. Pomimo wielu prób leczenia (m.in. anemii, czerniaka, wrodzonej ślepoty Lebera) i obiecujących rezultatów stosowanie terapii genowej jest w niektórych przypadkach ryzykowne, a nawet niebezpieczne ze względu na skutki uboczne. Terapia genowa to obecnie terapia eksperymentalnaterapia eksperymentalna, przez co nie może być powszechnie wykorzystywana.
Stosowanie wirusów w terapii genowej ludzi niesie ze sobą pewne ryzyko, chociaż geny niebezpieczne dla człowieka są z nich usuwane. Ryzyko to wiąże się z tym, że:
materiał genetyczny wirusów łatwo ulega mutacjom, dlatego zmodyfikowany wirus znów może się stać niebezpieczny;
nie można kontrolować miejsca, w którym wbudują się geny terapeutyczne, co w efekcie zmniejsza wydajność terapii; źle wbudowany gen może też tworzyć nieprawidłową sekwencję – nową wadę genetyczną.
Trudności terapii genowej:
Nawet jeśli uda się wprowadzić gen terapeutyczny do chromosomu komórkowego, nie jest łatwo wywołać jego ekspresję. Dzieje się tak, ponieważ genom ludzki jest bardziej skomplikowany niż bakteryjny, a metody regulacji ekspresji genów nie są jeszcze dobrze poznane.
Stężenie niektórych białek w organizmie musi być precyzyjnie określone. Zarówno niedobór, jak i nadmiar są niekorzystne dla organizmu.
Obce dla organizmu białko zazwyczaj zostaje zniszczone przez układ odpornościowy, dlatego terapia genowa jest skuteczna wtedy, gdy organizm produkuje nawet minimalne ilości białka kodowanego przez wszczepiony gen.
Choroby genetyczne powodowane przez zaburzenia większej ilości genów wywierają duży wpływ na procesy życiowe organizmu i upośledzają tyle reakcji biochemicznych, że wszczepienie komórek z naprawionym genem może nie spowodować wyleczenia.
Rozwój inżynierii genetycznej, badania nad nowymi wektorami kwasów nukleinowych i nad poprawą ich efektywności oraz bezpieczeństwa pozwalają sądzić, że być może w nadchodzących latach terapia genowa stanie się szeroko dostępną, bezpieczną i skuteczną formą leczenia przynajmniej części chorób, stanowiąc uzupełnienie dla metod konwencjonalnych.
Jedną z chorób genetycznych jest mukowiscydoza. Objawia się ona wydzielaniem bardzo lepkiego śluzu, który zaburza pracę narządów wyposażonych w gruczoły śluzowe – np. jelit, tchawicy i oskrzeli. Naukowcy z Uniwersytetu w Karolinie Północnej wykorzystali w swoich badaniach zmodyfikowanego wirusa paragrypy, który przenosi poprawną kopię genu do komórek osoby chorej na mukowiscydozę. W wyniku tego ok. 70% komórek otrzymało poprawny gen i zaczęło prawidłowo funkcjonować, co ograniczyło nadmierną produkcję śluzu. Na razie zastosowany wirus wywołuje paragrypę, choć pozbawienie go możliwości wywoływania infekcji to tylko kwestia czasu.
Podsumowanie
Terapia genowa jest eksperymentalną dziedziną nauki.
Terapia genowa polega na wprowadzeniu obcego kwasu nukleinowego do komórek chorego pacjenta w celach terapeutycznych.
W terapii genowej nośnikiem kwasów nukleinowych są wektory, np. wirusy.
Obecnie terapii genowej mogą być poddawane komórki somatyczne.
Terapia komórek rozrodczych jest zabroniona m.in. ze względów etycznych.
Terapia genowa może być stosowana w leczeniu chorób genetycznych oraz nowotworowych.
Potencjalnym ryzykiem związanym z terapią genową jest: niepożądana reakcja układu odpornościowego (wywołanie stanu zapalnego, niewydolność narządów), wywołanie infekcji wirusowej, ryzyko uszkodzenia nowych komórek i wywołanie objawów innej choroby.
Praca domowa
Zespół Pradera‑Willego spowodowany jest delecją długiego ramienia chromosomu 15. Osoby dotknięte tą chorobą są m.in. niskie, otyłe i odczuwają niepohamowany głód. Chorobę leczy się, podając chorym hormon wzrostu. Wyobraź sobie, że jesteś lekarzem, który może zaproponować osobie z zespołem Pradera‑Willego eksperymentalną terapię genową związaną z podaniem nowego, niesprawdzonego leku. Twoim obowiązkiem jako lekarza jest zapoznanie pacjenta zarówno z potencjalnymi korzyściami, jak i możliwymi zagrożeniami, które niesie ze sobą zastosowanie tego leku. Wymień dwa pozytywne i dwa negatywne potencjalne skutki takiej terapii.
Słownik
rodzina kulistych wielościennych wirusów o genomie zbudowanym z dwuniciowego DNA; występują w drogach oddechowych i układzie pokarmowym większości ludzi; adenowirusy są chorobotwórcze dla człowieka, niektórych ssaków oraz ptaków
gen wprowadzany do organizmu w celu leczenia lub łagodzenia objawów chorób genetycznych
wszystkie komórki organizmu z wyjątkiem komórek płciowych
komórki układu odpornościowego
pęcherzyki wypełnione wodą lub roztworem wodnym, otoczone warstwą lipidową; liposomy sztuczne służą do transportu zamkniętych w nich substancji, jak np. leki czy dermokosmetyki

Wacław Szybalski
Polski uczony, który wraz z żoną, Elizabeth Szybalski, prowadził badania głównie w USA. Obszarem jego zainteresowań były genetyka, biotechnologia i onkologia. Wacław Szybalski był współautorem wielu innowacyjnych technik laboratoryjnych z zakresu biotechnologii.
rodzina wirusów wykorzystujących w procesie replikacji DNA enzym RNA‐zależną polimerazę DNA (odwrotną transkryptazę); swą nazwę zawdzięczają specyficznemu sposobowi syntezy kwasu nukleinowego, rozpoczynającej się od przepisania informacji z RNA na DNA; retrowirusy są szeroko rozpowszechnionymi czynnikami zakaźnymi kręgowców, wywołującymi choroby nowotworowe tkanek pochodzenia mezodermalnego (białaczki, chłoniaki, mięsaki) i nabłonkowego (np. rak sutka, nerek, wątroby), niedobory immunologiczne, choroby autoagresywne
leczenie z wykorzystaniem niezbadanych lub częściowo zbadanych produktów leczniczych i technik stosowane, gdy żadne sprawdzone metody nie przynoszą rezultatu u chorego z poważną lub zagrażającą życiu chorobą oraz wtedy, gdy istnieje nawet niewielka szansa, że nowa terapia może przynieść pacjentowi korzyści
terapia polegająca na wprowadzeniu obcego kwasu nukleinowego do komórek chorego pacjenta w celach terapeutycznych; celem terapii genowej jest naprawienie bezpośredniej przyczyny choroby genetycznej
wprowadzenie obcego fragmentu DNA do komórki prokariotycznej
cząsteczki lub organizmy zdolne do przeniesienia informacji genetycznej do organizmu biorcy
Zadania
Wskaż błędne dokończenie zdania.
Terapia genowa może być stosowana w przypadku
- wirusowych chorób zakaźnych.
- niektórych chorób nowotworowych.
- chorób spowodowanych przez mutacje dominujące.
- schorzeń powstających w wyniku aberracji chromosomowych.
Zaznacz poprawne dokończenie zdania.
Komórki somatyczne
- to komórki, które budują organizm, z wyjątkiem komórek rozrodczych.
- mogą być poddawane terapii genowej.
- to na przykład komórki wątroby i szpiku kostnego.
- po wprowadzeniu leczniczych genów pozwalają przekazać nowo nabytą cechę potomstwu.
- to wszystkie komórki występujące w ciele każdego organizmu.
- zawierają pojedynczy zestaw chromosomów.