Tlen i tlenki
Ocenia się, że krew w tętnicach mózgowych człowieka, aby umożliwiała efektywne myślenie, powinna być nasycona tlenem aż w 90%. Obniżenie tej wartości już o 5% zmniejsza m.in. zdolność koncentracji oraz uruchamia reakcje obronne organizmu, jak np. ziewanie. Spadek poziomu nasycenia krwi tlenem do 75% skutkuje chwiejnością emocjonalną, błędnymi osądami i decyzjami.
Czy bez tlenu, tak ważnego dla organizmów żywych, byłoby możliwe ich funkcjonowanie na Ziemi?

w jaki sposób zaplanować doświadczenie potwierdzające, że powietrze jest mieszaniną;
co to są symbole pierwiastków chemicznych i jak się nimi posługiwać;
w jaki sposób zapisuje się równania reakcji chemicznych;
jak rozpoznać podstawowy sprzęt laboratoryjny i jak się nim posługiwać, w jaki sposób stosować w praktyce zasady bezpieczeństwa w szkolnej pracowni chemicznej.
wskazywać położenie tlenu w układzie okresowym pierwiastków;
podawać przykłady zastosowania tlenu i tlenków w życiu codziennym;
planować i wykonywać doświadczenia pozwalające otrzymać tlen oraz tlenki.
1. Tlen
Jeszcze 300 lat temu uważano, że powietrze jest pierwiastkiem lub związkiem chemicznym, a nie – jak wiemy dzisiaj – mieszaniną gazów. Mimo iż azot stanowi aż 78% objętości powietrza, to jednak jego wyłączna obecność w atmosferze oznaczałaby zupełny brak życia na Ziemi.
Tlen jest najbardziej rozpowszechnionym pierwiastkiem w przyrodzie. Jego zawartość w skorupie ziemskiej wynosi prawie połowę jej masy. Wchodzi on w skład wody, skał, rud metali, piasku.
Tlen jest niezbędny do życia większości organizmów, bez niego giną zwierzęta i rośliny. Obniżenie jego zawartości w powietrzu z 21 do 15% powoduje zaburzenie pracy organizmu, a spadek poniżej 10% może prowadzić do śmierci. Co ciekawe, w 2010 r. europejscy naukowcy odkryli pierwsze większe organizmy wielokomórkowe, które nie potrzebują tlenu do życia. Nieznane wcześniej gatunki znaleziono w osadach znajdujących się na dnie Morza Śródziemnego.
Odpowiedz na pytania:
Co mogłoby się stać, gdyby na Ziemi zabrakło tlenu?
Czy tlen może być szkodliwy?
Odpowiadając na pytanie, zwróć uwagę na dawkę. Dowiedz się, dlaczego w inkubatorach monitoruje się stężenie tlenu. Czy bary tlenowe są rekomendowane przez lekarzy?
Czy zawartość tlenu zmienia się wraz z wysokością? Powietrze to mieszanina gazów. Wraz z wzrostem wysokości spada jego ciśnienie, a tlen staje się coraz bardziej rozrzedzony.
Przykładowo, na szczycie Mount Everestu ciśnienie spada do 1/3 wartości ciśnienia nad poziomem morza, tak samo (również do 1/3) spada ilość wdychanego przez wspinaczy tlenu.
Miejsce | Wysokość n.p.m. | Ciśnienie na danej wysokości | Dostępność tlenu [%] w porównaniu z poziomem morza |
Poziom morza | 1010 hPa | 100% | |
Warszawa | ok. 120 | 1000 hPa | 99% |
Kasprowy Wierch | 1987 | 810 hPa | 80% |
Baza pod Mount Everestem | 5300 | 540 hPa | 53% |
Mount Everest – szczyt | 8848 | 340 hPa | 33% |

Film dostępny na portalu epodreczniki.pl
Na ekranie Mount Everest z zaznaczoną bazą na wysokości 6000 n.p.m. oraz całkowitą wysokością.
2. Tlen – otrzymywanie
Tlen został odkryty około roku 1774 przez Anglika Josepha Priestleya (czyt. dżozefa pristleja) oraz – niezależnie – także przez Szweda Karla Scheelego (czyt. karla schilego). W wyniku ogrzewania tlenku rtęci(II) wydzielił się gaz, a na ściankach naczynia osadziły się kropelki rtęci. Otrzymanym gazem podtrzymującym palenie był tlen.
W laboratorium tlen otrzymuje się podczas termicznego rozkładu manganianu(VII) potasu, rozkładu wody utlenionej (w obecności katalizatora) lub podczas rozkładu wody pod działaniem prądu elektrycznego (elektrolizy wody). Przemysłowa metoda otrzymywania tlenu polega na destylacji ciekłego powietrza.

Film dostępny na portalu epodreczniki.pl
Film rozpoczyna czarno biały portret Josepha Priestleya. Zmiana ujęcia na czarno biały portret ołówkowy Karla Wilhelma Scheele'a, Zmiana ujęcia na monochromatyczny portret w odcieniach sepii przedstawiający Antoine'a Lavoisiera. Zmiana ujęcia na barwny portret olejny Jędrzeja Śniadeckiego. Zmiana ilustracji na sąsiadujące portrety Zygmunta Wróblewskiego po prawej i Karola Olszewskiego po lewej stronie.
Doświadczenie wymaga zastosowania odzieży ochronnej i okularów.
Czy z manganianu(VII) potasu () można otrzymać tlen? W jaki sposób można go zidentyfikować?
Tlen można otrzymać w wyniku ogrzewania manganianu(VII) potasu (), podobnie jak otrzymuje się go w wyniku termicznego rozkładu tlenku rtęci(II). Powstały gaz należy zidentyfikować za pomocą żarzącego się łuczywka.
statyw,
metalowa łapa,
2 probówki,
korek z rurką odprowadzającą,
krystalizator,
palnik,
manganian(VII) potasu.
Do probówki wsyp kilka kryształków manganianu(VII) potasu. Wylot probówki zamknij korkiem z rurką odprowadzającą.
Drugą probówkę napełnij wodą, jej wylot zatkaj palcem i umieść, odwróconą do góry dnem, w krystalizatorze napełnionym wodą.
Probówkę z kryształkami manganianu(VII) potasu ogrzewaj w płomieniu palnika.
Gdy zacznie wydzielać się gaz, włóż rurkę odprowadzającą do probówki napełnionej wodą.
Po zebraniu gazu do odwróconej probówki zamknij ją korkiem i wyjmij.
RAAnL7Iv5i37x1 
Pod wpływem ogrzewania manganianu(VII) potasu zaczyna się wydzielać gaz, który wypiera wodę z probówki. Zebrany w probówce gaz jest bezbarwny.
Jest to reakcja rozkładu. W wyniku reakcji otrzymano bezbarwny i bezwonny gaz.
Czy drożdże spożywcze umożliwiają rozkład nadtlenku wodoru? W jaki sposób można zidentyfikować gazowy produkt?
Drożdże powodują rozkład roztworu nadtlenku wodoru, umożliwiając identyfikację zebranego tlenu za pomocą żarzącego się łuczywka.
kolba stożkowa,
woda utlenionawoda utleniona ,
drożdże lub ziemniak,
łuczywko,
zapałki.
Do kolby wlej wodę utlenioną, dodaj łyżeczkę suchych drożdży lub pokrojonego w kostkę surowego ziemniaka.
Po chwili do kolby włóż rozżarzone łuczywko.
Obserwuj zachodzące zmiany.
R1HGxjQpXXD7I1 
W wyniku rozkładu wody utlenionej () pod wpływem enzymów zawartych w drożdżach/ziemniaku wydziela się bezbarwny, bezwonny gaz, który można było zidentyfikować za pomocą tlącego się łuczywa.
3. Właściwości i zastosowanie tlenu
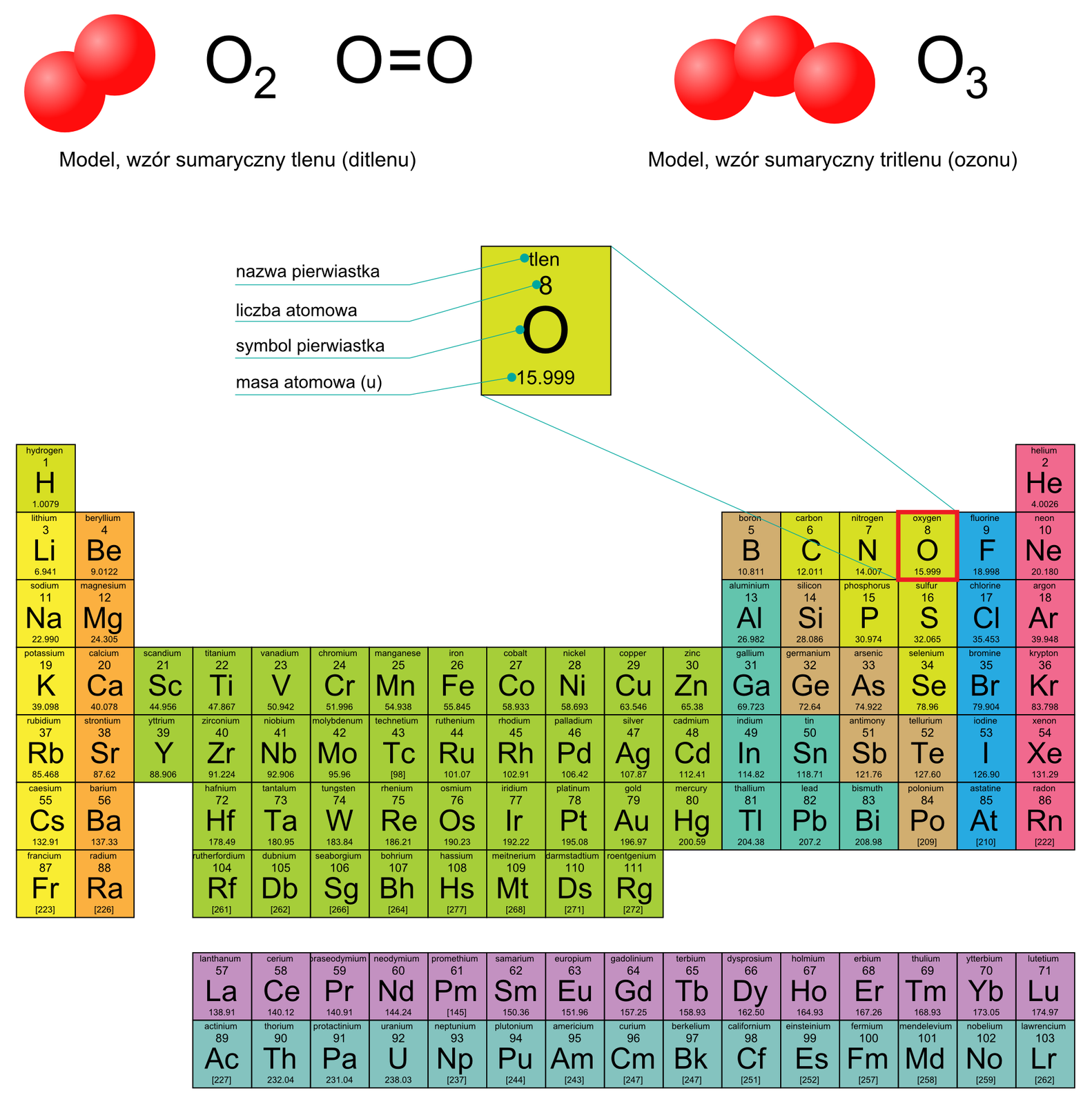
Tlen należy do pierwiastków bardzo rozpowszechnionych w przyrodzie. Jest niemetalem. Należy w 16. grupy i 2. okresu układu okresowego.
W warunkach normalnych (0°C, 1013,25 hPa) tlen jest bezbarwnym i bezwonnym gazem, tworzącym cząsteczki dwuatomowe. W górnych warstwach atmosfery pod wpływem promieniowania ultrafioletowego powstaje ozon, niebieski gaz, którego cząsteczki są zbudowane z trzech atomów tlenu.
Tlen poddany działaniu wysokiemu ciśnienia przechodzi ze stanu gazowego w ciekły.

Tlen znajduje szerokie zastosowanie w medycynie i różnych dziedzinach przemysłu.

4. Spalanie pierwiastków w tlenie
Doświadczenie wymaga zastosowania odzieży ochronnej i okularów.
Czy spalanie pierwiastków w tlenie jest reakcją chemiczną, czy procesem fizycznym?
Spalanie pierwiastków w tlenie jest reakcją chemiczną, ponieważ w jego wyniku powstają nowe substancje.
zebrany w kolbach stożkowych tlen,
łyżki do spalań,
węgiel,
magnez,
siarka.
Spalanie węgla w tlenie
Rozżarzony węgiel drzewny umieszczamy na łyżce do spalań i wprowadzamy do kolby z tlenem.Spalanie magnezu w tlenie
Na łyżkę do spalań nabieramy wiórki magnezowe, zapalamy je w płomieniu palnika i wprowadzamy do kolby z tlenem.Spalanie siarki w tlenie (doświadczenie wykonujemy pod sprawnym wyciągiem)
Na łyżkę do spalań nabieramy niewielką ilość siarki, zapalamy ją w płomieniu palnika, a następnie wprowadzamy do kolby z tlenem.

W kolbie z tlenem, do której wprowadzono węgiel, następuje rozbłysk światła, widać iskry, węgiel spala się gwałtownie.
Magnez spala się w tlenie bardzo jasnym płomieniem. Na łyżce do spalań pozostaje biały proszek.
Siarka pali się niebieskofioletowym płomieniem. Wydziela się gaz o drażniącym zapachu.
Tlen jest pierwiastkiem bardzo aktywnym chemicznie, łączy się z wieloma pierwiastkami. Spalanie to przemiana chemiczna, która zachodzi gwałtownie, z wydzielaniem światła i ciepła. W jej wyniku otrzymujemy nowe substancje (tlenki), które różnią się właściwościami od substancji użytych do reakcji (substratów). Spalanie w czystym tlenie zachodzi szybciej niż w powietrzu.
W trakcie spalaniaspalania pierwiastki (metale i niemetale) łączą się z tlenem. Produktami tej reakcji są tlenkitlenki, czyli związki tlenu z innymi pierwiastkami. Gdy tlen połączy się z:
metalem, np. magnezem, otrzymamy tlenek metalu
tlenek magnezu
niemetalem, np. siarką, powstanie tlenek niemetalu
tlenek siarki(IV)
tlenek węgla(IV)
Proces łączenia się pierwiastków z tlenem jest podstawową metodą otrzymywania tlenków. Przykładem takiej reakcji jest np. rdzewienie, polegające na łączeniu się żelaza z tlenem.
Tworzenie nazw tlenków
Tlen w związkach chemicznych jest zawsze dwuwartościowy. Inne pierwiastki mogą mieć różne wartościowości i tworzyć jeden lub więcej tlenków (litowce, berylowce, fluor mają tylko jedną wartościowość).
W nazwie tlenków po słowie „tlenek” należy podać nazwę pierwiastka łączącego się z tlenem. Jeżeli dany pierwiastek tworzy więcej niż jeden tlenek, wówczas trzeba wskazać także wartościowość, którą zapisujemy cyfrą rzymską umieszczoną w nawiasie.
Symbol pierwiastka | Wartościowość | Wzór sumaryczny | Nazwa tlenku |
II | tlenek magnezu | ||
II, IV, VI | tlenek siarki(IV) | ||
II, IV, VI | tlenek siarki(VI) | ||
II, IV | tlenek węgla(II) | ||
II, IV | tlenek węgla(IV) |

Film dostępny na portalu epodreczniki.pl
Tlenek siarki. Wartościowość siarki w związkach chemicznych: II, IV, VI.
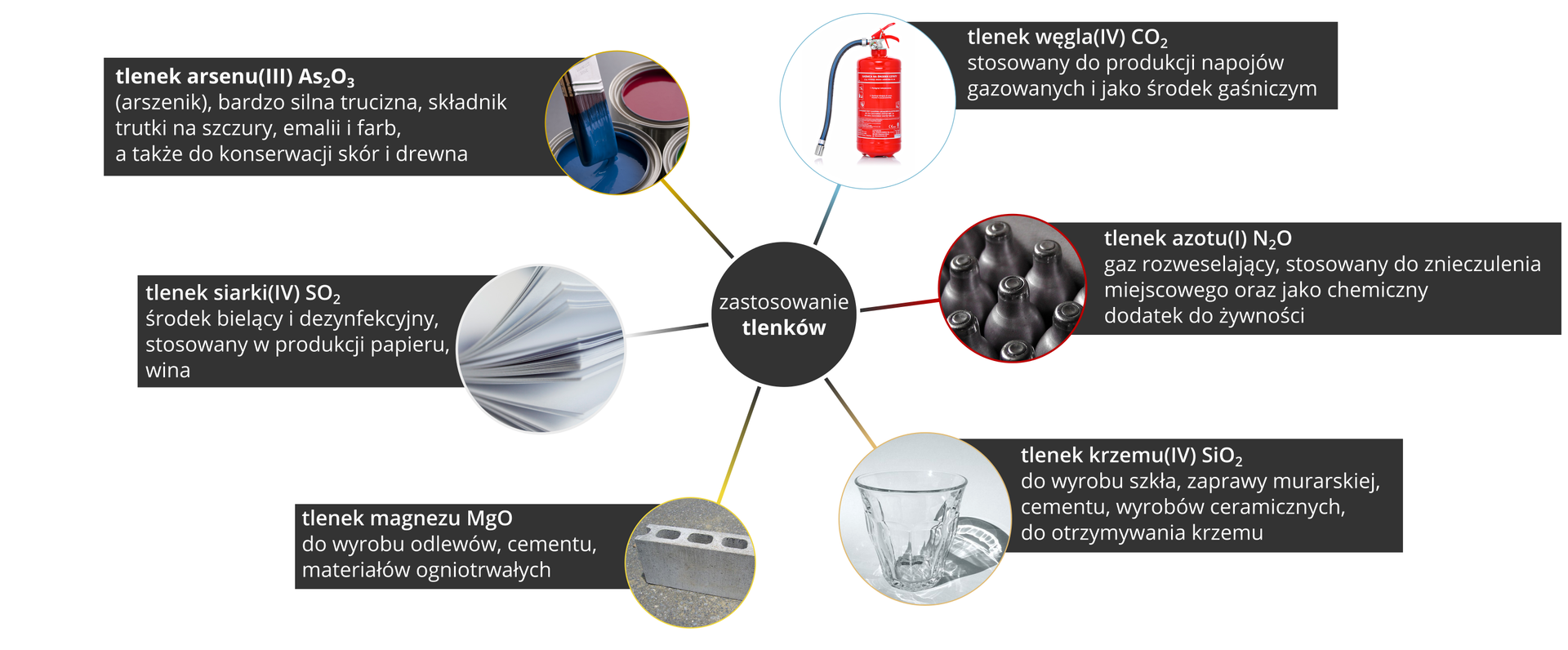
5. Tlenki – zastosowanie
Tlenki metali i niemetali mają szerokie zastosowanie. Niektóre tlenki występują w przyrodzie. Należą do nich:
tlenki metali: żelaza, glinu;
tlenki niemetali: wodoru (woda), krzemu (główny składnik piasku), węgla, azotu.
Tlenek żelaza(III) występuje w postaci minerału – hematytu. Ze względu na swoją czerwoną barwę może być składnikiem pigmentu do produkcji farb i lakierów.
Tlenek glinu występuje w postaci minerału – korundu. Kamienie szlachetne znajdują zastosowanie w jubilerstwie, zaś tlenek glinu ze względu na dużą twardość jest używany do polerowania oraz jako materiał ścierny.
Tlenek wapnia jest stosowany do produkcji cementu i zapraw murarskich (wapno palone) i w laboratoriach do osuszania cieczy i gazów. Znalazł również zastosowanie w produkcji nawozów sztucznych.

Podsumowanie
Tlen jest gazem bezbarwnym, bezwonnym, słabo rozpuszczalnym w wodzie, bardzo aktywnym chemicznie.
Tlenki to związki chemiczne metali i niemetali z tlenem.
Podstawową metodą otrzymywania tlenków jest reakcja łączenia się pierwiastków z tlenem.
Tlenki znalazły szerokie zastosowanie w życiu codziennym.
Przedstaw w postaci tabeli właściwości fizyczne i chemiczne tlenu oraz azotu.
Zaprojektuj plakat przedstawiający zestaw do zbierania tlenu. Wyjaśnij, jakie właściwości powodują, że zbieramy go do probówki lub zlewki napełnionej wodą.
Dowiedz się więcej
International Historic Chemical Landmarks Joseph Priestley ‒ oxygen
Słowniczek
związek tlenu z innym pierwiastkiem chemicznym, np.: , , , ,
reakcja z tlenem, której towarzyszy wydzielanie ciepła i światła
3‑procentowy roztwór nadtlenku wodoru ; stosowana do odkażania ran
Zadania
Połącz w pary wzory tlenków z wartościowościami pierwiastków chemicznych, które wchodzą w ich skład.
<span aria-label="P indeks dolny, 4, O indeks dolny, 10" role="math"><math><mrow><msub><mtext>P</mtext><mtext>4</mtext></msub><msub><mtext>O</mtext><mtext>10</mtext></msub></mrow></math></span>, <span aria-label="CrO indeks dolny, 3" role="math"><math><mrow><msub><mtext>CrO</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="NO indeks dolny, 2" role="math"><math><mrow><msub><mtext>NO</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="Fe indeks dolny, 2, O indeks dolny, 3" role="math"><math><mrow><msub><mtext>Fe</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="K indeks dolny, 2, O" role="math"><math><mrow><msub><mtext>K</mtext><mtext>2</mtext></msub><mtext>O</mtext></mrow></math></span>, <span aria-label="Cl indeks dolny, 2, O indeks dolny, 7" role="math"><math><mrow><msub><mtext>Cl</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>7</mtext></msub></mrow></math></span>
| IV | |
| VII | |
| III | |
| VI | |
| I | |
| V |
Zaprojektuj zestaw do otrzymywania tlenu z manganianu(VII) potasu.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DkOzJ7E5P
Zadaniem uczniów było podanie przykładu zastosowania tlenu. Która z osób popełniła błąd?
- Lena – Tlen jest stosowany do miejscowego znieczulania oraz w komorach kriogenicznych (leczenie zimnem).
- Igor – Tlen jest stosowany w palnikach do spawania i cięcia metali.
- Maciej – Tlen o odpowiednim stężeniu jest podawany wcześniakom w inkubatorach.
- Marta – Tlen zmieszany np. z azotem jest stosowany w butlach dla nurków, alpinistów, kosmonautów.
Oceń, czy podane informacje na temat tlenu są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| W temperaturze pokojowej jest niebieską cieczą. | □ | □ |
| W warunkach normalnych jest gazem bezbarwnym, bezwonnym, tworzącym dwuatomowe cząsteczki. | □ | □ |
| Gaz ten podtrzymuje spalanie. | □ | □ |
Ustal, którego pierwiastka – siarki czy magnezu – dotyczą podane informacje.
| niemetal tworzący kryształy o żółtej barwie | □ | □ |
| metal o barwie srebrzystobiałej | □ | □ |
| spala się w tlenie białym, oślepiającym płomieniem | □ | □ |
| w tlenie spala się niebieskofioletowym płomieniem | □ | □ |
| na łyżce do spalań powstaje substancja stała o białej barwie | □ | □ |
| produktem spalania jest gaz o drażniącym zapachu | □ | □ |
Przedstaw za pomocą modeli przebieg reakcji spalania magnezu.




