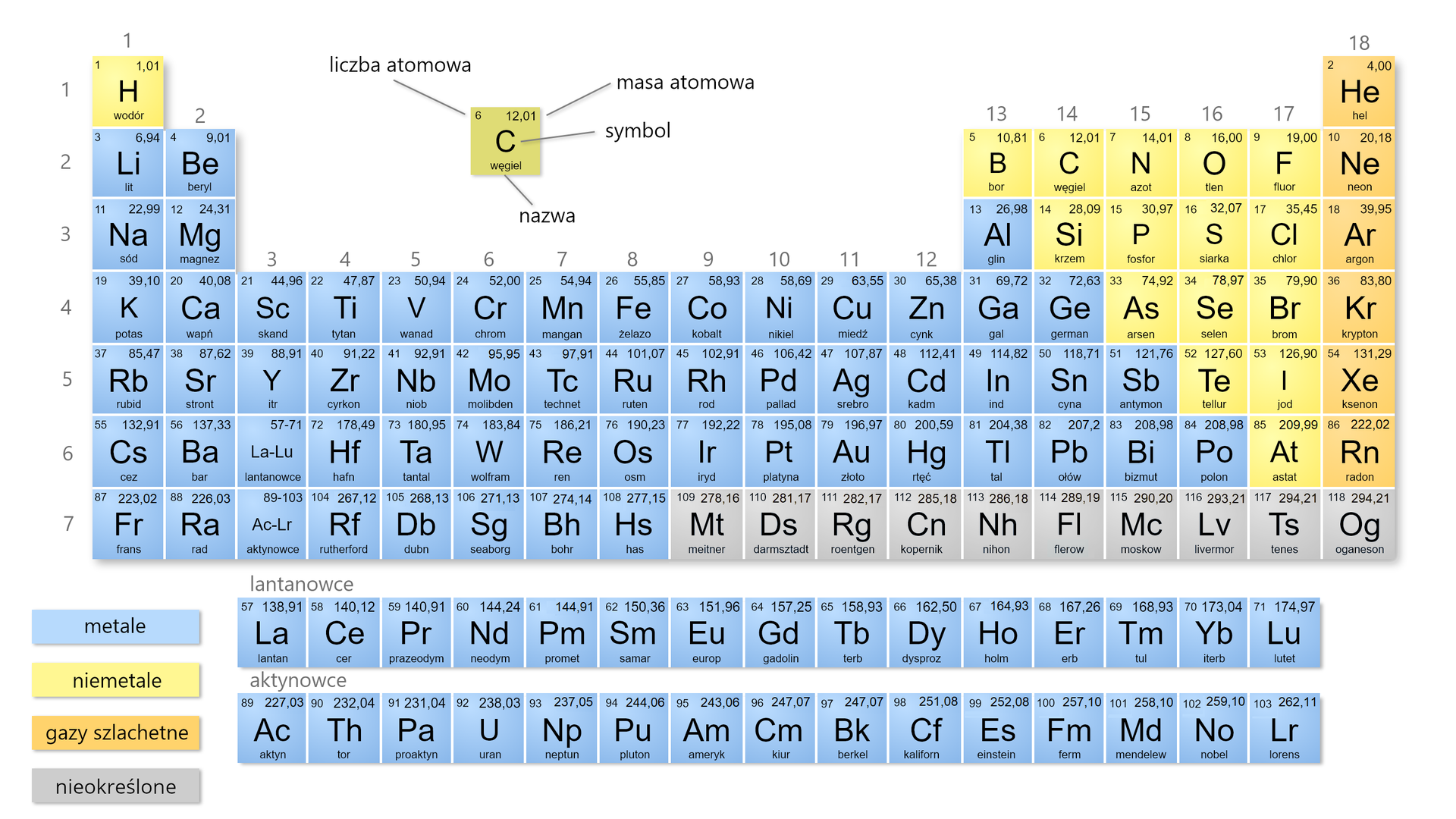
Układ okresowy pierwiastków
Ze wszystkich sposobów prezentacji pierwiastków chemicznych, tylko jeden zyskał ogromną popularność i jest stosowany w tej samej formie na całym świecie. Mowa tu o formie tabeli, w której zostały uporządkowane pierwiastki wg ściśle określonych kryteriów. Fenomen tego układu polega na tym, że nawet jeśli nie znamy pierwiastka, ale wiemy, w którym miejscu w tej tabeli się znajduje, jesteśmy w stanie wiele powiedzieć na temat jego właściwości.
budowę materii i co jest jej podstawowym składnikiem;
definicję liczby atomowej i masy atomowej;
budowę atomu;
symbole i nazwy pierwiastków chemicznych;
podział pierwiastków chemicznych.
interpretować prawo okresowości;
opisywać budowę układu okresowego (wskazywać grupy i okresy);
określać położenie pierwiastka w układzie okresowym;
wskazywać metale i niemetale w układzie okresowym;
odczytywać z układu okresowego podstawowe informacje o pierwiastku (liczbę atomową, masę atomową, rodzaj pierwiastka).
1. Jak klasyfikowano pierwiastki chemiczne?
XIX w. to czas, kiedy uczeni znali już kilkadziesiąt pierwiastków chemicznych. Były one już przez nich wówczas zbadane i opisane. Ówcześni naukowcy zauważyli, że wśród pierwiastków są takie, które wykazują podobne właściwości. Poszukiwali więc klucza, wg którego mogliby je uporządkować i sklasyfikować. Zauważyli, że jeśli ułoży się je w szeregu, zgodnie ze wzrastającą masą atomową, to na początku co ósmy, a potem co osiemnasty pierwiastek wykazuje podobne cechy. To spostrzeżenie pozwoliło jednemu z uczonych sformułować ogólne prawo, które nazwano prawem okresowości (na cześć twórcy Dymitra MendelejewaDymitra Mendelejewa – prawem okresowości Mendelejewa).
W poniższej animacji ukazano w skrócie, jak wyglądały pierwsze próby uporządkowania pierwiastków chemicznych, znanych już w XIX w.

Film dostępny pod adresem /preview/resource/R1B3I5Z3PqHLe
W filmie opisano historię systematyki pierwiastków. Przedstawiono chemików, którzy zajmowali się systematyzacją pierwiastków, byli to: Johann Wolfgang Döbereiner, John Alexander Reina Newlands, Dymitr Mendelejew oraz Julius Lothar Meyer.
Obecny wygląd układu okresowego różni się od tego, który zaproponował Mendelejew. Na podstawie odkrycia i analizy budowy jądra atomowego oraz badań nad widmami rentgenowskimi, emitowanymi przez znane pierwiastki chemiczne, stwierdzono, że lepszym kryterium, wg którego należy uporządkować pierwiastki chemiczne, jest liczba protonów w jądrze atomowym (liczba atomowaliczba atomowa). Dlatego też współcześnie funkcjonuje inna niż za czasów Mendelejewa treść prawa okresowościprawa okresowości.
Prawo okresowości – właściwości pierwiastków chemicznych, uszeregowane wg rosnącej liczby atomowej (Z), powtarzają się okresowo.
W poniższej animacji ukazano odzwierciedlenie prawa okresowości w długościach promieni atomowych wybranych pierwiastków chemicznych.

Film dostępny pod adresem /preview/resource/RhEEBAxv1lU3U
Na filmie ukazano pierwiastki uporządkowane według wzrastającej masy atomowej. Na wykresie przedstawiono zależność pomiędzy długością promieni atomowych a masą atomową pierwiastków.
2. Jak zbudowany jest współczesny układ okresowy pierwiastków?
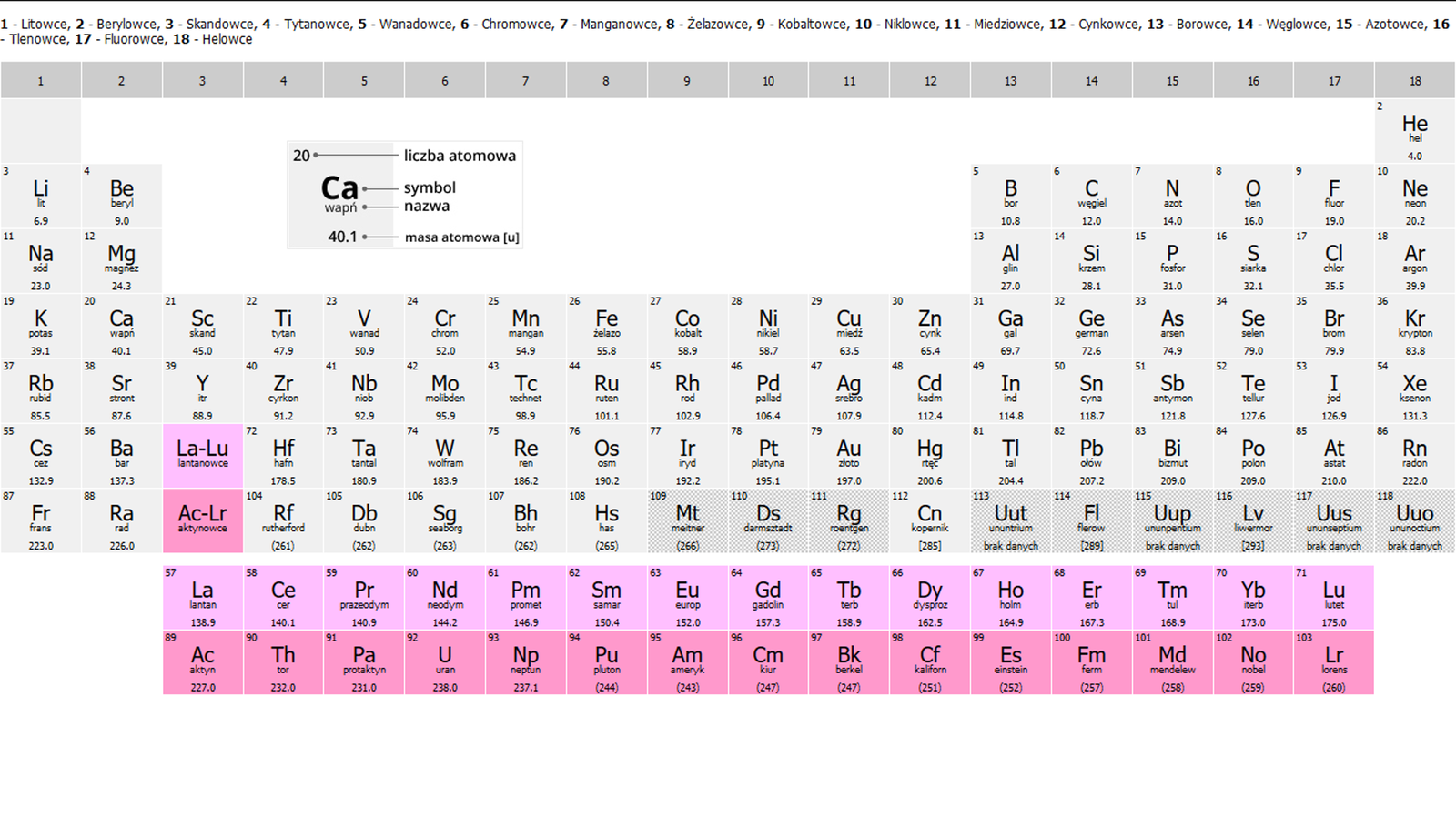
Układ okresowy pierwiastkówUkład okresowy pierwiastków to zestawienie w tabeli wszystkich pierwiastków chemicznych, uporządkowanych na podstawie rosnącej liczby atomowej. Pierwiastki są pogrupowane wg cyklicznie powtarzających się podobieństw ich właściwości. Kolumny określa się mianem grup, a wiersze – mianem okresów. Grupy i okresy są ponumerowane.
Przeanalizuj budowę zamieszczonego poniżej układu okresowego.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DYjZOiKZ3
Zastanów się i odpowiedz na pytanie, jakie dwa parametry należy podać, aby określić położenie pierwiastka chemicznego w układzie okresowym.
Na podstawie znajomości numeru grupy i okresu, możemy w prosty sposób zlokalizować dany pierwiastek w układzie okresowym.
Podaj nazwę oraz symbol pierwiastka chemicznego, który znajduje się w 17. grupie i w 5. okresie układu okresowego.
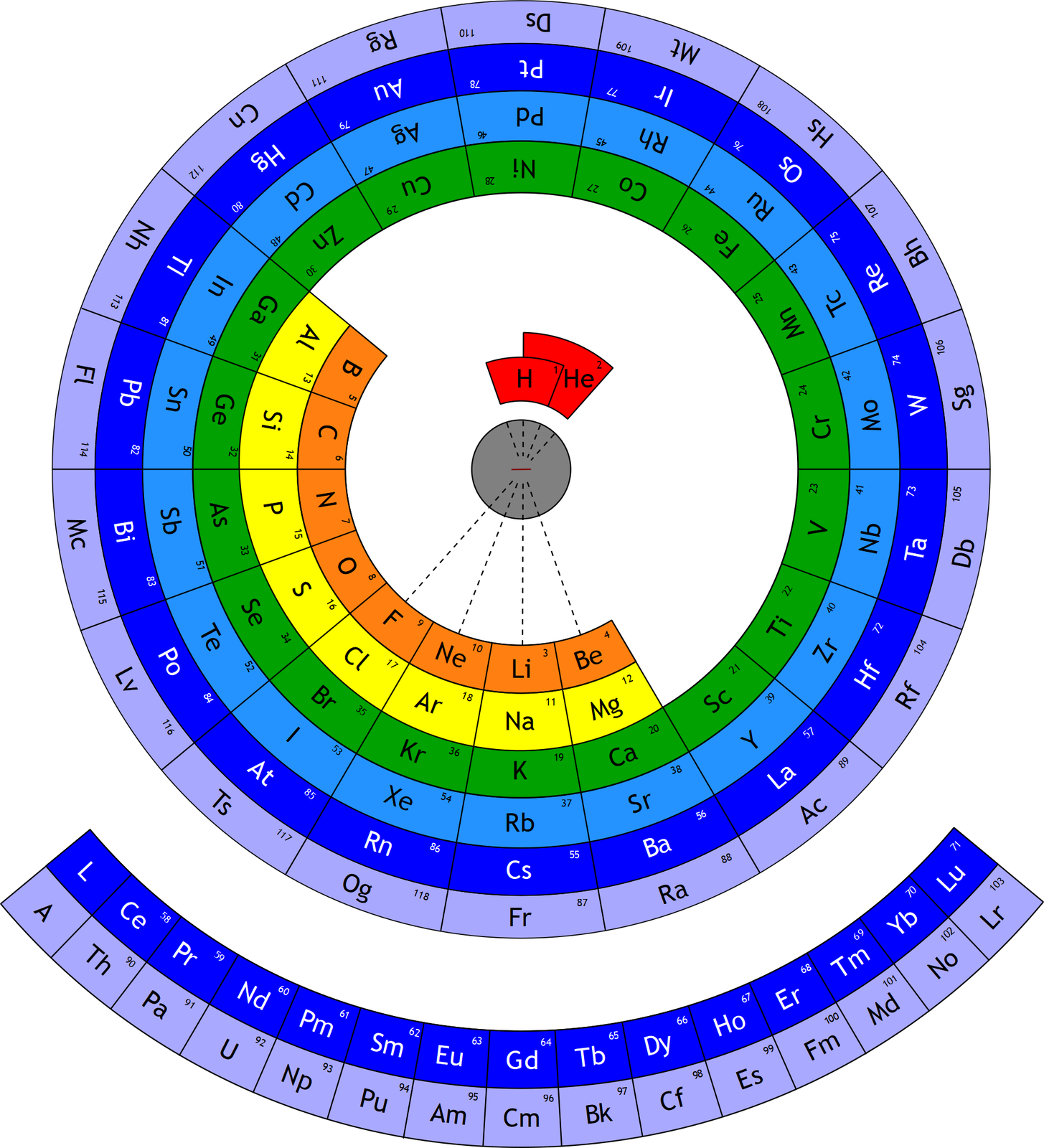
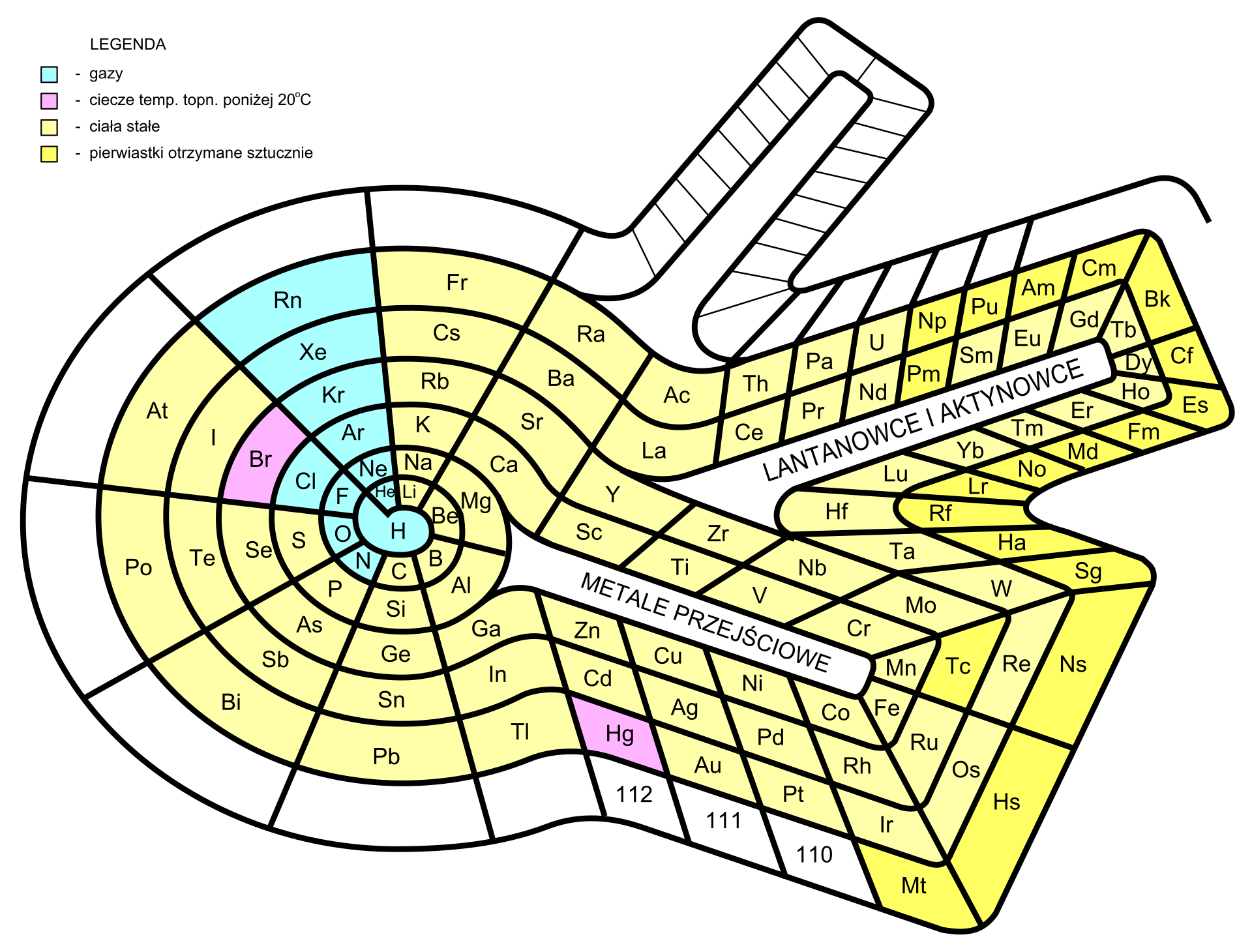
Jaką formę może przyjąć układ okresowy?
Niektórzy uczeni opracowywali układy okresowe o różnych kształtach. Jednak sposób prezentowania pierwiastków w formie tabeli jest najpowszechniej stosowany. Został zaakceptowany przez Międzynarodową Unię Chemii Czystej i Stosowanej – The International Union of Pure and Applied Chemistry, skrót IUPACIUPAC (czyt. internaszional junion of piur end eplajd kemistry), organizację zajmującą się głównie ujednolicaniem symboliki, nazewnictwa i wzorów, stosowanych przez chemików na całym świecie.

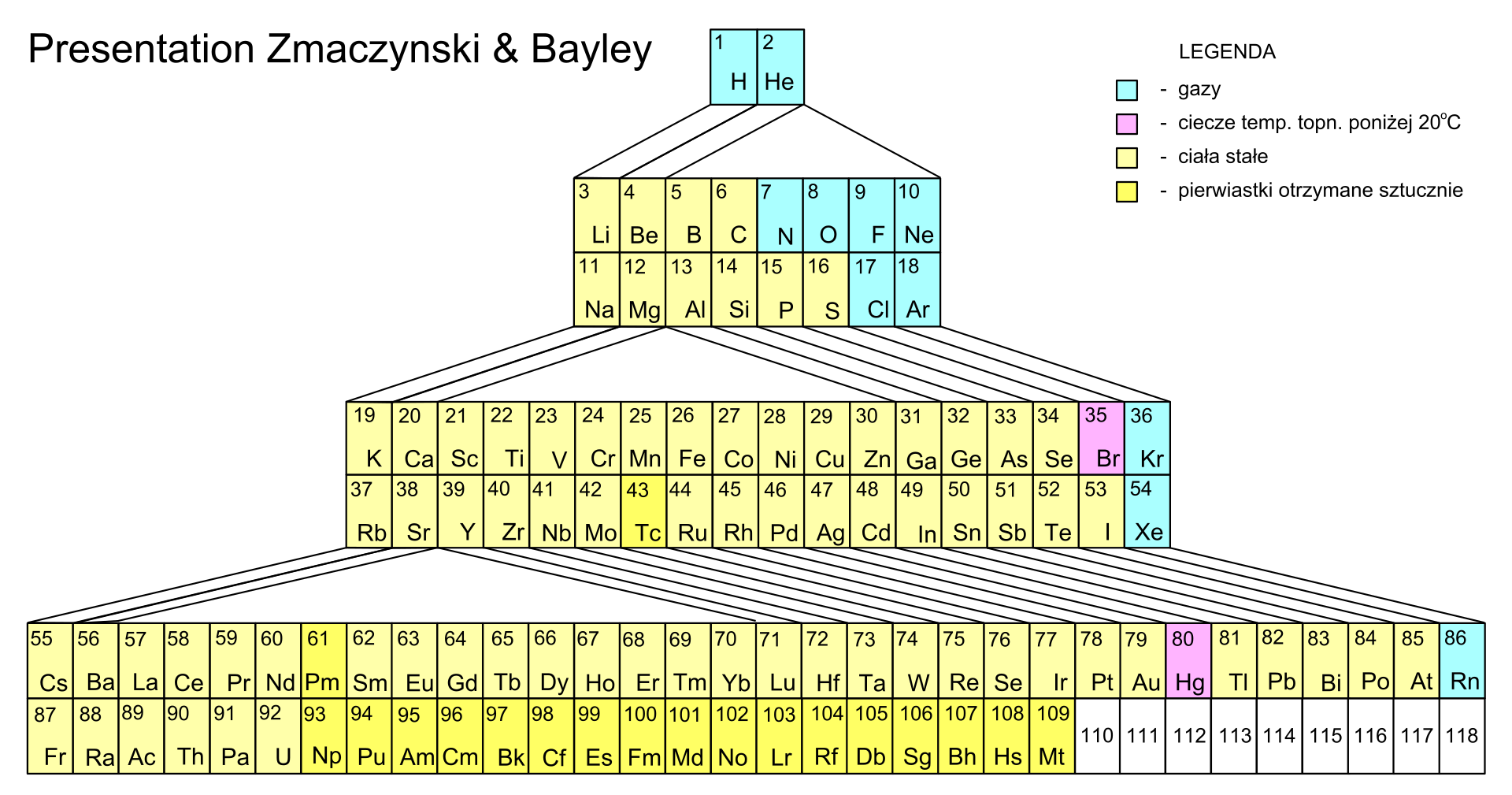
Najprostsza wersja układu okresowego zawiera symbole pierwiastków chemicznych, ich liczby atomowe (porządkowe) oraz numery grup i okresów. Istnieją jednak i takie wersje układów okresowych, które prezentują inne dodatkowe dane (np. nazwy pierwiastków i ich właściwości, budowę ich atomów, ich wielkość itp.). W niektórych układach okresowych stosuje się również kolory, np. do wskazania, które z pierwiastków chemicznych należą do metali, a które do niemetali, czy też do oznaczenia stanu skupienia poszczególnych pierwiastków chemicznych. Niezależnie od tego, ile informacji o pierwiastkach zawierają układy okresowe, zawsze kolejność pierwiastków, liczba grup oraz rodzaj pierwiastków w grupie i okresie w każdym układzie okresowym są identyczne.
Przez wiele lat różni uczeni wychodzili z różnymi propozycjami porządkowania znanych im pierwiastków chemicznych, tworząc niejednokrotnie układy okresowe o przeróżnych kształtach. W poniższej galerii znajduje się kilka z nich.
Najmniejszy układ okresowy świata – wyczyn wpisany do Księgi rekordów Guinnessa (czyt. ginesa).
Naukowcy w Wielkiej Brytanii zapisali na ludzkim włosie cały układ okresowy pierwiastków. Użyli do tego bardzo precyzyjnych narzędzi (m.in. specjalnego rodzaju mikroskopu) i otrzymali układ o wymiarach 89,67 na 46,39 mikrometrów. Jak wiemy, 1 mikrometr odpowiada jednej tysięcznej milimetra. Tego układu okresowego nie bylibyśmy w stanie zobaczyć nieuzbrojonym w odpowiedni sprzęt okiem.

3. Co łączy pierwiastki chemiczne należące do jednej grupy?
Czy grupy mają swoje nazwy?
Wszystkim grupom w układzie okresowym nadano nazwy, które pochodzą od nazw pierwiastków, znajdujących się na początku grupy. Pierwiastki z tej samej grupy mają podobne właściwości. Mogą one chociażby tworzyć podobne typy związków chemicznych z innymi pierwiastkami czy też wykazują podobne zachowanie wobec tych samych substancji chemicznych (np. wobec wody). Wyjątkiem jest wodór. Chociaż jest położony w grupie metali, to w rzeczywistości jest niemetalem i wykazuje odmienne właściwości od pozostałych pierwiastków chemicznych, które należą do pierwszej grupy układu okresowego. Stąd też nazwa wspomnianej grupy nie wywodzi się od wodoru, ale od znajdującego się tuż pod nim litu.
Nazwy poszczególnych grup układu okresowego przedstawiono na poniższym układzie okresowym.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DYjZOiKZ3
Pierwiastki chemiczne, należące do 17. grupy układu okresowego, nazywane są fluorowcami, ale często również halogenami, a pierwiastki chemiczne należące do 18. grupy układu okresowego określa się mianem helowców, a także gazami szlachetnymi.
4. Jak układ okresowy odzwierciedla podział pierwiastków na metale i niemetale?
Układ okresowy można umownie podzielić na dwie części, tak jak to przedstawiono na poniższej grafice. Pierwiastki chemiczne, zaznaczone na prezentowanym układzie okresowym na niebiesko, są metalami, a te, które zaznaczono na żółto, to niemetale.
Układ okresowy, nawet wtedy, gdy jest przedstawiony w najprostszej formie, może dostarczyć nam cennych informacji na temat poszczególnych pierwiastków chemicznych. Zapoznaj się z poniższą animacją, a dowiesz się, jakie wiadomości o tlenie można uzyskać z układu okresowego. Następnie wykonaj polecenie nr 5.

Film dostępny pod adresem /preview/resource/R1M8hxcFQxxLT
Film pokazujący, jakie informacje o tlenie można uzyskać z układu okresowego.
W załączonym układzie okresowym odszukaj pierwiastki chemiczne o nazwach: fosfor, potas, glin oraz brom, a potem uzupełnij poniższą tabelę. Masę atomową wskazanych pierwiastków chemicznych zaokrąglij do jedności.
Podsumowanie
Układ okresowy pierwiastków chemicznych jest uniwersalnym sposobem prezentacji pierwiastków chemicznych i różnorodnych danych na ich temat.
W układzie okresowym pierwiastki chemiczne (ich symbole i/lub nazwy) są umieszczone kolejno w tabeli, zgodnie z rosnącą liczbą atomową.
Pionowe kolumny tabeli nazywa się grupami, zaś poziome rzędy okresami. Wszystkie grupy i okresy są ponumerowane.
Każda z grup układu okresowego ma swoją nazwę, która pochodzi od nazwy rozpoczynającego ją pierwiastka chemicznego (z wyjątkiem grupy pierwszej, której nazwa pochodzi od drugiego z kolei pierwiastka).
Pierwiastki chemiczne należące do jednej grupy układu okresowego mają zbliżone właściwości (wyjątkiem jest wodór).
Praca domowa
Wyszukaj w układzie okresowym następujące pierwiastki:
A. pierwiastek chemiczny z grupy helowców, używany do napełniania balonów; dostarczony do płuc, powoduje zmianę wysokości głosu;
B. pierwiastek chemiczny z grupy borowców, stosowany do wyrobu puszek do napojów oraz folii do pakowania żywności;
C. pierwiastek chemiczny z drugiej grupy układu okresowego, główny składnik kości;
D. pierwiastek chemiczny z czwartego okresu, będący głównym składnikiem stali;
E. pierwiastek chemiczny z piątego okresu, będący surowcem do tworzenia biżuterii.
Słownik

Dymitr Mendelejew
Rosyjski chemik. Sformułował pierwotne prawo okresowości pierwiastków, nazywane także na jego cześć prawem okresowości pierwiastków Mendelejewa. Korzystając z tego prawa, sklasyfikował ówcześnie znane pierwiastki chemiczne i stworzył tablicę zwaną układem okresowym pierwiastków. Podczas prac nad systematyką pierwiastków, przewidział istnienie i trafnie określił właściwości nieznanych jeszcze wtedy pierwiastków.
tablica przedstawiająca wszystkie pierwiastki chemiczne, uporządkowane kolejno wg rosnącej liczby atomowej, w grupach (obejmujących pierwiastki o podobnych właściwościach) i okresach (w których właściwości pierwiastków zmieniają się stopniowo); grupy w układzie okresowym to pionowe kolumny, a okresy – poziome rzędy
liczba ładunków dodatnich (protonów) w jądrze atomowym; oznaczana symbolem Z
prawo głoszące, że właściwości pierwiastków chemicznych, uszeregowane wg rosnącej liczby atomowej, powtarzają się okresowo; współczesne prawo okresowości różni się od sformułowanego przez Mendelejewa
(czyt. internaszynal junion of piur end aplajd kemistry) Międzynarodowa Unia Chemii Czystej i Stosowanej – międzynarodowa organizacja, która zajmuje się głównie standaryzacją symboliki, nazewnictwa i wzorców wielkości fizycznych stosowanych przez chemików na całym świecie
Ćwiczenia
Uzupełnij puste miejsca w zdaniach, wybierając brakujące elementy z listy.
zespoły, zbiory, tego samego okresu, wykresu, grupy, okresy, tabeli, tej samej grupy, zespoły, listy pierwiastków, wielkość drobin pierwiastka, alfabet, liczba atomowa pierwiastka, grupy, zbiory, okresy
Układ okresowy pierwiastków przedstawiany jest w formie ........................................................... Kryterium uporządkowania pierwiastków w układzie okresowym jest ........................................................... Pionowe kolumny w układzie okresowym to ........................................................... Poziome rzędy w układzie okresowym to ........................................................... Pierwiastki należące do .......................................................... wykazują podobne właściwości.
Połącz pierwiastki (ich nazwy) z odpowiednim opisem położenia w układzie okresowym.
numer grupy: 2, numer okresu: 3, numer grupy: 14, numer okresu: 2, numer grupy: 17, numer okresu: 3, numer grupy: 11, numer okresu: 4
| magnez | |
| miedź | |
| chlor | |
| węgiel |
Określ liczby atomowe pierwiastków na podstawie informacji o ich położeniu w układzie okresowym. Połącz liczby atomowe z odpowiednim opisem położenia.
numer grupy: 11, numer okresu: 5, numer grupy: 16, numer okresu: 3, numer grupy: 15, numer okresu: 2, numer grupy: 2, numer okresu: 4
| 7 | |
| 16 | |
| 20 | |
| 47 |
Podziel podane pierwiastki na metale i niemetale. Przyporządkuj pierwiastki do odpowiednich kategorii.
hel, neon, węgiel, chlor, miedź, ołów, srebro, azot, cyna, krzem, wodór, tlen, jod, sód, potas, złoto
| metale | |
|---|---|
| niemetale |
Zaznacz, które zdania są prawdziwe, a które – fałszywe.
| Prawda | Fałsz | |
| Wszystkie pierwiastki w danym okresie mają podobne właściwości. | □ | □ |
| Większość metali znajduje się w lewej części układu okresowego. | □ | □ |
| Pierwiastki należące do tej samej grupy układu okresowego mają jednakową liczbę atomową. | □ | □ |
| W układzie okresowym jest więcej metali niż niemetali. | □ | □ |
| W układzie okresowym są grupy, które zawierają zarówno metale, jak i niemetale. | □ | □ |
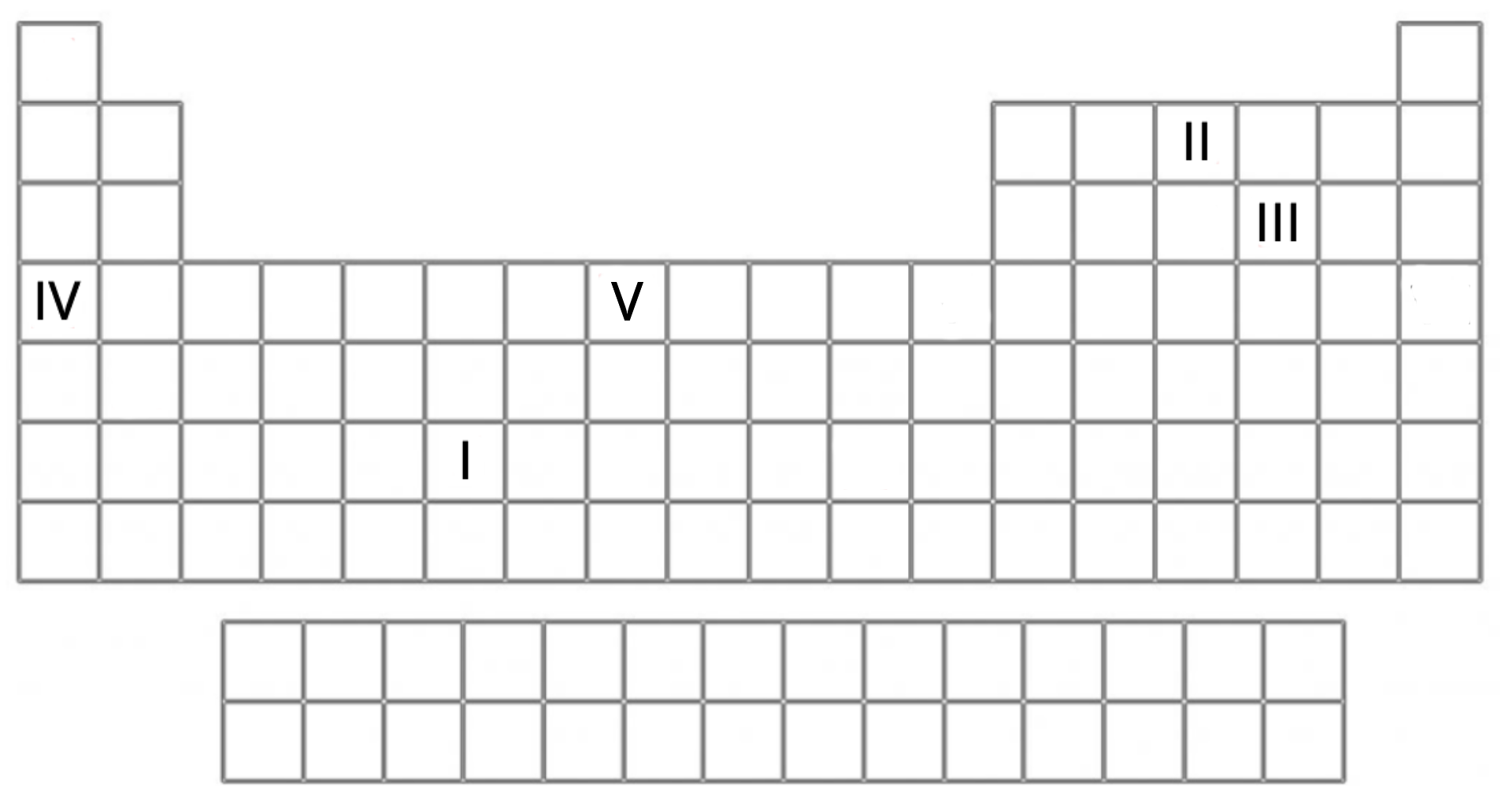
Na poniższym schemacie cyframi rzymskimi oznaczono wybrane pierwiastki chemiczne.
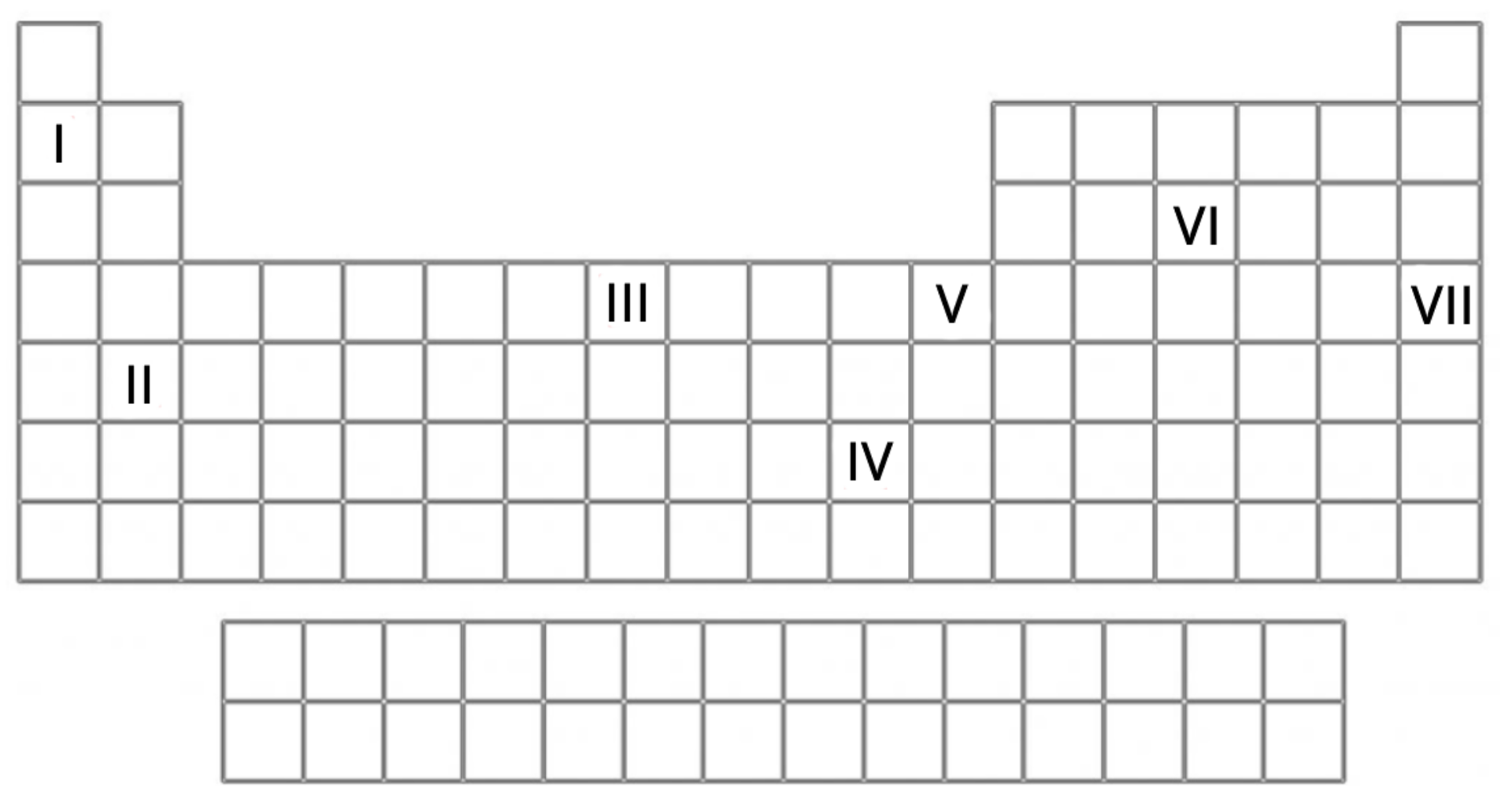
Na poniższym schemacie układu okresowego zaznaczono cyframi położenia siedmiu różnych pierwiastków chemicznych (1‑7). Odszukaj te pierwiastki w układzie okresowym, a następnie uzupełnij tabelę.
W pewnym laboratorium chemicznym badano właściwości trzech pierwiastków chemicznych, oznaczonych umownie symbolami A, B oraz C. Stwierdzono, że pierwiastki A i C to srebrzystoszare ciała stałe o metalicznym połysku, a pierwiastek B to żółte, matowe ciało stało. Po spaleniu próbek pierwiastków A i C w tlenie, na łyżce do spalań pozostał w obydwu przypadkach biały proszek, a podczas spalania pierwiastka B zaobserwowano wydzielanie się gazu o duszącym, nieprzyjemnym zapachu.
Poniżej podano informacje o budowie atomów trzech różnych pierwiastków chemicznych. Rozszyfruj, jakiego pierwiastka chemicznego dotyczy każda z tych informacji, i podaj jego lokalizację w układzie okresowym (nr grupy oraz nr okresu, do których pierwiastek ten należy).
Bibliografia
Encyklopedia PWN
Gulińska H., Smolińska J., Ciekawa chemia, cz. 1, Warszawa 2009.
Kaznowski K., Pazdro K. M., Chemia. Podręcznik do liceów i techników, cz. 1, Warszawa 2019.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1. Chemia ogólna i nieorganiczna. Zakres rozszerzony, Warszawa 2012.