Właściwości substancji
Zimą do spryskiwaczy i chłodnic samochodowych wlewa się specjalne płyny, które zamarzają w temperaturze poniżej –20 °C, a nawet –37 °C. Do szlifowania i polerowania kamieni szlachetnych, a także do cięcia szkła używa się diamentu, który jest najtwardszym z materiałów. Zastosowania substancji są związane z ich cechami charakterystycznymi, takimi jak np. temperatura krzepnięcia lub twardość. Zastanów się, jakie inne właściwości mają substancje nas otaczające i w jaki sposób można je wykorzystywać.
definicję chemii i czym się ona zajmuje;
zasady bezpieczeństwa obowiązujące w szkolnej pracowni chemicznej;
przykłady naczyń i sprzętu laboratoryjnego potrzebnych do wykonania określonej czynności laboratoryjnej;
zasady postępowania z substancjami i preparatami oznaczonymi piktogramami ostrzegawczymi.
definiować pojęcie: substancja;
określać, które cechy substancji są zaliczane do właściwości fizycznych, a które – do właściwości chemicznych;
planować metody badania właściwości fizycznych i chemicznych substancji;
badać i opisywać właściwości wybranych substancji.
1. Czy słowo „substancja” ma zawsze takie samo znaczenie?
W języku potocznym substancjami nazywamy otaczające nas elementy przyrody – wodę, powietrze, drewno do palenia w kominku, a także używane w kuchni przyprawy. Jednak nie jest to określenie poprawne pod względem chemicznym.
SubstancjaSubstancja to rodzaj materii o stałym składzie chemicznym, wykazującej zespół określonych właściwości, dzięki którym możemy ją rozpoznać.
Substancjami są np.: cukier, sól kamienna, żelazo, tlen, czysta woda, czyli tzw. woda dejonizowana (w przeciwieństwie do wody morskiej czy tej z kranu, które zawierają inne związki chemiczne).
Sprawdź, czy materiał, z którego wykonany jest dany przedmiot, ma wpływ na jego zastosowanie. W tym celu wykonaj doświadczenie. Wybierz hipotezę, napisz obserwacje oraz sformułuj odpowiedni wniosek.
Sprawdzono, czy materiał, z którego wykonany jest dany przedmiot, ma wpływ na jego zastosowanie. W tym celu wykonano doświadczenie. Wybierz hipotezę, zapoznaj się z obserwacjami oraz wnioskami.
Problem badawczy:
Czy zastosowanie różnych przedmiotów związane jest z właściwościami materiałów, z których są wykonane?
Hipoteza:
Zastosowanie przedmiotów jest związane z właściwościami materiałów, z których są wykonane.
Co będzie potrzebne:
nóż drewniany (do smarowania);
nóż plastikowy;
metalowy nóż kuchenny;
deska do krojenia;
jabłko.
Instrukcja:
Położono jabłko na desce. Spróbowano przekroić je kolejno nożami wykonanymi z różnych materiałów (drewna, plastiku i metalu).
Obserwacje:
Jabłko najłatwiej kroi się nożem metalowym, a najtrudniej – drewnianym.
Wnioski:
Do przekrojenia jabłka najlepiej użyć noża metalowego, a nie plastikowego czy drewnianego. Ostre noże produkuje się m.in. z dobrej jakości twardego metalu lub jego stopu. Sztućce jednorazowego użytku wytwarza się z plastiku, zaś noże, które świetnie nadają się do smarowania pieczywa, wykonuje się z drewna.
Zapisz hipotezę, obserwacje oraz wnioski.
Zastanów się i napisz, jaka jest różnica pomiędzy zastosowanymi nożami?
Użyteczność przedmiotów jest związana z właściwościami materiałów, z których są wykonane. Elementy konstrukcyjne wytwarza się z materiałów o dużej wytrzymałości. Garnki wykonuje się z tworzyw, które dobrze przewodzą ciepło, z kolei rączki – z izolatorów chroniących przed oparzeniem. Dobre i złe przewodnictwo ciepła to właściwości materii, które wpływają na jej zastosowanie. Niektóre cechy można zmierzyć, a inne tylko opisać. Pomiarów dokonuje się w tych samych warunkach (np. w temperaturze pokojowej (25 °C) i pod ciśnieniem normalnym (1013 hPa)), co umożliwia porównanie wyników.
Przypomnij sobie z lekcji przyrody, z czego zbudowany jest otaczający nas świat.
Spójrz na ilustracje przykładowych wyrobów (waty cukrowej, szpilki krawieckiej, solnego żyrandola, srebrnej monety, miedzianej rynny) i określ, z jakich substancji zostały wytworzone.
Przypomnij sobie z lekcji przyrody, z czego zbudowany jest otaczający nas świat.
Z jakich substancji zostały wykonane przykładowe wyroby:
wata cukrowa,
szpilki krawieckie,
solny żyrandol w Wieliczce,
srebrna moneta,
miedziana rynna.
2. Jakie właściwości nazywamy fizycznymi?
Wszystkie substancje mają określone właściwości. Możemy je badać zmysłami (np. zobaczyć, usłyszeć, powąchać) lub za pomocą specjalnych przyrządów, co pozwala odróżnić daną substancję od innej.
Właściwości substancji możemy podzielić na:
jakościowe – te, których nie można wyrazić w liczbach (np. smak, zapach);
ilościowe – te, które można mierzyć i opisać za pomocą liczb (np. gęstość, temperatura wrzenia, temperatura topnienia).
Jakie znasz stany skupienia?
Przypomnij sobie z lekcji przyrody wiadomości o stanach skupienia wody.
Rozejrzyj się wokół siebie i dokonaj podziału przedmiotów, biorąc pod uwagę ich stan skupienia.
Przypomnij sobie z lekcji przyrody wiadomości o stanach skupienia wody.
Jakie są przedmioty wokół ciebie? Dokonaj podziału przedmiotów, biorąc pod uwagę ich stan skupienia.
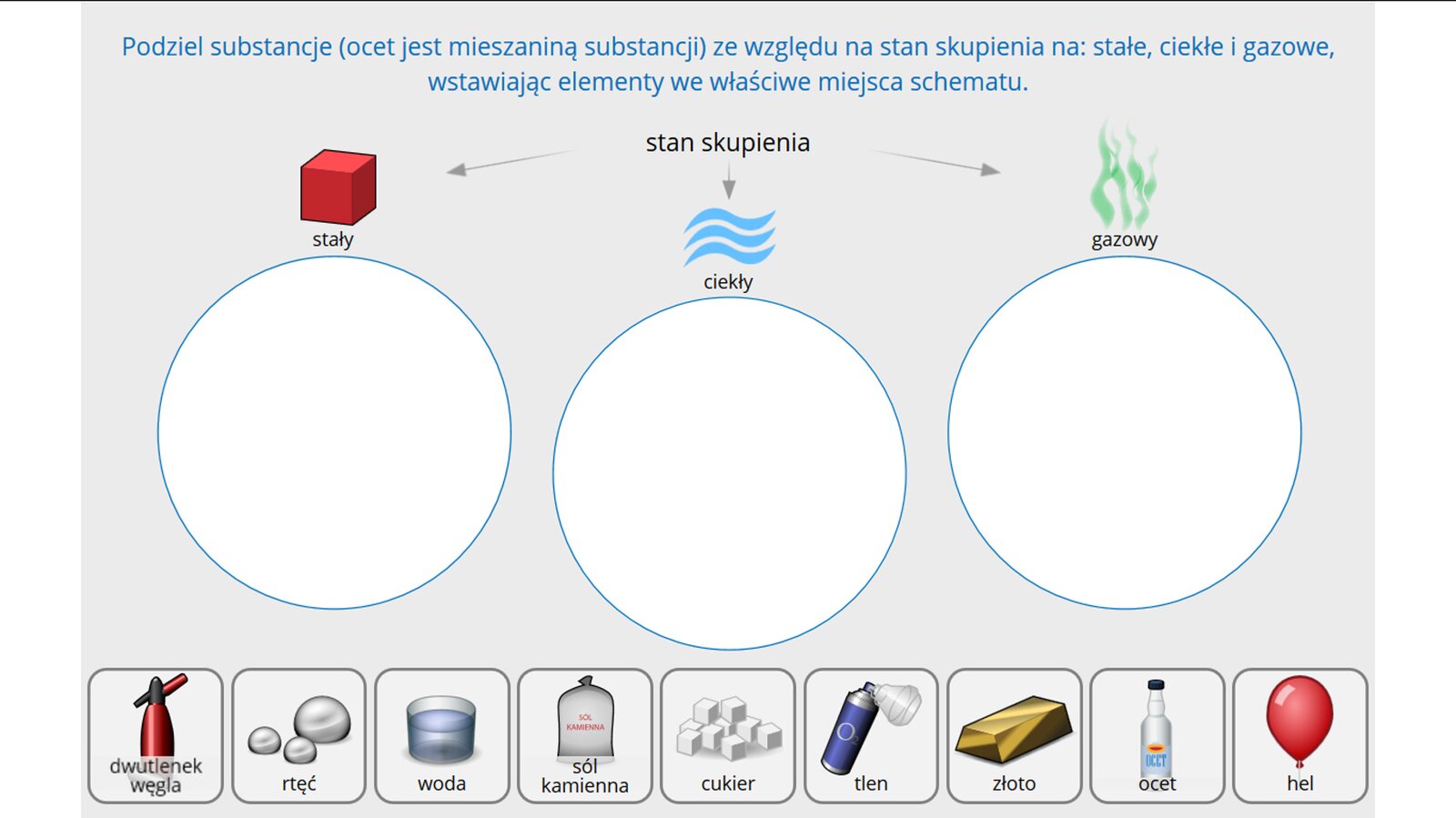
Substancje mogą występować (w określonej temperaturze i przy odpowiednim ciśnieniu) w jednym z trzech podstawowych stanów skupienia:
stałym,
ciekłym,
gazowym.

Substancje mogą zmieniać stan skupienia w określonej temperaturze. Przyjrzyjmy się temu zjawisku na przykładzie wody. Lód topi się, czyli przechodzi ze stanu stałego w ciekły, w temperaturze 0 °C. Mówimy, że jest to temperatura topnienia (krzepnięcia) wody. Kiedy z kolei woda wrze, to przechodzi ze stanu ciekłego w gazowy, w temperaturze 100 °C – mówimy wówczas, że jest to temperatura wrzenia wody.
Wszystkie te zmiany można odwrócić – wystarczy ogrzać lub oziębić wodę.
Niekiedy substancja stała przekształca się bezpośrednio w gaz z pominięciem stanu ciekłego (sublimacja) i odwrotnie – gaz może bezpośrednio przejść w stan stały, bez skraplania i krzepnięcia (resublimacja). Taką substancją jest np. jod. W temperaturze pokojowej występuje w postaci ciemnofioletowych kryształów, a już podczas ogrzewania ulega sublimacji. Widoczne są wtedy fioletowe pary.
Czwarty stan skupienia
Definicja uwzględniająca tylko trzy stany skupienia uległa zmianie, kiedy to w 1928 r. Irving Langmuir (czyt. erwing lanmire) wprowadził pojęcie plazmy.
Plazma to gaz będący najczęściej mieszaniną jonów. We Wszechświecie jest ona najczęściej występującym stanem materii. Są z niej zbudowane gwiazdy (np. Słońce) oraz cała przestrzeń międzygwiezdna. Na Ziemi występuje rzadko, ale można ją zaobserwować przy wyładowaniach atmosferycznych (np. podczas burzy), w zorzy polarnej, płomieniu świecy czy promieniu lasera. Techniczne zastosowanie plazmy jest szerokie, a najbardziej znane produkty, w których się ją wykorzystuje, to telewizory z ekranem plazmowym (PDP – od ang. plasma display panel), świetlówki oraz neonówki.
Powyżej wymieniono podstawowe stany skupienia materii, jednak dotąd poznano ich więcej. W fizyce XXI w. można wyróżnić kilka kolejnych stanów skupienia materii, jak np. stan nadciekły (kondensat Bosego Einsteina), czyli moment, w którym materia nie wykazuje żadnej lepkości.
Zero absolutne W drugiej połowie XIX w. fizycy odkryli, że temperatura jest przejawem chaotycznego ruchu cząstek, z których składa się materia. W substancjach stałych cząstki drgają, w cieczach – przemieszczają się swobodnie we wszystkich kierunkach, zderzając się ze sobą niczym kule bilardowe, a w gazach – poruszają się swobodnie we wszystkich kierunkach. Zero absolutne (zero bezwzględne) to 0 K (kelwinów) czyli –273,15 °C. Jest to taka temperatura, w której cząstki nieruchomieją, przestają się przemieszczać, drgać i obracać, czyli mają najniższą możliwą energię.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/b/P17SIowER
Wiedząc, że temperatura równa 273 K odpowiada 0 °C, wyraź temperaturę pokojową (25 °C) w kelwinach. Zaznacz prawidłową odpowiedź.
Problem badawczy:
Czy badana materia w tych samych warunkach może zachowywać się jednocześnie jak ciecz i substancja stała (mieć właściwości cieczy i substancji stałej)?
Hipoteza:
Badana materia w tych samych warunkach może mieć właściwości cieczy i substancji stałej.
Co będzie potrzebne:
krystalizator lub głęboki talerz;
szklanka;
skrobia ziemniaczana (mąka ziemniaczana);
woda.
Instrukcja:
Do krystalizatora (lub głębokiego talerza) wsypano ok. ½ szklanki mąki ziemniaczanej. Dodano ¼ szklanki wody. Następnie, cały czas mieszając, stopniowo dolewano wodę, aż do momentu uzyskania cieczy o konsystencji bardzo gęstego płynu. Zbadano zachowanie powstałej masy poprzez:
zanurzenie ręki (szybko, wolno);
uderzenie pięścią;
nabranie niewielkiej ilości masy w dłonie i uformowanie kuli;
wrzucenie uformowanej wcześniej kuli do miski z masą;
potrząśnięcie zawartością krystalizatora (talerza).
Obserwacje:
Masa zachowuje się albo jak substancja ciekła, albo jak substancja stała, w zależności od wykonywanych czynności. Na przykład podczas uderzania pięścią wyczuwalne jest ciało stałe, a podczas potrząsania zawartością widoczna jest ciecz.
Wnioski:
W zależności od działającej siły na powstałą masę, zachowuje się ona jak ciecz lub substancja stała. Jeżeli badana materia w tych samych warunkach może mieć właściwości zarówno cieczy, jak i substancji stałej, to nazywamy ją tzw. cieczą nienewtonowską (płynem nienewtonowskim).

Film dostępny pod adresem /preview/resource/RYMlYlBb0bxEG
Animacja prezentująca zmianę stanu skupienia i zależności między ułożeniem cząsteczek wody i mąki ziemniaczanej.
Zapisz hipotezę, obserwacje i wnioski.
Napisz, czym charakteryzuje się ciecz nienewtonowska.
Właściwości fizyczneWłaściwości fizyczne – cechy charakterystyczne substancji:
stan skupienia;
barwa;
rodzaj powierzchni: błyszcząca, matowa, chropowata, porowata;
twardość;
zmiana kształtu ciała pod wpływem sił:
kruchość (odkształcenie trwałe z rozpadem na mniejsze kawałki);
sprężystość (zmiana kształtu pod wpływem niewielkiej siły i powrót do pierwotnego kształtu);
kowalność (odkształcenie trwałe metali, ale bez rozpadu na mniejsze kawałki);
rozpuszczalność w wodzie i innych rozpuszczalnikach (ciekłych, stałych i gazowych);
przewodnictwo ciepła;
przewodnictwo prądu elektrycznego;
właściwości magnetyczne;
temperatura wrzenia;
temperatura topnienia;
gęstość.

Zaplanuj doświadczenie, przeprowadź je i zapisz obserwacje oraz wnioski.
Znajdź podobieństwa i różnice we właściwościach fizycznych następujących substancji: soli kamiennej, cukru, mąki, kawałka kredy, oleju, miedzianego drutu oraz żelaznej szpilki krawieckiej. Porównaj ich barwy, stan skupienia, rozpuszczalność w wodzie.
Przeprowadzono doświadczenie polegające na znalezieniu podobieństw i różnic we właściwościach fizycznych następujących substancji: soli kamiennej, cukru, mąki, kawałka kredy, oleju, miedzianego drutu oraz żelaznej szpilki krawieckiej. Porównano ich barwy, stan skupienia, rozpuszczalność w wodzie.
Problem badawczy:
W jaki sposób można zidentyfikować właściwości fizyczne substancji i ich mieszanin?
Hipoteza:
Niektóre właściwości fizyczne substancji i ich mieszanin można zbadać za pomocą zmysłów.
Co będzie potrzebne:
sól kamienna;
cukier;
mąka;
kawałek kredy;
woda;
olej
miedziany drut;
żelazna szpilka krawiecka;
siedem szalek Petriego;
siedem zlewek;
bagietka.
Instrukcja:
Na sześciu szalkach Petriego umieszczono kolejno po łyżeczce: soli kamiennej, cukru, mąki, rozdrobionej kredy, oleju oraz wody. Na siódmej szalce położono kawałek miedzianego drutu, a na ósmej – żelazną szpilkę krawiecką. Określono stan skupienia oraz barwę badanych substancji. Do zlewek wlano wodę do połowy ich objętości, a następnie dodano badane substancje z szalek Petriego, pomijając wodę. Zawartość zlewek zamieszano bagietką szklaną. Określono czy badane substancje ropuszały się w wodzie.
Obserwacje:
Zanotowano następujące obserwacje:
sól kamienna, stan skupienia: stały, barwa: biała, rozpuszczalność w wodzie: dobra;
cukier, stan skupienia: stały, barwa: biała, rozpuszczalność w wodzie: dobra;
mąka, stan skupienia: stały, barwa: biała, rozpuszczalność w wodzie: słaba;
kawałek kredy, stan skupienia: stały, barwa: biała, rozpuszczalność w wodzie: nierozpuszczalna;
olej, stan skupienia: ciekły, barwa: żółty, rozpuszczalność w wodzie: bardzo słaba;
miedziany drut, stan skupienia: stały, barwa: pomarańczowo‑brunatna, rozpuszczalność w wodzie: nierozpuszczalny;
żelazna szpilka krawiecka, stan skupienia: stały, barwa: srebrzystoszara, rozpuszczalność w wodzie: nierozpuszczalna;
Wnioski:
Hipoteza potwierdzona. Za pomocą zmysłów można zbadać niektóre właściwości fizyczne substancji. Należą do nich m.in. stan skupienia, barwa oraz rozpuszczalność w wodzie.
Uzupełnij tabelę z obserwacjami.
Do właściwości fizycznych należą m.in. stan skupienia. Jakie znasz stany skupienia? Podaj przykłady substancji występujących w tych stanach skupienia Odpowiedź zapisz poniżej.

Film dostępny pod adresem /preview/resource/RE0gEIuRTWoVj
Film przedstawia badanie właściwości fizycznych substancji stałych.

Film dostępny pod adresem /preview/resource/R1TdhX8RXKQfJ
Film przedstawia badanie właściwości fizycznych substancji ciekłych.
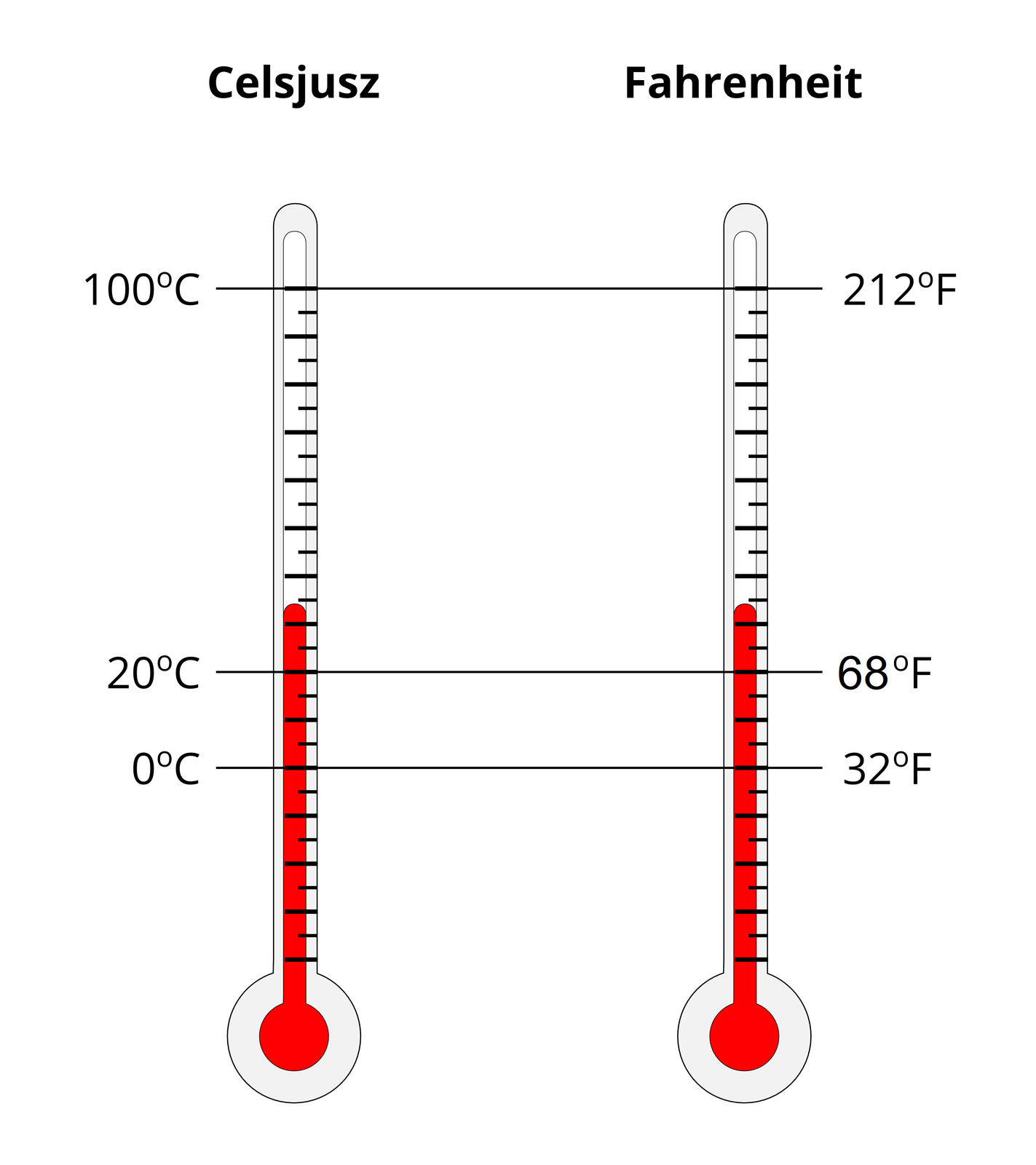
Na początku XVIII w., pochodzący z Gdańska holenderski inżynier Daniel Fahrenheit (czyt. farenhait) wynalazł termometr rtęciowy oraz, wzorując się na duńskim astronomie Olem Romerze, stworzył nową skalę temperatur. Ole Romer (czyt. ule roma) za temperaturę wrzenia wody przyjął 60 stopni, zgodnie z systemem sześćdziesiątkowym, w którym liczą się także czas i kąty (podział na sekundy i minuty). Według tej skali woda zamarza w temperaturze 7,5 stopnia, a temperatura ciała ludzkiego wynosi 22,5 stopnia. Daniel Fahrenheit, który nie lubił ułamków, najpierw pomnożył stopnie Romera przez cztery, a potem jeszcze nieco zmienił, żeby różnica między zerem a temperaturą ludzkiego ciała była równa 64 stopniom. Umożliwiło mu to podzielenie jednego odcinka wielokrotnie na pół (64 to 26) i zrobienie podziałki w swoich termometrach. Tak oto temperatura zamarzania wody w skali Fahrenheita ma wartość 32, a wrzenia – 212 stopni. Amerykanie używają tej skali do dziś. Europejczycy korzystają ze skali szwedzkiego astronoma i fizyka Andersa Celsiusa (czyt. andersa celsiusa), w której 0 stopni to temperatura topnienia lodu, a 100 stopni – temperatura wrzenia wody. Używanie innych skal przez Amerykanów i Europejczyków jest ogromnym utrudnieniem ze względu na brak prostego przelicznika. Prowadzi to do sytuacji, w której Europejczycy i Amerykanie nie są w stanie w pamięci, w szybki i łatwy sposób, przeliczyć skali Celsiusa na Fahrenheita i odwrotnie.
3. Jakie właściwości nazywamy chemicznymi?
Obejrzyj fotografie. Obie drabiny przez kilka miesięcy były narażone na działanie podobnych warunków atmosferycznych.
Zastanów się i napisz, jakimi właściwościami różnią się substancje, z których wykonano obie drabiny.

Dwie drabiny – żelazna i aluminiowa – przez kilka miesięcy były narażone na działanie podobnych warunków atmosferycznych. Drabina żelazna po pewnym czasie zardzewiała, a drabina aluminiowa – nie. Zastanów się i napisz, jakimi właściwościami różnią się substancje, z których wykonano obie drabiny.
Właściwościami chemicznymiWłaściwościami chemicznymi nazywamy te cechy substancji, które można określić na podstawie jej zachowania wobec innych substancji. Są to np.:
zapach,
smak,
palność,
reaktywność (zdolność do reagowania z określonymi substancjami lub jej brak, uleganie rozkładowi na substancje prostsze pod wpływem określonych czynników).


Film dostępny pod adresem /preview/resource/RshRQlxjBmXM6
Film przedstawia badanie właściwości przykładowych substancji, w celu ich identyfikacji.
Znajdź podobieństwa i różnice we właściwościach chemicznych trzech dowolnych substancji: pod nadzorem nauczyciela porównaj ich smak i zapach. Zaplanuj doświadczenie, przeprowadź je, a obserwacje i wnioski zanotuj w zeszycie.
Określenie podobieństw i różnic we właściwościach chemicznych trzech dowolnych substancji.
Problem badawczy:
Czy za pomocą zmysłu węchu i smaku można określić właściwości chemiczne substancji?
Hipoteza:
Za pomocą zmysłu węchu i smaku można określić właściwości chemicznych substancji.
Co będzie potrzebne:
woda;
roztwór wodny kwasu octowego o stężeniu 10 % (ocet);
sól kuchenna;
cukier;
dwie szalki Petriego.
Instrukcja:
Na szalkach Petriego umieszczono kolejno: wodę, ocet, sól kuchenną i cukier. Następnie ostrożnie zbadano substancje za pomocą węchu.
Uwaga! Badanie zapachu należy przeprowadzać z zachowaniem szczególnych środków ostrożności, delikatnie nawiewając ich pary ruchem ręki w stronę nosa.
Następnie ostrożnie zbadano substancje za pomocą zmysłu smaku.
Uwaga! Smak wybranych substancji badamy wyłącznie na wyraźne polecenie nauczyciela.
Obserwacje:
Woda jest bezwonna i bez smaku.
Ocet ma charakterystyczny zapach i kwaśny smak.
Sól kuchenna jest bezwonna i ma charakterystyczny słony smak.
Cukier jest bezwonny i ma charakterystyczny słodki smak.
Wnioski:
Badane substancje różnią się zapachem i smakiem. Właściwości chemiczne substancji i ich mieszanin można określić za pomocą zmysłów węchu i smaku.
Zapisz hipotezę, obserwacje i wnioski.
Zapisz, jakie stężenie procentowe miał ocet wykorzystany w doświadczeniu.
Problem badawczy:
Czy substancje ulegają spalaniu w ten sam sposób?
Hipoteza:
Badane substancje różnią się sposobem spalania.
Co będzie potrzebne:
magnez;
siarka;
palnik;
szczypce metalowe;
okulary ochronne.
Instrukcja:
1. Metalowymi szczypcami chwycono niewielki kawałek wstążki magnezowej i umieszczono go w płomieniu palnika. Zaobserwowano zachodzące zmiany.
2. Metalowymi szczypcami chwycono niewielki kawałek siarki i umieszczono w płomieniu palnika. Zaobserwowano zachodzące zmiany.
Obserwacje:
1. Wstążka magnezowa płonie jasnym, oślepiającym płomieniem. Po spaleniu, na szczypcach metalowych pozostaje biały proszek.
2. Siarka najpierw topi się, a potem płonie spokojnie niebieskim płomieniem. Po spaleniu na łyżce do spalań nic nie pozostaje.
Wnioski:
Hipoteza potwierdzona.
Badane substancje różnią się sposobem spalania. Magnez spala się bardzo szybko oślepiającym płomieniem do tlenku magnezu (czyli białego osadu pozostałego na metalowych szczypcach). Siarka najpierw ulega stopieniu (zjawisko fizyczne), a później spaleniu do tlenku siarki(IV), który jest bezbarwnym gazem (niewidocznym podczas przeprowadzania doświadczenia chemicznego).

Zapisz hipotezę, obserwacje i wnioski.
Napisz, w jakiej formie w doświadczeniu użyto siarki i magnezu.
1. , 2. , 3. , 4. , 5. , 6. 1. , 2. , 3. , 4. , 5. , 6. 1. , 2. , 3. , 4. , 5. , 6. 1. , 2. , 3. , 4. , 5. , 6.
Spalanie siarki:
1. , 2. , 3. , 4. , 5. , 6. 1. , 2. , 3. , 4. , 5. , 6.
Badanie właściwości fizykochemicznych tlenu oraz tlenku węgla(IV)

Film dostępny pod adresem /preview/resource/RBwKGKgo4TqBU
W filmie przedstawiono doświadczenie porównujące właściwości tlenu i tlenku węgla(IV).
Przyporządkuj właściwości fizykochemiczne tlenu oraz tlenku węgla(IV), przenosząc je w odpowiednie miejsca.
Podsumowanie
Świat składa się z różnych substancji, które mają stały skład i określone właściwości.
Każda substancja ma swoje charakterystyczne właściwości fizyczne – np. stan skupienia, barwę, rozpuszczalność w wodzie – oraz chemiczne – np. smak, zapach, palność.
Substancje można zidentyfikować na podstawie ich właściwości.
Zastosowania substancji wynikają z ich charakterystycznych właściwości, zarówno fizycznych, jak i chemicznych (np. cukier jest słodki, dlatego używamy go do słodzenia, dwutlenek węgla nie podtrzymuje palenia, więc jest stosowany jako środek gaśniczy w niektórych rodzajach gaśnic).
Odszukaj w tablicach chemicznych wartości gęstości, temperatur topnienia i wrzenia złota, platyny oraz srebra, a następnie porównaj je ze sobą, zestawiając dane w tabeli.
Odszukaj w tablicach chemicznych wartości gęstości, temperatur topnienia i wrzenia złota, platyny oraz srebra, a następnie porównaj je ze sobą.
Opisz właściwości czterech produktów stosowanych na co dzień. Uwzględnij ich stan skupienia, barwę, rozpuszczalność w wodzie oraz zapach. Dane zestaw w tabeli.
Opisz właściwości czterech produktów stosowanych na co dzień. Uwzględnij ich stan skupienia, barwę, rozpuszczalność w wodzie oraz zapach.
Przedstaw w formie infografiki właściwości substancji z podziałem na właściwości fizyczne i chemiczne.
Słownik
właściwość charakteryzująca substancje stałe, np. metale, które pod wpływem kucia ulegają odkształceniu, tworząc cienkie blaszki, a nawet folie
właściwość substancji stałych lub materiałów, które pod wpływem uderzenia rozpadają się na małe kawałki
liczba gramów substancji stałych, ciekłych i gazowych, które można rozpuścić w 100 g wody w danej temperaturze
rodzaj jednorodnej materii (o stałym składzie chemicznym) o określonych właściwościach (cechach charakterystycznych – stan skupienia (w danych warunkach), barwa, twardość, palność), jak np.: woda, żelazo, miedź, glin
temperatura, w której substancja zmienia stan skupienia ze stałego na ciekły (topi się); temperatura topnienia zależy od ciśnienia w otoczeniu
temperatura, w której ciecz zaczyna wrzeć (substancja zmienia stan skupienia z ciekłego na gazowy); im niższe jest ciśnienie atmosferyczne, tym niższa jest temperatura wrzenia cieczy
cechy substancji, które można określić na podstawie jej zachowania wobec innych substancji; do właściwości chemicznych zaliczamy m.in.: palność, reaktywność, zapach, smak
charakterystyczne cechy danej substancji, takie jak: stan skupienia, barwa, rozpuszczalność (rozpuszczanie to zjawisko fizyczne), przewodnictwo elektryczne, przewodnictwo cieplne, temperatury wrzenia i topnienia, twardość, kruchość, kowalność, połysk, gęstość, właściwości magnetyczne
Ćwiczenia
Oceń prawdziwość każdego zdania. Zaznacz Prawda, jeśli zdanie jest prawdziwe, lub Fałsz, jeśli jest fałszywe.
| Prawda | Fałsz | |
| Substancja ma charakterystyczne właściwości, które umożliwiają jej identyfikację. | □ | □ |
| Stan skupienia materii to jedna z właściwości fizycznych substancji niezależna od temperatury i ciśnienia. | □ | □ |
| Właściwości chemiczne to cechy substancji, które można określić na podstawie jej zachowania wobec innych substancji. | □ | □ |
| Woda niezależnie od ciśnienia zawsze wrze w temperaturze 100 stopni Celsjusza, czyli przechodzi ze stanu ciekłego w gazowy. | □ | □ |
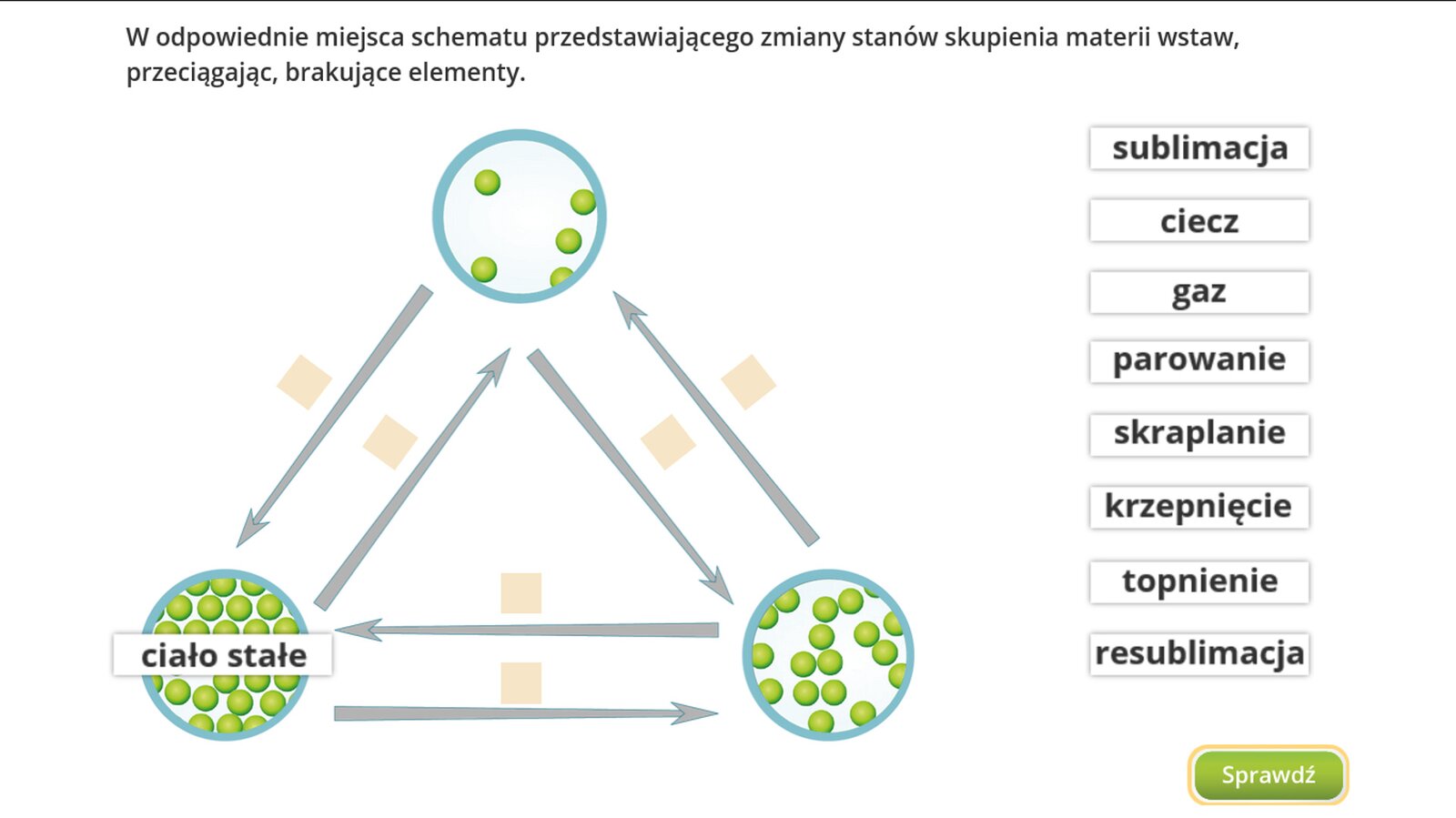
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/b/P17SIowER
stan stały w stan ciekły - 1. resublimacja, 2. krzepnięcie, 3. sublimacja, 4. parowanie, 5. skraplanie, 6. topnienie
stan ciekły w stan stały - 1. resublimacja, 2. krzepnięcie, 3. sublimacja, 4. parowanie, 5. skraplanie, 6. topnienie
stan stały w stan gazowy - 1. resublimacja, 2. krzepnięcie, 3. sublimacja, 4. parowanie, 5. skraplanie, 6. topnienie
stan gazowy w stan stały - 1. resublimacja, 2. krzepnięcie, 3. sublimacja, 4. parowanie, 5. skraplanie, 6. topnienie
stan ciekły w stan gazowy - 1. resublimacja, 2. krzepnięcie, 3. sublimacja, 4. parowanie, 5. skraplanie, 6. topnienie
stan gazowy w stan ciekły - 1. resublimacja, 2. krzepnięcie, 3. sublimacja, 4. parowanie, 5. skraplanie, 6. topnienie
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/b/P17SIowER
Przyjrzyj się fotografiom 1–4 i na ich podstawie określ w tabeli po jednej właściwości charakterystycznej dla każdej z substancji. Pamiętaj, że w każdym wierszu można zaznaczyć tylko jedną odpowiedź.
Na podstawie opisów zdjęć określ w tabeli po jednej właściwości charakterystycznej dla każdej z substancji. Pamiętaj, że w każdym wierszu można zaznaczyć tylko jedną odpowiedź.
Uczniowie w grupach mieli zbadać właściwości wybranych substancji. Informacje z kart pracy zestawiono w tabeli.
Grupa I | Gaz, bezbarwny, bezwonny; ma gęstość najmniejszą spośród wszystkich gazów; podczas jego spalania powstaje woda. |
Grupa II | Ciało stałe, kruche; rozpuszczalne w wodzie; o gęstości 1,587 g/cm³ i temperaturze topnienia 184 °C. |
Grupa III | Ciało stałe, bezwonne; barwy żółtej; nie przewodzi prądu elektrycznego; w reakcji ze srebrem tworzy substancję stałą o czarnej barwie. |
Grupa IV | Substancja stała, barwy czarnej; pod wpływem jej ogrzewania wydziela się m.in. woda. |
Która z grup określiła wyłącznie właściwości fizyczne? Zaznacz prawidłową odpowiedź.
Uczniowie w grupach badali przewodnictwo elektryczne wybranych substancji. Informacje zapisali w kartach pracy w postaci tabeli.
Substancja | Obserwacje |
siarka | żarówka nie świeci się |
cukier | żarówka nie świeci się |
mąka | żarówka nie świeci się |
sól | żarówka nie świeci się |
miedź | żarówka świeci się |
żelazo | żarówka świeci się |
Spośród odpowiedzi zaznacz te, które są wnioskami z doświadczenia, sformułowanymi na podstawie danych z tabeli.
Uzupełnij schemat doświadczenia chemicznego pt. „Cięcie wstążki magnezowej – zjawisko fizyczne czy reakcja chemiczna?” o brakujące elementy, wybierając je z dostępnej puli.
Zaznacz elementy, za pomocą których można przeprowadzić doświadczenie badania palności siarki. Czy spalanie siarki to zjawisko fizyczne czy reakcja chemiczna?
Which of these processes is a physical phenomenon? Select the correct answers.
Bibliografia
Kulawik J., Kulawik T., Litwin M., Podręcznik do chemii dla klasy siódmej szkoły podstawowej, Warszawa 2020.
Łasiński D., Sporny Ł., Strutyńska D., Wróblewski P., Podręcznik dla klasy siódmej szkoły podstawowej, Kielce 2020.