Wykorzystanie badań DNA w medycynie
Dlaczego warto znać swoich krewnych oraz historię zachorowań przodków? Ponieważ predyspozycje do określonych chorób kryją się w genach i można je ustalić już przed przyjściem dziecka na świat.
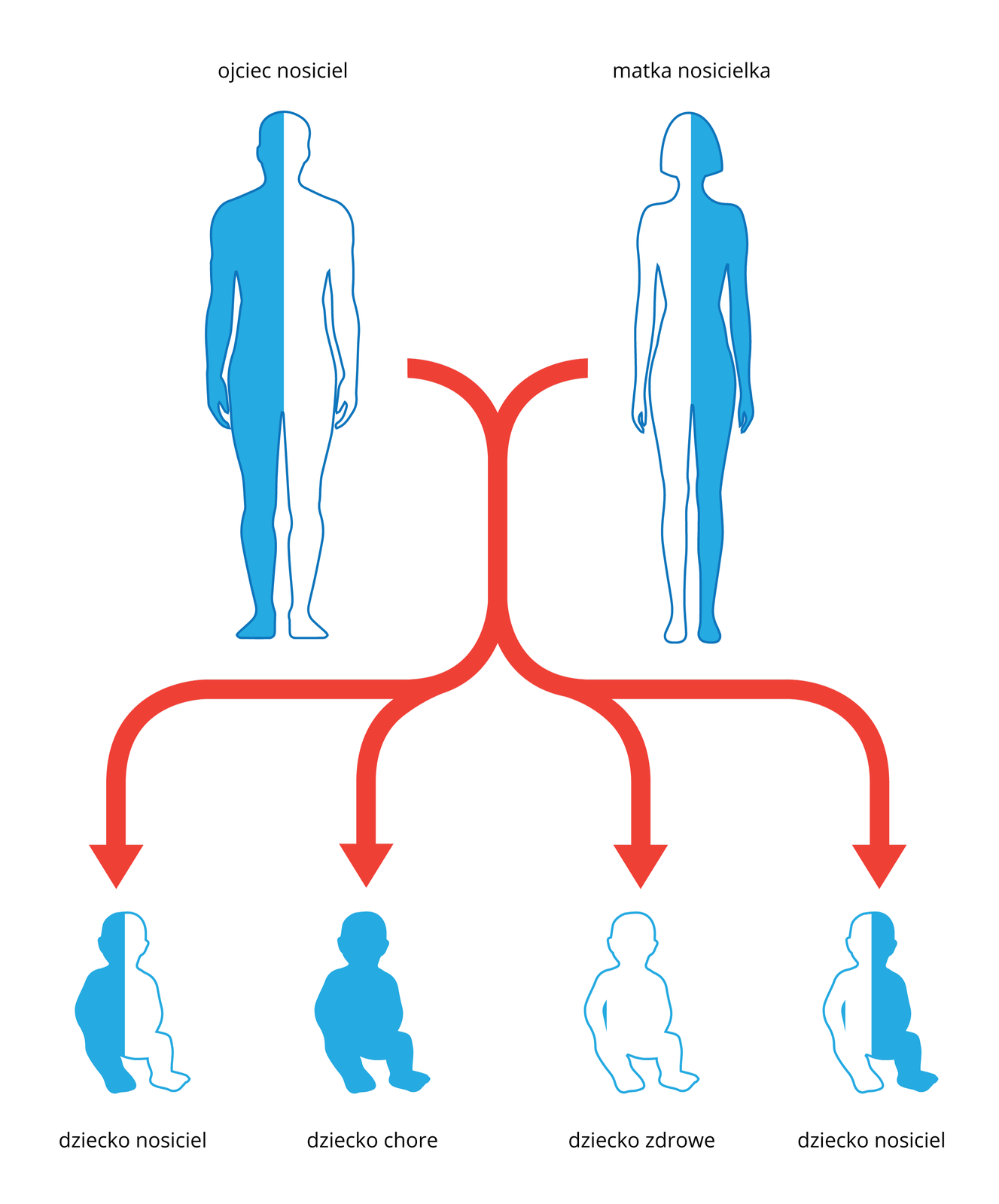
że niektóre choroby genetyczne dziedziczone są zgodnie z prawami Mendla;
że zmiany sekwencji genetycznych niosą ze sobą zmiany w funkcjonowaniu genów, a w konsekwencji – organizmu;
że znamy już 99% sekwencji nukleotydów ludzkiego genomu.
Wymienisz przykłady chorób genetycznych i przedstawisz ich objawy.
Wyjaśnisz związek między mutacją w genie a występowaniem choroby.
Wskażesz sytuacje, w których zasadne jest korzystanie z poradnictwa genetycznego.
Wskażesz znaczenie badań DNA w diagnostyce chorób genetycznych.
Wymienisz korzyści płynące z produkcji leków nowej generacji w walce z chorobami i podasz przykłady biofarmaceutyków.
Wskażesz, jak są pozyskiwane oraz wykorzystywane komórki macierzyste.
Wymienisz korzyści z zastosowania terapii komórkowej.
Wyjaśnisz istotę terapii genowej.
Przedstawisz potencjalne korzyści i zagrożenia związane z terapią genową.
Określisz, czym zajmuje się toksykogenomika.
1. Genetyczne predyspozycje do rozwoju nowotworu
Choroby genetyczne mogą być dziedziczone zgodnie z zasadami odkrytymi przez Grzegorza Mendla. Dlatego wiedząc, że rodzice lub jedno z nich jest chore albo ma chorego krewnego, można oszacować prawdopodobieństwo przekazania wadliwej cechy potomstwu. Dotychczas najlepiej poznano geny przyczyniające się do powstawania niektórych nowotworów.
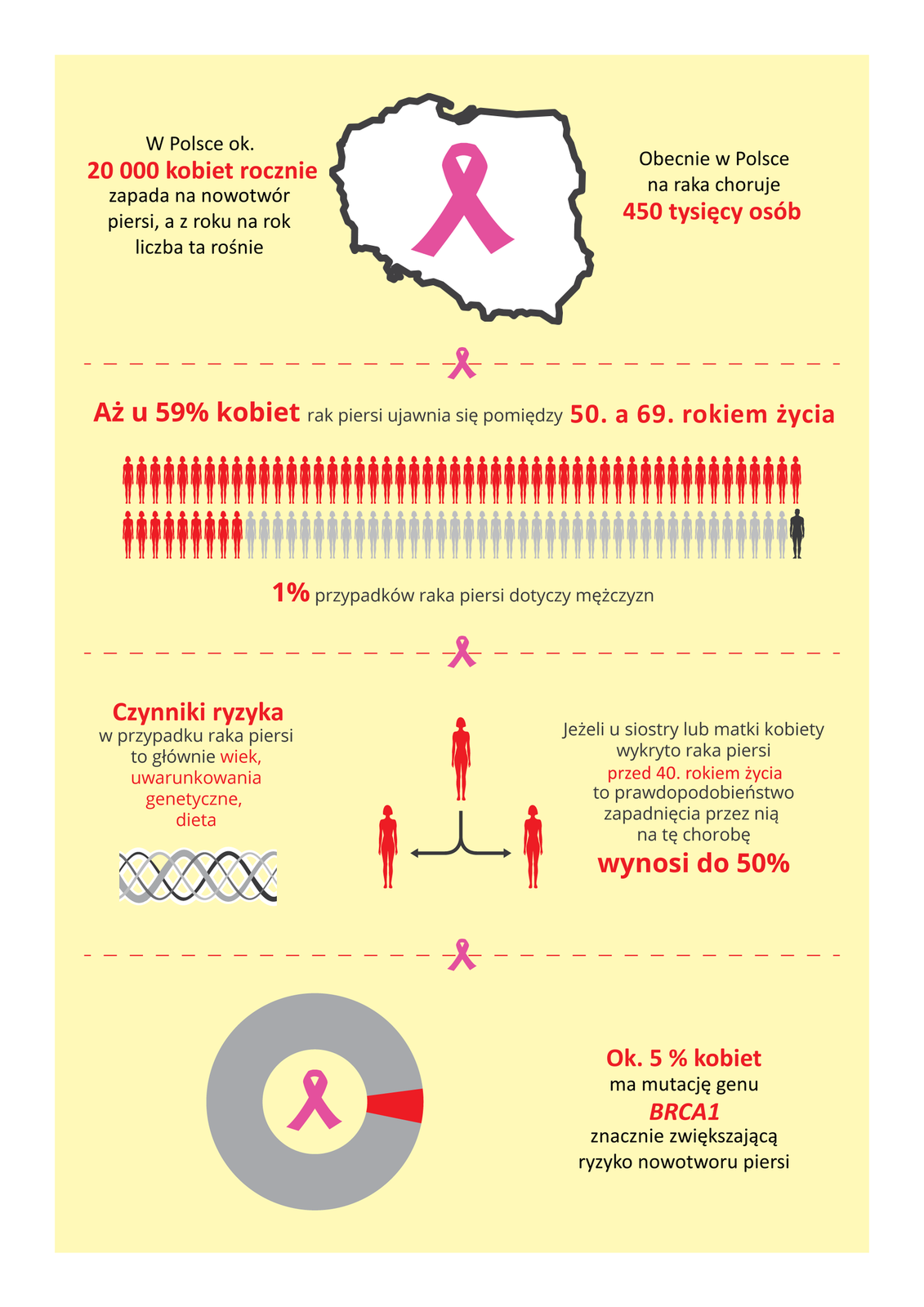
Osoby, których krewni chorowali na raka, mogą przeprowadzić bezpłatne badania w poradniach genetycznych i dowiedzieć się, jakie prawdopodobieństwo rozwoju nowotworu jest w ich przypadku. Sam fakt posiadania zmutowanych genów nie oznacza, że ich właściciel na pewno zapadnie na daną chorobę. Wiedza o zagrożeniu pozwala jednak zmniejszyć ryzyko zachorowania.
Jednym z genów, który ulega częstym mutacjom, jest BRCA, gen kodujący białko BRCA blokujące powielanie uszkodzonego DNA i tym samym umożliwiające jego naprawę. Brak tego białka prowadzi do gromadzenia się mutacji w materiale genetycznym.

Przeanalizuj ilustrację i wskaż czynniki rozwoju choroby nowotworowej, na które mamy wpływ.

Więcej informacji na ten temat znajdziesz w e‑materiale pt. Genetyczne podłoże transformacji nowotworowejGenetyczne podłoże transformacji nowotworowej.
2. Znaczenie badań DNA w diagnostyce chorób genetycznych
Badania nad DNA pozwalają na zidentyfikowanie mutacji genetycznych odpowiedzialnych za choroby genetyczne. Wczesna diagnoza pozwala na szybsze rozpoczęcie leczenia, co może znacząco poprawić jakość życia pacjenta.
Mukowiscydoza (CF) to najczęstsza choroba genetyczna wśród rdzennych Europejczyków. Nosicielem zmutowanego genu jest co 25 osoba w Polsce, a na chorobę zapada 1 na 2,5 tysiąca noworodków. Mukowiscydoza pojawia się, gdy dziecko otrzyma od obojga rodziców zmutowany gen CFTR, zlokalizowany na chromosomie 7. Opisano aż 1600 różnych mutacji w tym genie. Ustalenie rodzaju mutacji u danego pacjenta pozwala na zrozumienie, jak ciężki może być przebieg choroby. Mukowiscydoza jest dziedziczona autosomalnie recesywnie.
Gen CFTR koduje białko odpowiedzialne za przepływ jonów ClIndeks górny - Indeks górny koniec- przez błony komórkowe. Ekspresja zmutowanego genu prowadzi do syntezy wadliwego, niefunkcjonalnego białka. Choroba objawia się wydzielaniem przez gruczoły śluzowe obfitej i gęstej wydzieliny zatykającej oskrzela, co prowadzi do niewydolności oddechowej. W układzie pokarmowym zaburzenia dotyczą trzustki i wątroby - kanaliki trzustkowe i przewody żółciowe są niedrożne, co powoduje stopniowe pogarszanie się pracy tych narządów. Choroba na ogół ma ciężki przebieg. Zanim poznano jej przyczyny, dzieci z mukowiscydozą umierały w 1. roku życia z powodu niewydolności układu oddechowego i niedożywienia. Obecnie chorzy dożywają wieku dorosłego, choć żyją krócej niż przeciętna osoba.
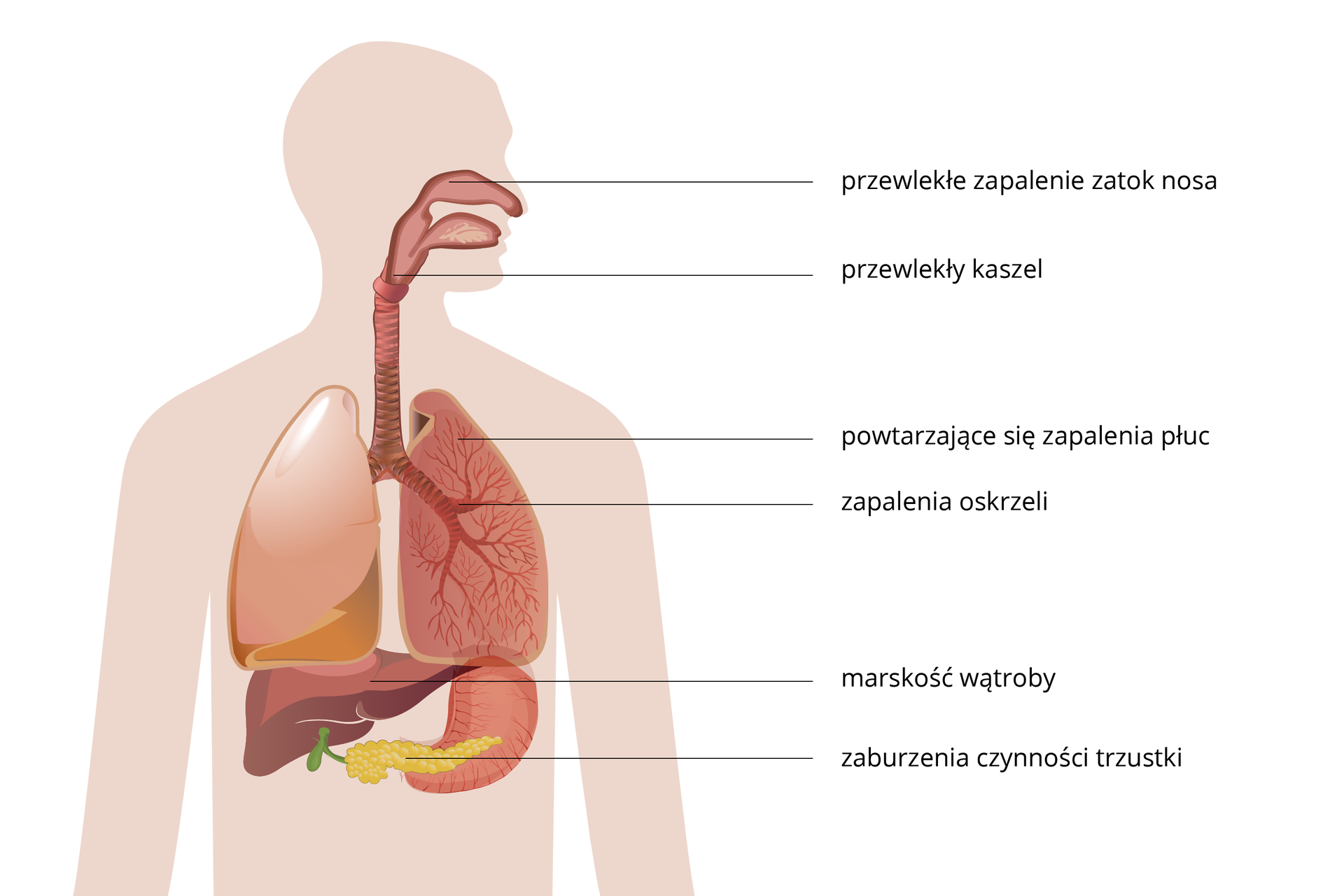
Jedna z hipotez zakłada, że Fryderyk Chopin chorował na łagodną postać mukowiscydozy. Potwierdza to m.in. wczesna śmierć jego siostry (która cierpiała na nawracający kaszel i duszności) oraz kłopoty zdrowotne Fryderyka: częste infekcje dróg oddechowych, nietolerancja pokarmów bogatych w tłuszcze, niezdolność do dużego wysiłku fizycznego. Większość badaczy skłania się jednak ku tezie, że słynny kompozytor chorował na gruźlicę.
Para rodziców, nosicieli genu CFTR, ma 6 zdrowych dzieci niebędących nosicielami. Wyjaśnij, jak to możliwe, że żadne z dzieci nie odziedziczyło wadliwego genu.
Więcej informacji na ten temat znajdziesz w e‑materiale pt. Diagnostyka molekularna chorób genetycznychDiagnostyka molekularna chorób genetycznych.
3. Produkcja leków nowej generacji
Osiągnięcia biotechnologii molekularnej umożliwiają produkcję nowego typu substancji leczniczych określanych mianem biofarmaceutykówbiofarmaceutyków.
Biofarmaceutyki dzielą się na dwie generacje. Generację I stanowią białka mające strukturę aminokwasową identyczną z białkami ludzkimi. Wytwarza się je w celu zastąpienia lub uzupełnienia niedoboru naturalnych białek. Dążenia do uzyskania lepszych preparatów mających wyższą skuteczność i mniej działań ubocznych doprowadziły do otrzymania preparatów II generacji, gdzie naturalne białko zostało celowo zmodyfikowane.
Biofarmaceutyki otrzymywane są z wykorzystaniem organizmów modyfikowanych genetycznie (GMOGMO).
Do biofarmaceutyków należą:
Insulina, którą wytwarzają zmodyfikowane genetycznie pałeczki okrężnicy (Escherichia coli), znajduje z powodzeniem zastosowanie w leczeniu cukrzycy typu I.
Hirudyna pijawki lekarskiej, wytwarzana przez zmodyfikowane genetycznie bakterie laseczki siennej (Bacillus subtilis), stosowana jest do leczenia zakrzepów krwi.
Erytropoetyna człowieka, wytwarzana przez zmodyfikowane genetycznie komórki wyizolowane z nerek i jajników chomika, wykorzystywana jest do leczenia anemii.
Czynnik krzepliwości IX człowieka, wytwarzany przez zmodyfikowane genetycznie komórki ssaków, między innymi krów i owiec, wykorzystywany jest do leczenia hemofilii.
Interferon alfa człowieka, wytwarzany przez zmodyfikowane genetycznie drożdże Saccharomyces cerevisiae, wykorzystywany jest do leczenia chorób wirusowych oraz nowotworowych.
Hormon wzrostu człowieka, wytwarzany przez zmodyfikowane genetycznie pałeczki okrężnicy (Escherichia coli), stosowany jest do leczenia niedoborów wzrostu.
Wiele grzybów i bakterii wytwarza naturalne antybiotyki, które pomagają im w konkurencji z sąsiadami. Z tego powodu naukowcy badają genomy bakterii i poszukują w nich genów kodujących nowe, nieznane jeszcze nauce substancje bakteriobójcze. Opracowano także skuteczne narzędzia do konstruowania genów (niekiedy będących „składanką” fragmentów DNA pochodzącą od różnych mikroorganizmów) i produkcji na ich bazie białek niszczących bakterie lub ograniczających ich wzrost. Jest to metoda radzenia sobie z lekoopornością mikroorganizmów chorobotwórczych, obserwowaną coraz powszechniej w środowisku.
Biofarmaceutykami są przeciwciała monoklonalneprzeciwciała monoklonalne. Przeciwciała monoklonalne swoiście rozpoznają jeden rodzaj antygenu. Stosowane są m.in. w leczeniu chorób autoimmunizacyjnych (reumatoidalnego zapalenia stawów, stwardnienia rozsianego). Hamują reakcję układu immunologicznego chorego poprzez przyłączanie się do wybranych białek. Przeciwciała monoklonalne wykorzystywane są również do leczenia chorób nowotworowych. Zmodyfikowanych przeciwciał używa się do dostarczenia leku bezpośrednio do komórki nowotworowej. Pozwala to zmniejszyć ryzyko efektów ubocznych stosowanej terapii.
Prawdopodobnie za 10 lat, dzięki lekom nowej generacji, będzie można wyleczyć prawie wszystkich chorych na wirusowe zapalenie wątroby typu C. Jest to jedna z najbardziej zakaźnych chorób, która może się rozwijać wiele lat w ukryciu, prowadząc niepostrzeżenie do uszkodzenia wątroby. Obecna terapia z wykorzystaniem interferonu trwa ok. 1 roku i ma wiele skutków ubocznych. Testowane leki nowej generacji mają uniemożliwić powielanie się wirusa w zainfekowanym organizmie i doprowadzić do wyleczenia w ciągu kilku tygodni, a terapia nimi ma być niemal całkowicie pozbawiona skutków ubocznych.
Więcej informacji na ten temat znajdziesz w e‑materiale pt. Biotechnologia molekularna – historia, cele i perspektywyBiotechnologia molekularna – historia, cele i perspektywy.
4. Terapia komórkowa
U człowieka klonowanie dotyczy głównie komórek macierzystychkomórek macierzystych i określane jest mianem klonowania terapeutycznego. Komórki macierzyste charakteryzują się zdolnością do podziałów i przekształcania się w inne typy komórek.
Po podziale komórki zwykle różnicują się (specjalizują), przystosowując do pełnienia określonej funkcji. Choć mają pełny komplet informacji genetycznej zawierającej instrukcję działania całego organizmu, korzystają tylko z jego części przydatnej w narządzie, w skład którego wchodzą. Niektóre komórki organizmu dorosłego człowieka zachowują zdolność do powielania się i różnicowania przez całe życie. Dzięki temu mogą się dzielić w miarę potrzeb organizmu. Chemiczne sygnały wytwarzane przez otaczające je zróżnicowane komórki stają się dla nich impulsami do przekształcania w komórki określonej tkanki, która wymaga regeneracji.
Dojrzałe komórki macierzyste mogą się przekształcić tylko w jeden typ komórek, zależny od ich miejsca występowania w organizmie. Komórki macierzyste obecne w krwi pępowinowej, a także krwiotwórcze komórki macierzyste występujące w szpiku kostnym mogą przekształcać się w komórki wywodzące się tylko z tego listka zarodkowegolistka zarodkowego, z którego pochodzą. Mogą dać początek komórkom szpiku, krwi lub mięśni. Zdolność przekształcania we wszystkie typy mają komórki zarodka. Może z nich powstać ponad 200 różnych tkanek.
Metodę leczenia za pomocą komórek macierzystych (własnych pacjenta lub obcych) określa się mianem terapii komórkowejterapii komórkowej.
Od lat 70. ubiegłego wieku komórki macierzyste są wykorzystywane do hodowli płatów skórnych dla pacjentów z poparzeniami zajmującymi duże powierzchnie. Nowo wyhodowana skóra nie jest jednak identyczna z naturalną, nie ma m.in. mieszków włosowych. Obecnie przeszczep komórek macierzystych stosowany jest także w leczeniu nowotworów krwi oraz układu chłonnego, niektórych ciężkich postaci anemii, a także wrodzonych zaburzeń układu odpornościowego.
Trwają intensywne badania nad wykorzystaniem komórek macierzystych do hodowania tkanek i narządów, które mogłyby zostać przeszczepione bez ryzyka odrzucenia przeszczepu. W przyszłości terapia komórkami macierzystymi może posłużyć m.in. do regeneracji mięśnia sercowego, odtworzenia naczyń krwionośnych po operacji wszczepienia by‑passów. Trwają badania nad wykorzystaniem komórek macierzystych w leczeniu chorób zwyrodnieniowych, a także w opóźnianiu procesu starzenia.
Komórki macierzyste uzyskane od dawców obarczonych chorobami genetycznymi mogą być też stosowane jako modele do badań nad tymi chorobami.
Ze względu na prawny zakaz terapeutycznego wykorzystywania ludzkich zarodków korzysta się z komórek pozazarodkowych, np. zawartych w krwi pępowinowej.
Krew pępowinowa, która jest źródłem komórek macierzystych, może zostać pobrana po porodzie i przechowywana nawet kilkadziesiąt lat, a w razie wystąpienia takich chorób, jak anemie złośliwe, białaczki czy zaburzenia odporności, może być użyta do autotransplantacji.
Więcej informacji na ten temat znajdziesz w e‑materiałach:
Otrzymywanie i pozyskiwanie komórek macierzystychOtrzymywanie i pozyskiwanie komórek macierzystych;
Zastosowanie komórek macierzystych w medycynieZastosowanie komórek macierzystych w medycynie;
Jak wyhodować wątrobę?Jak wyhodować wątrobę?;
Komórki macierzyste – szanse i zagrożeniaKomórki macierzyste – szanse i zagrożenia.
5. Terapia genowa
Terapia genowa polega na wprowadzeniu do komórek osoby chorej prawidłowo funkcjonującej wersji uszkodzonego genu. W tym celu pobiera się od pacjenta komórki somatyczne, najczęściej macierzyste, które nie tracą zdolności do podziałów, co sprzyja stabilizacji terapii. Do genomu tych komórek wprowadza się prawidłowy allel, zaś zmutowany pozostawia się lub usuwa.
Terapia genowa chorób spowodowanych uszkodzeniem pojedynczego genu – opiera się na wprowadzeniu brakującego fragmentu DNA do komórek pacjenta. Jeśli nowy gen zacznie działać w komórkach chorego, który został poddany takiej terapii, komórki będą produkować brakujące białko i objawy mają szansę ustąpić. Jest to szansa dla osób chorych np. na hemofilię czy cukrzycę typu I.
Terapia genowa chorób spowodowana uszkodzeniem wielu genów – zazwyczaj zaburzenia genetyczne są tak poważne, że ich „naprawa” jest praktycznie niemożliwa. Naukowcy starają się jednak wykorzystać terapię genową do niszczenia komórek nowotworowych albo do zatrzymania ich podziałów. Jednym ze sposobów jest apoptoza (samobójstwo) komórek na skutek wprowadzenia do nich odpowiednich genów. Można też zatrzymać podziały komórek raka, wprowadzając do nich geny regulujące cykl komórkowy. Innym sposobem genetycznej walki z nowotworem jest odcięcie nowotworu od tlenu i substancji odżywczych przy pomocy genów hamujących angiogenezęangiogenezę, co doprowadza do „uduszenia” i „zagłodzenia” guza nowotworowego.

Korzyści i zagrożenia związane z terapią genową:
Terapia genowa będzie stosowana w medycynie przyszłości, jednak zanim to nastąpi, człowiek musi się nauczyć manipulować ludzkimi genami i wprowadzać „lecznicze fragmenty materiału genetycznego” do komórek pacjentów.
W prawodawstwie Unii Europejskiej ingerencja w ludzki genom jest dopuszczalna tylko do celów terapeutycznych i dozwolona jedynie w przypadku komórek somatycznych.
Więcej informacji na ten temat znajdziesz w e‑materiałach:
Terapia genowaTerapia genowa;
Procedura terapii genowejProcedura terapii genowej;
Terapia genowa i poradnictwo genetyczneTerapia genowa i poradnictwo genetyczne.
6. Inżynieria genetyczna narzędziem selekcji?
Ingerencja w materiał genetyczny organizmów musi być bardzo rozważna. W przypadku ingerencji w genom człowieka szczególnie istotne są zastrzeżenia etyczne. Manipulacja genetyczna łącznie z technikami zapłodnienia in vitro daje ogromną szansę na ochronę wielu osób przed cierpieniem, ale może też prowadzić do poważnych nadużyć. Pytania natury moralnej i prawnej budzi np. sytuacja, w której kobieta z wadliwie funkcjonującymi mitochondriami pragnie mieć zdrowe dziecko. Stając się matką, każdemu potomkowi wraz z mitochondriami znajdującymi się w cytoplazmie komórki jajowej przekaże swoją wadę genetyczną. Dzięki technikom inżynierii genetycznej jądro komórkowe komórki jajowej przyszłej matki można umieścić w pozbawionej jądra gamecie innej kobiety. Jej gameta zawiera mitochondria, których DNA nie wykazuje wad. Dziecko, które się urodzi po zapłodnieniu tej komórki, będzie miało geny dwóch kobiet (jądrowe pochodzące od chorej matki i mitochondrialne – od dawczyni komórki jajowej) oraz jednego ojca.
Badając zarodki uzyskane metodą zapłodnienia in vitro np. pod kątem ewentualnej mutacji chromosomowej, można wybierać do wszczepienia te, które takiej wady nie mają. Wątpliwości natury etycznej budzi selekcja płci zarodków, np. wszczepianie matkom tylko zarodków płci męskiej. Kryteria selekcji mogą być też inne, np. prognozowana wysoka inteligencja lub wyjątkowa uroda. Czy ludzkość oprze się pragnieniu posiadania idealnego potomstwa? Czy nie doprowadzi to do produkcji ludzi o ściśle określonych cechach, np. idealnych żołnierzy czy supersportowców, których przyszłość będzie tym samym zdeterminowana od momentu zapłodnienia? Jakie kryterium wyboru zarodków zastosować w przypadku wad genetycznych, które mogą mieć nieznaczny wpływ na komfort życia przyszłego dziecka? Na te i wiele innych pytań wciąż brakuje odpowiedzi, dlatego m.in. zasady prawne wielu państw zakazują ingerowania w ludzki genom.
7. Toksykogenomika
Organizmy narażone są na negatywny wpływ różnych czynników obecnych naturalnie w środowisku (np. promieniowanie UV, azbest) oraz wprowadzanych do niego sztucznie. Stopień szkodliwości potencjalnie niebezpiecznych substancji można określić, obserwując wywołane przez nie zmiany w funkcjonowaniu organizmów. Szkodliwe mogą być np. nowe leki, w przypadku których należy określić rodzaj i ryzyko możliwych skutków ubocznych.
Badaniem zmian zachodzących w ekspresji genów i aktywności białek w danych tkankach czy komórkach pod wpływem czynników środowiskowych i toksyn zajmuje się toksykogenomikatoksykogenomika. Obserwacja tych zmian oparta jest na biomarkerachbiomarkerach, substancjach, które pojawiają się w komórkach po podaniu testowanych związków chemicznych. Toksykogenomika pozwala przewidzieć reakcję danego organizmu (o znanych sekwencjach DNA) na określoną substancję (truciznę lub lek) oraz zastosować terapię dedykowaną danej osobie. Dzięki rozwojowi tej dziedziny wiedzy nowego znaczenia nabiera postulat, by leczyć osobę, a nie chorobę.
Rozwój toksykogenomiki może się w przyszłości przyczynić do skrócenia czasu trwania badań przedklinicznychbadań przedklinicznych (na ich etapie leków jeszcze nie podaje się ludziom). Bardziej wyrazista reakcja organizmu (czułe biomarkery) pozwolą na obserwowanie reakcji już w materiale genetycznym.
Celem toksykogenomiki jest zwiększenie czułości testów w celu ograniczenia wielkości stosowanych dawek leków. Ma to duże znaczenie, ponieważ wiele leków to silne trucizny, które w małych ilościach przynoszą bardzo dobre efekty terapeutyczne, natomiast w większych dawkach mogą spowodować śmierć (np. glikozydy nasercowe zawarte w naparstnicy lub konwalii majowej).
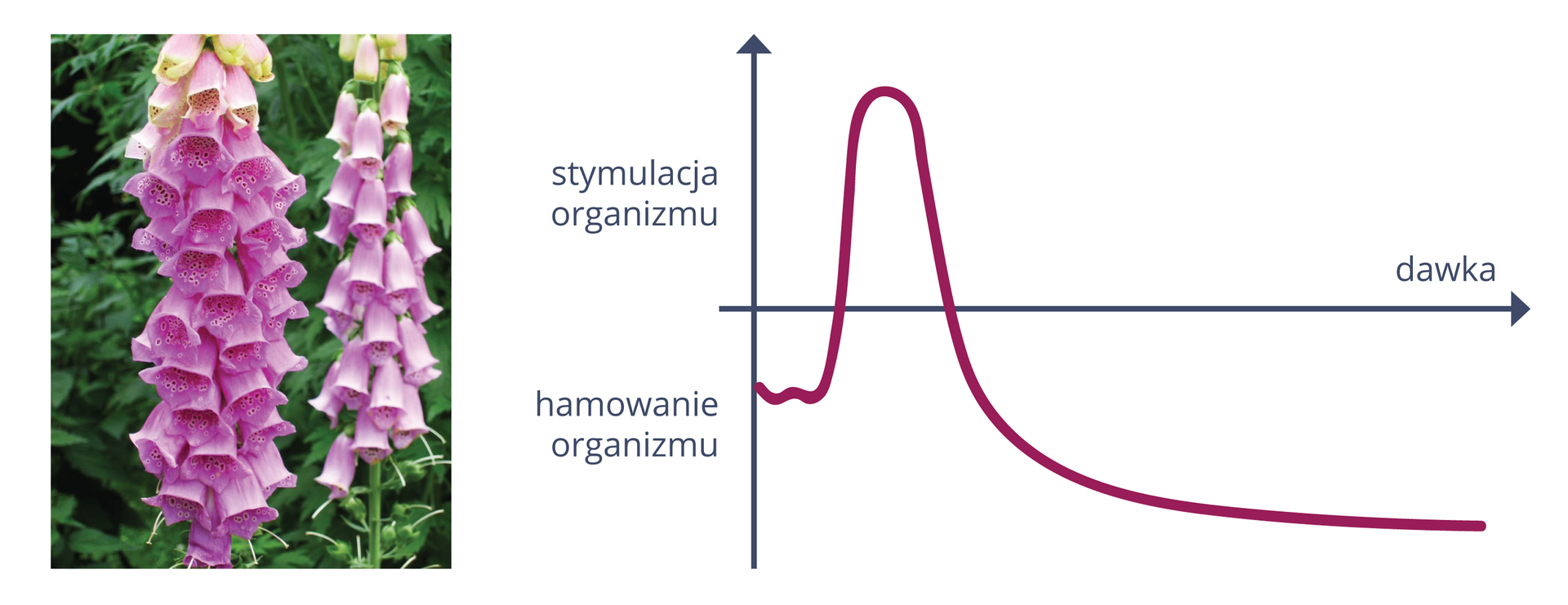
Żyjący w XVI w. szwajcarski lekarz i przyrodnik, zwany ParacelsusemParacelsusem, odkrył, że wpływ substancji leczniczych na organizm zależy od ich dawki: w niewielkich ilościach jest leczniczy, a w dużych – toksyczny. Jest autorem słynnego powiedzenia: „Wszystko jest trucizną i nic nie jest trucizną, bo tylko dawka czyni truciznę”.
Podsumowanie
Do chorób genetycznych należą m.in. mukowiscydoza, która objawia się wydzielaniem przez gruczoły śluzowe obfitej i gęstej wydzieliny zatykającej oskrzela, co prowadzi do niewydolności oddechowej.
Mutacja w genie może skutkować błędną syntezą białek lub ich brakiem, co z kolei może zaburzać funkcje komórek i przyczynić się do rozwinięcia się choroby genetycznej.
Z poradnictwa genetycznego można skorzystać np. podczas planowania rodziny, aby ocenić ryzyko wystąpienia dziedzicznych chorób genetycznych u dziecka. Ponadto do poradni genetycznej mogą zgłosić się osoby, które chcą ocenić ryzyko wystąpienia nowotworu u osób z rodzin obciążonych nowotworami.
Badania genetyczne pozwalają ustalić prawdopodobieństwo pojawienia się choroby genetycznej.
Leki nowej generacji mają wiele zalet, m.in.: są skuteczniejsze i bardziej precyzyjne, mają mniej działań niepożądanych, mogą służyć do leczenia rzadkich chorób.
Komórki macierzyste pozyskuje się z zarodków ludzkich otrzymanych metodą in vitro, łożyska, krwi pępowinowej, szpiku kostnego, krwi obwodowej.
Komórki macierzyste mogą być wykorzystane w medycynie regeneracyjnej uszkodzonych tkanek i narządów.
Terapia genowa polega na wprowadzeniu do komórek osoby chorej prawidłowo funkcjonującej wersji uszkodzonego genu.
Toksykogenomika bada zmiany zachodzące w ekspresji genów pod wpływem czynników środowiskowych i toksyn.
Praca domowa
Wymień korzyści wynikające z zastosowania badań DNA w medycynie.
Słownik
proces tworzenia się naczyń włosowatych
pierwszy etap badań nad nowym lekiem, gdzie sprawdza się, jak substancja oddziałuje na komórki (in vitro) oraz organizmy (in vivo); ich celem jest wstępna ocena bezpieczeństwa i skuteczności potencjalnego leku przed jego pierwszym zastosowaniem u ludzi w badaniach klinicznych
białka (w tym przeciwciała) i kwasy nukleinowe wytwarzane z zastosowaniem biotechnologii w celach terapeutycznych lub diagnostycznych
charakterystyczne substancje pojawiające się w mierzalnych ilościach w komórkach po podaniu określonych substancji, np. toksyn
organizmy modyfikowane genetycznie za pomocą inżynierii genetycznej; mają zmieniony genom np. w wyniku zwielokrotnienia własnych genów lub wprowadzenia do genomu fragmentu DNA pochodzącego z innego organizmu
niedojrzałe komórki organizmu mające zdolność dzielenia się i różnicowania w różne typy tkanek; występują między innymi w zarodkach, krwi pępowinowej, szpiku kostnym
warstwy komórek pojawiające się we wczesnym rozwoju zarodkowym na etapie rozwoju zarodka i przekształcające w dalszym rozwoju w tkanki i narządy; początkowo tworzą się dwie warstwy: zewnętrzny listek zarodkowy, czyli ektoderma, i wewnętrzny listek zarodkowy, czyli endoderma; następnie u większości zwierząt rozwija się między nimi trzeci – środkowy listek zarodkowy, czyli mezoderma
Phillippus Aureolus Theophrastus Bombastus von Hohenheim; ur. 10 XI 1493, Einsiedeln (Szwajcaria), zm. 24 IX 1541, Salzburg (Austria); przyrodnik, lekarz; badał wiele substancji chemicznych oraz naturalnych (np. pochodzących z ziół) pod kątem wykorzystania w lecznictwie
przeciwciała unieszkodliwiające tylko jeden określony antygen
terapia polegająca na wykorzystaniu komórek macierzystych do regeneracji uszkodzonych tkanek i organów
dziedzina nauki zajmująca się badaniem zmian w ekspresji genów i białek oraz ich zróżnicowanych reakcji na dane toksyny w zależności od indywidualnych cech genomu
Zadania
Mutacja w genie BRCA Możliwe odpowiedzi: 1. występuje u części osób zagrożonych nowotworem., 2. umożliwia powielanie uszkodzonych odcinków DNA., 3. zawsze prowadzi do nowotworu piersi., 4. występuje z częstotliwością 1: 200 000 000., 5. u mężczyzn nie prowadzi do rozwoju nowotworu.
Wskaż poprawne zakończenie zdania.
Mutacja w genie BRCA
- występuje u części osób zagrożonych nowotworem.
- umożliwia powielanie uszkodzonych odcinków DNA.
- zawsze prowadzi do nowotworu piersi.
- występuje z częstotliwością 1: 200 000 000.
- u mężczyzn nie prowadzi do rozwoju nowotworu.
Komórki macierzyste... Możliwe odpowiedzi: 1. nie mogą się różnicować w komórki kości., 2. są zdolne do przekształcenia się w inne komórki organizmu., 3. nie mogą być stosowane w medycynie, ale mogą w weterynarii., 4. nie są pobierane od osób z chorobami genetycznymi.
Wskaż poprawne zakończenie zdania.
Komórki macierzyste
- nie mogą różnicować się w komórki kości.
- są zdolne do przekształcenia się w dowolne komórki organizmu.
- nie mogą być stosowane w medycynie, ale mogą w weterynarii.
- pobierane do przeszczepów nie mogą pochodzić od osób z chorobami genetycznymi.
Biomarkery Możliwe odpowiedzi: 1. i interferony to białka wytwarzane przez komórki., 2. są specyficzne dla każdego związku chemicznego., 3. to inna nazwa interferonów., 4. powstają w odpowiedzi na zakażenie wirusem.
Wskaż poprawne zakończenie zdania.
Biomarkery
- i interferony to białka wytwarzane przez komórki.
- są specyficzne dla każdego związku chemicznego.
- to inna nazwa interferonów.
- powstają w odpowiedzi na zakażenie wirusem.