1. Budowa atomu wodoru. Stan podstawowy i stany wzbudzone
Pod koniec wieku i na początku wiedza na temat najmniejszej – jak wtedy uważano – porcji materii, czyli atomu, była raczej skromna. Nie pozwalała na wyjaśnienie zjawiska widma promieniowania atomów (nawet tak prostego jak widmo atomu wodoru). Doświadczenie Rutherforda i model atomu stworzony przez Bohra były przełomem w rozwoju fizyki. Jeżeli chcesz wiedzieć dlaczego, czytaj dalej.
budowa cząsteczkowa materii.
jednostki odległości.
Ich opracowanie znajdziesz w materiale Cząsteczkowa budowa materii i Pomiary w fizyce. Niepewność pomiaru. Przeliczanie wielokrotności i podwielokrotności
jak zbudowany jest atom;
jakie są modele budowy atomu; jaka jest struktura jądra atomowego;
co to są kwarki.
1. Co to jest atom?
Podstawowymi elementami, z których zbudowana jest materia, są atomy. Substancje tworzące świat materialny składają się z różnych atomów. Mają one masę, objętość i kształt. Każdy pierwiastek składa się z atomów tylko jednego rodzaju: żelazo – z atomów żelaza, a złoto – z atomów złota. Pojedyncze atomy różnych pierwiastków, np. żelaza są zbudowane z tych samych cząstek, tylko inna jest ich liczba. Dlatego różnice te są wystarczające, aby ich zbiory tworzyły pierwiastki o odmiennych właściwościach.

Niewielkie rozmiary atomów nie pozwalają nam na oglądanie ich w sposób, w jaki przywykliśmy obserwować otaczający nas świat. Obecnie nie dysponujemy urządzeniami, które pozwalałyby nam swobodnie wnikać w głąb każdego rodzaju materii.
Od niedawna możemy jednak w bardzo niskich temperaturach dostrzec cienką warstwę atomów unieruchomionych na powierzchni innych ciał stałych. Pomaga nam w tym przyrząd, nazywany skaningowym mikroskopem tunelowym. Na otrzymanych za jego pomocą czarno‑białych obrazach zobaczyliśmy, że atomy mają kształt kulisty, a ich rozmiary są różne i zależą od rodzaju badanego pierwiastka. Już na początku angielski uczony John Dalton (czyt. dżon dalton) twierdził, że atomy tworzące różne pierwiastki są kulami, które różnią się między sobą wielkością.

Film dostępny pod adresem /preview/resource/R1UMZT1PnpD9B
Film opowiada o skonstruowaniu pierwszego skaningowego mikroskopu tunelowego, a także o możliwościach, jakie ten wynalazek otworzył. Dzięki niemu uzyskano dokładne obrazy wnętrz atomów, możliwe stało się również ich układanie i przemieszczanie.
2. Spoglądamy w głąb atomu
Niemal do końca uważano, że atomy przypominają niewyobrażalnie małe i twarde jak kamień kulki. Dziś już wiemy, że nie są jednorodne i niepodzielne. Okazuje się, że mają złożoną wewnętrzną budowę. W środku każdego atomu, w samym jego centrum, znajduje się jądro atomowe. Poruszające się w różnych kierunkach z dużą szybkością ujemnie naładowane cząstki, zwane elektronami, tworzą chmurę elektronową. Przestrzeń, którą zajmuje jądro atomowe, jest znacznie mniejsza od przestrzeni zajmowanej przez elektrony – średnica atomu jest około razy większa od średnicy jądra.

Samo jądro atomu ma również złożoną budowę. W jego skład wchodzą dodatnio naładowane cząstki, nazywane protonami, oraz cząstki pozbawione ładunku – neutrony. Protony i neutrony cząstki znajdujące się w jądrze) określa się jako nukleony.
Każdy atom jest elektrycznie obojętną drobiną (nie jest obdarzony żadnym ładunkiem). W jego wnętrzu równoważą się ładunki ujemne i dodatnie. Oznacza to, że liczba protonów i elektronów w każdym atomie jest jednakowa.

Nazwa | Symbol | Ładunek* | Miejsce w atomie |
|---|---|---|---|
elektron | () | -1 | obszar poza jądrem |
proton | () | 1 | jądro atomowe |
neutron | () | 0 | jądro atomowe |
*Ujemny ładunek elektronu i dodatni ładunek protonu mają tę samą wartość bezwzględną (różnią się tylko znakami). Ustalono, że ładunek ujemny elektronu jest elementarnym ładunkiem ujemnym. Zatem proton ma elementarny ładunek dodatni.

Kwarki
Czy składniki atomu są niepodzielne?
Obecny stan wiedzy pozwala nam powiedzieć, że elementarnymi składnikami materii są dwa rodzaje cząstek: leptony i kwarki. Nie wiemy, czy cząstki te mają strukturę wewnętrzną.
Elektron należy do leptonów, czyli zgodnie z obecnym stanem wiedzy jest niepodzielny, nie ma wewnętrznej struktury.
Neutrony i protony są zbudowane z kwarków. Znaleziono dowody na istnienie sześciu rodzajów kwarków. Każdemu z nich fizycy nadali angielskie nazwy, nawiązujące bardziej do życia codziennego niż do świata nauki. W języku polskim nazwy te brzmią: górny (u), dolny (d), dziwny (s), powabny (c), niski (spodni) (b), wysoki (t). Nie istnieją one samodzielnie w przyrodzie, jak tylko w grupie, tworząc inne cząstki. Dwa z nich (górny i dolny) biorą udział w tworzeniu nukleonów.

Nazwa | Symbol | Ładunek | Masa [u] |
|---|---|---|---|
elektron | () | -1 | |
proton | () | 1 | 1 |
neutron | () | 0 | 1 |
Należy wyraźnie podkreślić, że mimo bardzo małych rozmiarów jądra w stosunku do całego atomu, jest ono bardzo ciężkie. Skupia aż masy całego atomu.
Modele budowy atomu
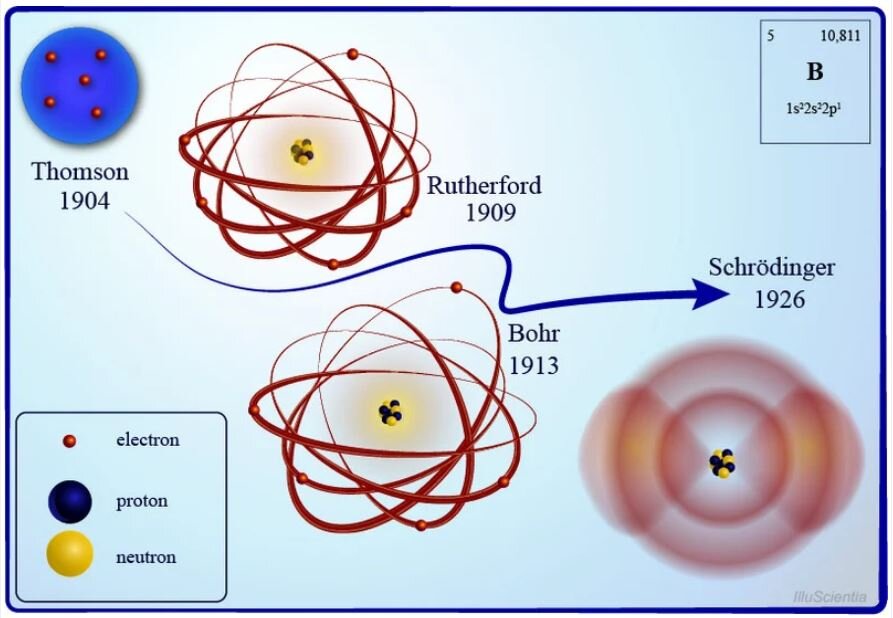
Joseph John ThomsonJoseph John Thomson w roku dokonał przełomowego odkrycia w fizyce i budowie materii. Kiedy badał przewodnictwo gazów, stwierdził, że naelektryzowanie przenoszone jest za pomocą cząsteczek mających pewien ładunek ujemny. Thomsonowi udało się również określić stosunek ich ładunku do masy. Cząsteczką, którą odkrył brytyjski fizyk, był elektronelektron. Thomson dowiódł, że źródłem pochodzenia elektronów są atomy, i tym samym obalił powszechną wówczas ideę o niepodzielności atomu.
Na podstawie późniejszych badań elektron okazał się cząstką niosącą elementarną, czyli podstawową, ilość ładunku elektrycznego.
Model budowy atomu według Thomsona
J. J. Thomson w roku zaproponował model budowy atomu, który składał się z różnych elementów, czyli był podzielny.

Model ten nazywano modelem „ciasta z rodzynkami” lub „puddingu z rodzynkami”. Dlaczego? Thomson twierdził, że dodatni ładunek atomu rozłożony jest równomiernie w całym atomie, w którym znajdują się elektrony o ujemnym ładunku (co przypomina rodzynki w cieście). Jednak bardzo szybko model ten został podważony przez Ernesta Rutherforda.
Model budowy atomu według Rutherforda
Ernest RutherfordErnest Rutherford i jego dwaj pomocnicy – Hans GeigerHans Geiger oraz Ernest MarsdenErnest Marsden przeprowadzili eksperyment bombardowania cienkiej złotej folii cząstkami alfacząstkami alfa, odkrytymi wcześniej przez Rutherforda. Cząstki te mają budowę identyczną jak jądra atomu helu, ale Ernest Rutherford podczas przeprowadzania doświadczenia jeszcze o tym nic nie wiedział. Sądził, że było to promieniowanie – strumień cząstek obdarzonych podwójnym ładunkiem dodatnim , którego źródłem była substancja promieniotwórcza.
Eksperyment Rutherforda był prosty w wykonaniu. Strumień cząstek padał na cienką złotą folię o grubości . Umieszczony wokół ekran rozbłyskiwał, gdy uderzyła w niego cząstka . Na podstawie obserwacji rozbłysków można było wyznaczyć zmianę kierunku poruszającej się cząstki. W późniejszych badaniach wykorzystywano również inne metale. Podczas badań Geiger i Marsden naliczyli ponad sto tysięcy rozbłysków spowodowanych przez cząstki .
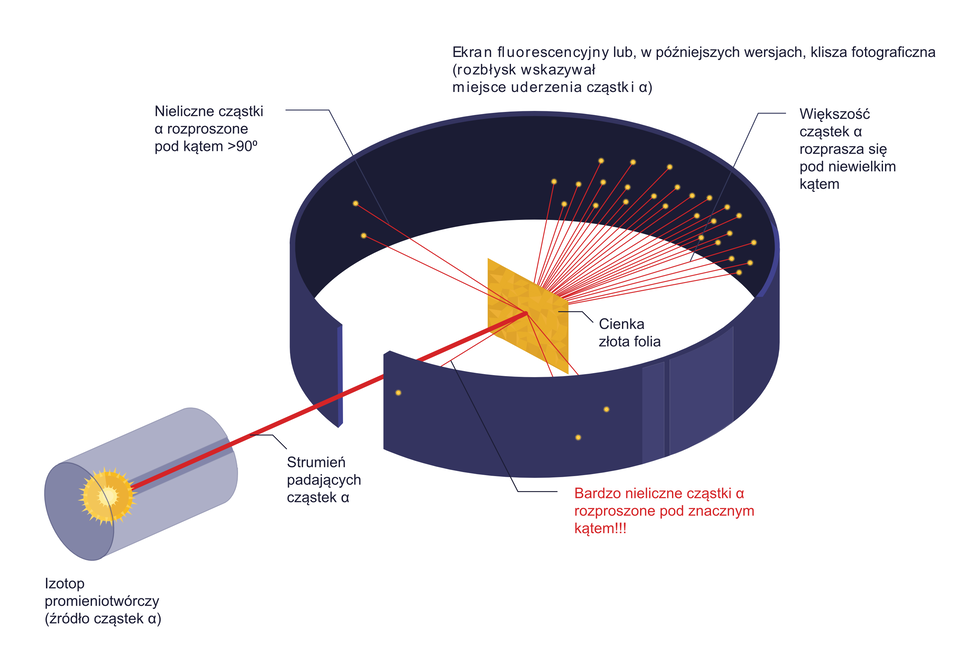
Film dostępny pod adresem /preview/resource/RkBR3A8rA8XkC
Film animowany dotyczący eksperymentu Rutherforda – odkrycie jądra atomowego.
Opublikowane wyniki pomiarów były zdumiewające. Prawie wszystkie cząstki przechodziły przez folię bez zmiany kierunku ruchu, co było niemożliwe w modelu Thomsona. Z kolei znaczne odchylenia torów cząstek , które mogłyby wskazywać na występowanie dużej siły odpychającej cząstki obserwowano bardzo rzadko. Zdarzało się, że cząstka odbijała się od folii i biegła w przeciwną stronę. Rutherford miał nawet powiedzieć, że „ to było tak, jakbyś wystrzelił piętnastocalowy pocisk do kawałka bibułki, a ten pocisk odbił się od bibułki i uderzył w ciebie”.
Rutherford przez osiemnaście miesięcy zastanawiał się, co jest przyczyną, że niektóre cząstki promieniowania doznają tak silnego rozproszenia. Zastanawiało go, jaki jest znak ładunku jądra (Rutherford używał pojęcia „rdzeń”). W końcu fizyk doszedł do wniosku, że muszą one przechodzić w pobliżu pewnych ciał naładowanych dodatnio i mających niezwykle małe rozmiary.

Rutherford przyjął, że w atomie dodatni ładunek jest skupiony w bardzo małej objętości atomu, co sugerowało istnienie jądra atomowego. Elektrony znajdujące się w atomie miały krążyć po zamkniętych orbitach wokół jądra, tak jak planety krążą wokół Słońca. Model ten nazwano planetarnym modelem budowy atomuplanetarnym modelem budowy atomu. Rutherford oszacował, że ciężkie jądro atomowe powinno mieć rozmiar , a oddziaływanie między jądrem a elektronami – charakter elektryczny (kulombowski). Uznał również, że ładunek elektryczny jądra i elektronów na powłokach są sobie równe co do wartości bezwzględnej, tak że atom jako całość pozostaje obojętny elektrycznie.
Model ten miał jednak wiele niedoskonałości. Stał w sprzeczności z fizyką klasyczną, ponieważ fale elektromagnetyczne powinny być emitowane przez krążące elektrony w sposób ciągły, a zatem ich energia kinetyczna musiałaby się zmniejszać i ostatecznie elektrony powinny się zbliżać do jądra, czego nie zaobserwowano. Materia, którą znamy, jest stabilna, a elektrony nie spadają na jądra w atomach.
Jakie zjawisko obserwowane w doświadczeniu Rutherforda by nie zaszło, gdyby prawdziwy okazał się model budowy atomu Thomsona? Dlaczego? Ewentualne notatki możesz zapisać w polu poniżej.
Średnica atomu jest rzędu , a średnica jądra to . Oblicz średnicę atomu w modelu, w którym średnica jądra wynosi .
Model budowy atomu wodoru stworzony przez Bohra ( r.)
Duński fizyk Niels BohrNiels Bohr był uczniem Thomsona, ale bardziej cenił sobie współpracę z Ernestem Rutherfordem. Budowa atomu odkryta przez Rutherforda stała się podstawą do rozważań Bohra nad niezrozumiałymi faktami dotyczącymi tego modelu.
Co sprawia, że atom jest stabilny?
Co decyduje o rozmiarach atomu?
Co różni atomy różnych pierwiastków?
Gdy Bohr dowiedział się o wzorze Balmera, zrozumiał, że rozwiązanie tych problemów jest tylko kwestią czasu.

Dwa postulaty Bohra
Bohr korzystał z modelu atomu Rutherforda i przyjął, że atom wodoru zbudowany jest z dodatnio naładowanego jądra – protonu, wokół którego krąży ujemnie naładowany elektron. Cząstki te przyciągają się wzajemnie siłami zgodnymi z prawem Coulomba. Fizyk rozpatrywał energię całkowitą atomu jako sumę energii kinetycznej elektronu i energii potencjalnej układu proton–elektron. Jednak aby wyjaśnić stabilność atomów oraz kwestię emisji i absorpcji energii przez atom, przyjął dwa postulaty:
I postulat Bohra
1. Elektron krążący wokół jądra nie wysyła energii (jak wynikało to z fizyki klasycznej), jeżeli promień tej orbity i prędkość elektronu spełniają warunek:
gdzie:
– promień orbity, po której krąży elektron;
– masa elektronu;
– wartość prędkości liniowej krążącego elektronu;
– liczba całkowita określająca numer orbity elektronu;
– stała Plancka .
Założenie to nazywane jest pierwszym postulatem Bohra, a takie orbity – orbitami stacjonarnymi.
II postulat Bohra
2. Procesowi przejścia elektronu z jednej orbity na drugą towarzyszy albo wysłanie, albo zaabsorbowanie pewnej ściśle określonej porcji energii (kwantu energii, fotonu).
Bohr założył, że do zmian energii atomu może dojść tylko wtedy, gdy elektron przechodzi z orbity znajdującej się bliżej jądra na orbitę dalszą (lub odwrotnie). Zmiana energii równa jest porcji (kwantowi) energii, która zgodnie ze wzorem Plancka jest równa:
gdzie:
, – odpowiednie numery orbit elektronu;
– stała Plancka;
– częstotliwość promieniowania elektromagnetycznego;
– długość fali promieniowania elektromagnetycznego;
– prędkość światła w próżni.
Warunek ten, nazywany drugim postulatem Bohra, związany jest z przejściem elektronu z jednej orbity na drugą.
Kwantowanie promienia i energii atomu wodoru
Rozważania i obliczenia uwzględniające siły, jakimi działają na siebie jądro wodoru i elektron, związek energii całkowitej atomu z energią kinetyczną elektronu i energią potencjalną układu proton–elektron w połączeniu z postulatem Bohra doprowadziły do otrzymania zależności:
Promień orbity stacjonarnej można wyrazić wzorem:
.Energię całkowitą atomu wodoru można przedstawić wzorem:
.
Jak widać, obie zależności zawierają wielkość oznaczoną literą , która nazywana jest główną liczbą kwantową.
Wartość promienia dla jest równa i nazywana jest promieniem pierwszej orbity Bohra w atomie wodoru. Promień drugiej orbity jest razy większy, trzeciej – razy większy itd. Obecnie wartości tych promieni mają znaczenie jedynie historyczne – według nowych teorii opisujących atom, elektron nie jest już naładowaną ujemnie kulką.
Energia całkowita atomu wodoru (po podstawieniu odpowiednich wartości liczbowych) może być wyrażona jako:
Z tej zależności wynika, że energia atomu jest ujemna. Oznacza to, że atom wodoru nie może się samorzutnie rozpaść na jądro i elektron.
Najmniejszą energię ma atom wodoru w stanie, dla którego . Jest ona równa . Ten stan nazywamy stanem podstawowymstanem podstawowym. Wartości energii dla przedstawione w poniższej tabeli, dotyczą atomów znajdujących się na jednym z wyższych poziomów energetycznych.
Poziomy energetyczne można przedstawić za pomocą schematu:
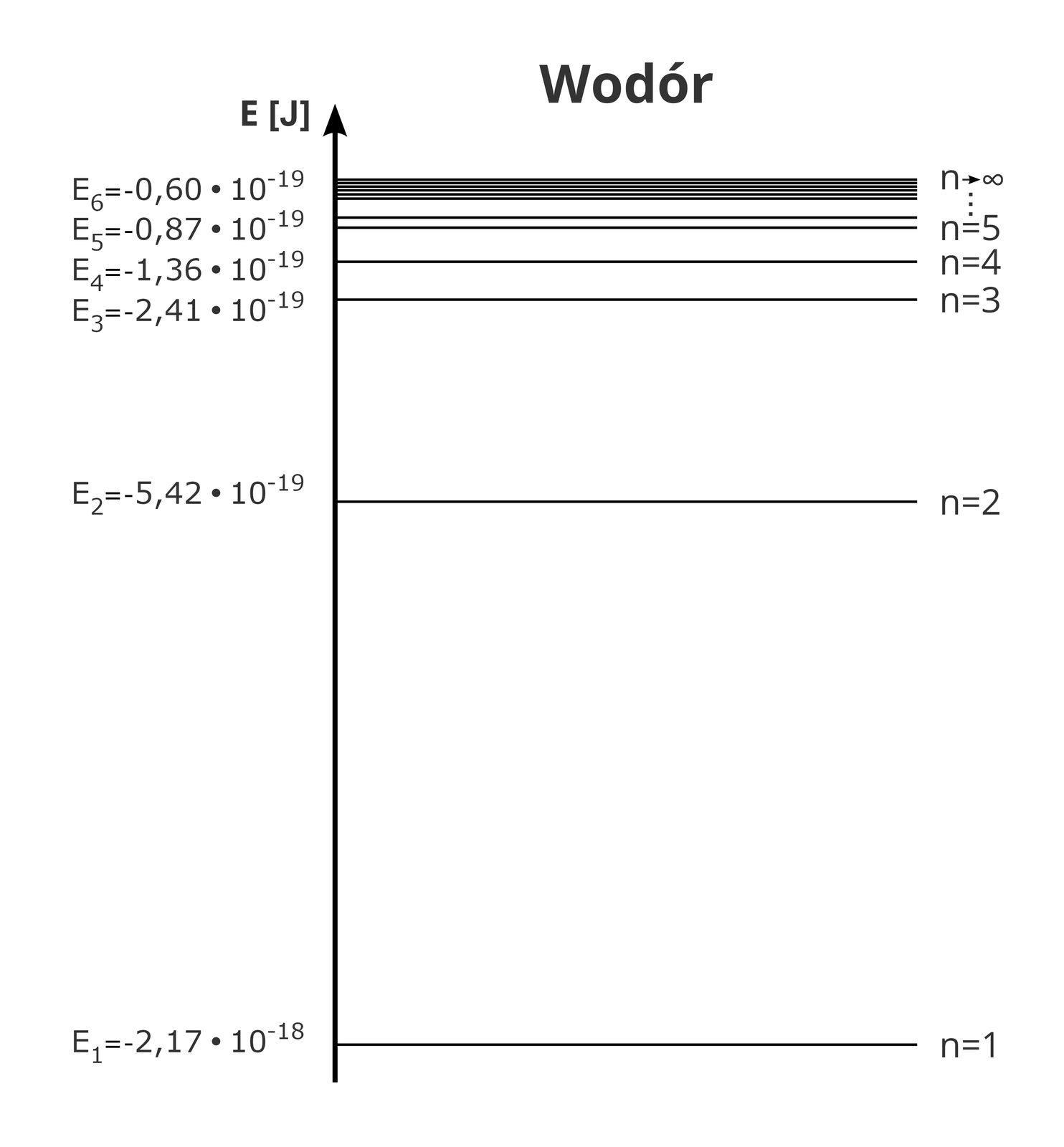
Widzimy zatem, że energia atomu nie może być dowolna. Stany, w których elektron znajduje się na wyższych poziomach energetycznych, czyli itd., nazywamy stanami wzbudzonymistanami wzbudzonymi, ponieważ atom wodoru musi wtedy zwiększyć swoją energię do odpowiedniej wartości. Aby to lepiej zrozumieć, można posłużyć się pewną dość prostą analogią do prostopadłościanu o krawędziach , i .
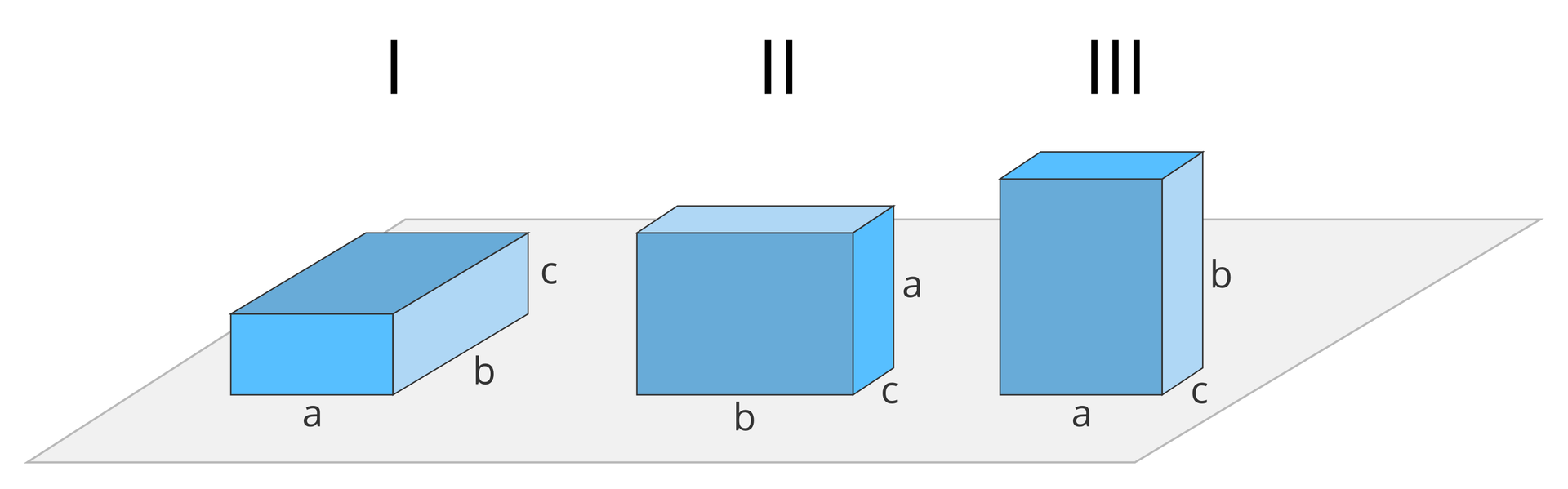
Prostopadłościan ten można położyć stabilnie tylko na jednej z trzech różnych ścian. Położenie , w którym prostopadłościan leży na ścianie , oznacza, że ma on najniższą energię potencjalną w stosunku do podłoża. Położenie , w którym prostopadłościan leży na ścianie , oznacza większą energię potencjalną, a położenie , czyli na ścianie – największą (przedyskutujcie w klasie, dlaczego tak jest). Oczywiście, aby przenieść prostopadłościan ze stanu do albo ze stanu do , trzeba wykonać pracę o wartości różnicy energii potencjalnych.
Oblicz wartość energii, jaką musi pochłonąć atom znajdujący się na poziomie podstawowym, aby przejść na drugi poziom.
Energia na drugim poziomie jest równa:
,
a energia na pierwszym poziomie:
.
Z obliczeń wynika, że atom musi zwiększyć swoją energię o
.
Oblicz wartość energii, jaką musi pochłonąć atom wodoru, aby przejść z drugiego poziomu na trzeci poziom .
Energia na trzecim poziomie wynosi:
,
a energia na drugim poziomie:
.
.
Po podstawieniu wartości , , otrzymamy .
Pochłanianie i emisja promieniowania przez atom wodoru
Z powyższych rozważań wynika, że pochłonięcie kwantu promieniowania przez atom może skutkować przeskokiem elektronu na wyższy poziom energetyczny (atom wodoru przechodzi w stan wzbudzony) tylko wówczas, gdy energia promieniowania jest równa dokładnie różnicy między wybranymi stanami energetycznymi. Natomiast gdy elektron powraca na niższy poziom energetyczny, musi wypromieniować energię w postaci promieniowania elektromagnetycznego o wartości równej dokładnie różnicy energii między poziomami energetycznymi. Możliwe są sytuacje, w których atom pochłania taką energię, że przechodzi np. z pierwszego poziomu od razu na czwarty. W stanie wzbudzonym atom „przebywa” krótko – przeciętnie (jedna stumilionowa część sekundy). Potem pozbywa się nadmiaru energii i przechodzi na jeden z poziomów o niższej energii – może przeskoczyć od razu na pierwszy poziom, ale często jest to przejście stopniowe (etapowe) najpierw na trzeci poziom, potem na drugi itd. Podczas każdego przejścia atom wysyła kwant energii, co oznacza emisję promieniowania o ściśle określonej długości fali (barwie).

Warto wspomnieć o tym, w jaki sposób możemy pobudzić atomy gazu do świecenia. Odbywa się to w ten sposób, że podczas zderzenia atomów (jak wiemy, im wyższa temperatura, tym poruszają się one szybciej) następuje pochłonięcie energii kinetycznej, w wyniku czego atom przechodzi z poziomu podstawowego na jeden z poziomów wzbudzonych. Właśnie wtedy mówimy o wzbudzeniu termicznym. Potem następują procesy przechodzenia na niższe poziomy energetyczne i wysyłanie jednego lub kilku kwantów promieniowania.
Model Bohra sprawdzał się dobrze w trakcie badań atomu wodoru. Zgodność obliczeń z wynikami pomiarów była w pełni satysfakcjonująca. Jednak uogólnienie tego modelu na atomy innych pierwiastków niosło wiele problemów. Wynikało to np. z tego, że w atomie wodoru rozpatrujemy oddziaływania jednego protonu z jednym elektronem. W atomie helu mamy już dwa ładunki elementarne w jądrze i dwa elektrony. Ponadto nie tylko jądro działa na każdy z elektronów, lecz także one oddziałują ze sobą. Jeżeli jednak będziemy analizować atom zjonizowanego helu, w którym wokół jądra krąży tylko jeden elektron, to opis okaże się znacznie prostszy, a jego widmo – bardzo podobne do widma wodoru. Oczywiście, długości emitowanych i absorbowanych fal są inne – zawsze wiadomo, z którym pierwiastkiem mamy do czynienia. Łatwo można opisać również atomy wodoropodobne, takie jak sód, w których na ostatniej orbicie krąży jeden elektron.
Oddziaływania w atomach wieloelektronowych
Oddziaływania w atomach wieloelektronowych są bardzo złożone i, jak się później okazało, nie tylko energia jest skwantowana – inne wielkości fizyczne także mogą przyjmować tylko ściśle określoną wartość. Należą do nich moment pędu, orbitalny moment magnetyczny i tzw. moment spinowy (będziesz mógł je poznać w dalszym toku nauki). Bohr wprowadził swoje postulaty, aby uzyskać zgodność z obserwacjami. W następnych latach zrozumiano, dlaczego prawdziwy jest pierwszy postulat Bohra, ale wtedy już nie traktowano elektronu jako kulki mającej ładunek elektryczny. Te dwie teorie (potwierdzone doświadczalnie) – model planetarny Rutherforda i model Bohra – stały się podstawą zrozumienia procesów w świecie atomów. Powstała mechanika kwantowa, pozwalająca wyjaśnić atomową budowę ciał stałych, co z kolei doprowadziło do poznania ich wielu niezwykłych właściwości. Odkrycie półprzewodników sprawiło, że wiele nowoczesnych urządzeń zostało zminiaturyzowanych; teraz urządzenia, które kiedyś zajmowałyby ogromne pomieszczenia, mieszczą się w kieszeni. Na płytce wielkości paznokcia możemy mieć bibliotekę tysięcy audiobooków lub e‑booków, zapisać film, nawet gdyby trwał on kilkadziesiąt godzin, lub przechować kilkaset godzin muzyki.
Pomiędzy np. piątym poziomem energetycznym a ostatnim, w którym energia atomu jest równa zero, jest nieskończenie wiele poziomów energetycznych. Uzasadnij, dlaczego nie oznacza to, że energia atomu wodoru może przyjmować dowolną wartość.
W drugim przykładzie obliczyliśmy, że przejście atomu z poziomu drugiego na trzeci wymaga pochłonięcia energii o wartości około . Oblicz długość fali promieniowania, której kwant został pochłonięty. Jaka jest barwa światła o tej długości fali?
Podsumowanie
Każdy atom jest elektrycznie obojętną cząstką (nie jest obdarzony żadnym ładunkiem). W jego wnętrzu równoważą się ładunki ujemne i dodatnie. Oznacza to, że liczba protonów i elektronów w każdym atomie jest jednakowa.
Ujemny ładunek elektronu i dodatni ładunek protonu mają tę samą wartość bezwzględną (różnią się tylko znakami).
Ładunek ujemny elektronu jest elementarnym ładunkiem ujemnym. Proton ma elementarny ładunek dodatni.
Model atomu wodoru stworzony przez Rutherforda wskazał jądro atomowe jako centrum atomu, dookoła którego krążą elektrony niczym planety wokół Słońca (tzw. model planetarny atomu).
Model atomu Bohra wprowadził do języka fizyki nowe pojęcia, np.: stan wzbudzony, stan podstawowy, orbita stacjonarna, widmo promieniowania, seria widmowa, stan energetyczny i in.
W atomie wodoru, gdy elektron powraca na niższy poziom energetyczny, musi wypromieniować energię w postaci promieniowania elektromagnetycznego o wartości równej dokładnie różnicy energii między poziomami energetycznymi.
Pochłonięcie kwantu promieniowania przez atom może skutkować przeskokiem elektronu na wyższy poziom energetyczny (atom wodoru przechodzi w stan wzbudzony).
Za pomocą modelu Bohra można wyjaśnić układ linii widmowych atomu wodoru.
Model atomu Bohra pozwala opisać precyzyjnie budowę jedynie atomu wodoru; zawodzi w odniesieniu do atomów mających bardziej złożone jądro atomowe, wokół którego krąży więcej elektronów.
Dzięki modelowi Bohra stworzono podstawy nowej gałęzi fizyki współczesnej – mechaniki kwantowej.
Na schemacie układu poziomów energetycznych atomu wodoru narysuj przejście z poziomu trzeciego na drugi, z czwartego na drugi i z piątego na drugi. Oblicz wartości energii emitowanej za każdym razem oraz długości fal otrzymanego promieniowania. Porównaj wyniki obliczeń z długościami linii widmowych wodoru.
Opisz na przykładzie układu poziomów energetycznych atomu wodoru przejścia z poziomu trzeciego na drugi, z czwartego na drugi i z piątego na drugi. Oblicz wartości energii emitowanej za każdym razem oraz długości fal otrzymanego promieniowania. Porównaj wyniki obliczeń z długościami linii widmowych wodoru.
Oblicz długości fali promieniowania wysyłanego przez atom wodoru podczas przejścia z drugiego poziomu na podstawowy i z czwartego poziomu na trzeci. W jakich obszarach promieniowania elektromagnetycznego (radiowe, podczerwień, widzialne, nadfiolet) znajduje się to promieniowanie?
Uwaga: poniższe zadania warto przedyskutować również podczas lekcji.
W atmosferze gwiazdy, podobnie jak w każdym gazie, atomy poruszają się ruchem chaotycznym, zderzając się wzajemnie. W gazie o niskiej temperaturze większość atomów znajduje się zatem na poziomie podstawowym, ale w wyższych temperaturach energia zderzeń jest na tyle duża, że przeciętny atom znajduje się na drugim poziomie (jest tak w temperaturze rzędu – ). Atom wodoru znajdujący się w tym stanie pochłania (absorbuje) fotony biegnące z wnętrza gwiazdy i przechodzi na jeden z wyższych poziomów energetycznych. W jakim obszarze widma (podczerwień, światło widzialne, ultrafiolet) odbywa się ta absorpcja? Odpowiedź uzasadnij (skorzystaj z wyników obliczeń w poprzednim zadaniu).
Każdy atom lub jon emituje lub pochłania promieniowanie o innych długościach fali. Ma też charakterystyczne widmo pierwiastka. Kiedy astronomowie badali widma dwóch gwiazd, stwierdzili, że w pierwszej gwieździe dominują linie pierwiastków w stanie neutralnym, a w drugiej – głównie pierwiastków zjonizowanych. Jaki wniosek mogą sformułować astronomowie na tej podstawie? Uzasadnij odpowiedź.
Kiedy badano widmo Słońca, wykryto obecność pierwiastka nieznanego wtedy na Ziemi. Był to hel. Kilkadziesiąt lat później, podczas badań widma korony słonecznej (atmosfery Słońca, którą widać podczas jego całkowitych zaćmień), stwierdzono ponownie obecność linii nieznanych pierwiastków. Jeden z nich nazwano „koronium”. Po niedługim czasie okazało się, że są to linie pierwiastków znanych na Ziemi, ale wielokrotnie zjonizowanych (np. żelazo pozbawione kilkunastu elektronów). Świadczyło to o bardzo wysokiej temperaturze. Dlaczego? Ewentualne notatki możesz zapisać w polu poniżej.
Temperatura korony słonecznej wynosi od miliona do dwóch milionów kelwinów i jest znacznie wyższa od temperatury powierzchni Słońca.
Zadania
Uzupełnij poniższą lukę. Kliknij w nią, aby rozwinąć listę, a następnie wybierz poprawną odpowiedź. Wzbudzony atom wodoru znajdujący się na trzecim poziomie energetycznym może przejść na poziom podstawowy na 1. jeden, 2. dwa, 3. cztery, 4. trzy sposób/sposoby.
Wybierz prawidłową ilość sposobów jakimi elektron może przejść z orbity 3, na poziom podstawowy.
jeden, dwa, trzy, cztery
Wzbudzony atom wodoru znajdujący się na trzecim poziomie energetycznym może przejść na poziom podstawowy na ............ sposób/sposoby.
Które informacje są prawdziwe, a które fałszywe?
| Prawda | Fałsz | |
| Zgodnie z fizyką klasyczną atom wodoru powinien emitować widmo liniowe. | □ | □ |
| Zgodnie z fizyką klasyczną w modelu Rutherforda elektron powinien spaść na jądro. | □ | □ |
| Atom znajdujący się w stanie wzbudzonym, wracając do stanu podstawowego, może wyemitować więcej niż jeden foton, jeżeli nie znajduje się na pierwszym poziomie wzbudzonym. | □ | □ |
Słownik
najmniejsza część pierwiastka chemicznego, która zachowuje jego właściwości chemiczne.
jądro atomu helu.
trwała niepodzielna cząstka elementarna o ładunku ujemnym (elementarnym ładunku ujemnym); składnik atomu, zajmuje obszar w przestrzeni wokół jądra
centralna część atomu, zbudowana z jednego lub więcej protonów i neutronów (nie wszystkie jądra atomowe zawierają neutrony, np. ); stanowi niewielką część objętości całego atomu, ale w jądrze skupiona jest prawie cała masa atomu
liczba protonów w jądrze atomowym (równa liczbie elektronów).
liczba nukleonów, równa sumie liczby protonów i liczby neutronów.
atomowa jednostka masy, unit []; jednostka masy, wykorzystywana do określania względnych mas atomów (tzw. mas atomowych), liczbowo równa .
model atomu wodoru zaproponowany w r. przez Nielsa Bohra. Zgodnie z jego koncepcją wokół dodatnio naładowanego jądra krąży elektron, który porusza się po zamkniętej orbicie stacjonarnej. Atom w modelu Bohra może przyjmować jedynie pewne ściśle określone (dyskretne) wartości energii; również elektron może krążyć jedynie po orbitach o ustalonym promieniu. W celu zmiany stanu energetycznego atomu należy dostarczyć mu ściśle określoną porcję (kwant) energii. Przejściu atomu do stanu o niższej energii towarzyszy emisja kwantu promieniowania elektromagnetycznego o ściśle określonej długości fali.
cząstka obojętna (nie posiada ładunku elektrycznego) będąca składnikiem jądra atomowego; neutrony nie są cząstkami elementarnymi, składają się z mniejszych elementów, tzw. kwarków (górnego i dwóch kwarków dolnych).
model budowy atomu zaproponowany przez Rutherforda. Według tej koncepcji elektrony krążą wokół małego jądra naładowanego dodatnio.
cząstka o ładunku dodatnim będąca składnikiem jądra atomowego; składa się z jednego kwarka dolnego i dwóch kwarków górnych.
liczba nukleonów, równa sumie liczby protonów i liczby neutronów.
składniki jądra atomowego; zaliczają się do nich protony i neutrony.
stan energetyczny atomu o najniższej możliwej energii.
stan energetyczny atomu wyższy niż podstawowy, tj. taki, w którym elektron przeszedł na wyższą orbitę i zyskał energię dzięki absorpcji promieniowania albo zderzenia z innym atomem.
Biogramy

Niels Bohr
[nyls boa] Duński fizyk, współtwórca mechaniki kwantowej. Brał dział w budowie pierwszej bomby atomowej w ramach projektu „Manhattan”.

Johannes Geiger
[johanes gajge] Niemiecki fizyk, który wspólnie z Walterem Müllerem opracował licznik promieniowania, nazwany na ich cześć licznikiem Geigera‑Müllera.

Ernest Marsden
[enest mazdyn] Jeden z czołowych nowozelandzkich fizyków. W czasie wojny światowej prowadził prace nad radarem.

Ernest Rutherford
[enest radefert] Brytyjski fizyk. Badał pierwiastki promieniotwórcze, odkrył, że źródłem promieniowania jest spontaniczny rozpad pierwiastków, za co otrzymał Nagrodę Nobla.
Joseph John Thomson
[dżołzef dżon tomsyn] Angielski fizyk, który otrzymał Nagrodę Nobla za badanie przewodnictwa elektrycznego gazów, co doprowadziło do odkrycia elektronu.
