Czym są reakcje strąceniowe?
Czym jest osad?
Wykonaj poniższy eksperyment i zastanów się jak zdefiniować osad.
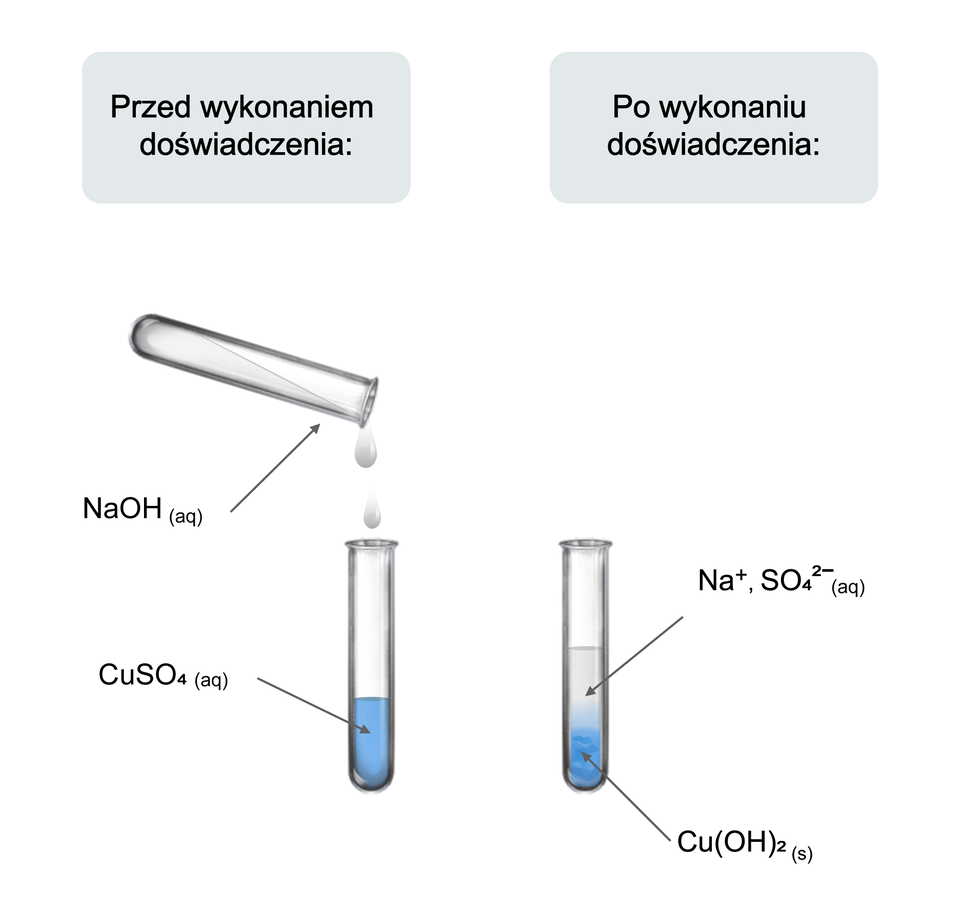
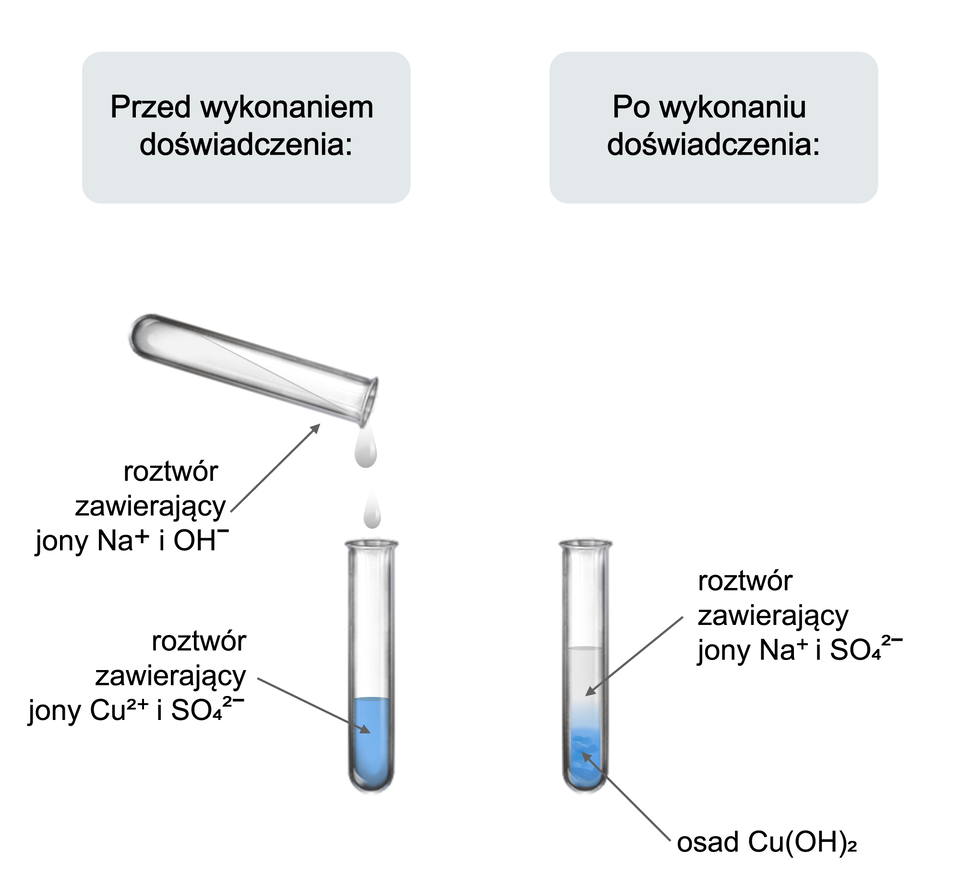
Sprawdź, czy po zmieszaniu wodnych roztworów wodorotlenku sodu i siarczanu miedzi zajdzie reakcja chemiczna
Przygotuj niezbędne odczynniki i przyrządy laboratoryjne. Wybierz hipotezę i zweryfikuj ją, przeprowadzając doświadczenie wg załączonej instrukcji. Jeśli nie masz możliwości samodzielnego przeprowadzenia doświadczenia, zapoznaj się ze schematycznymi rysunkami, obrazującymi jego przebieg. Napisz obserwacje oraz sformułuj odpowiedni wniosek.
Wykonano doświadczenie, w którym sprawdzono, czy po zmieszaniu wodnych roztworów wodorotlenku sodu i siarczanu miedzi, zostaną zaobserwowane objawy świadczące o zajściu reakcji chemicznej.
Problem badawczy:
Czy po zmieszaniu wodnych roztworów wodorotlenku sodu i siarczanu miedzi zajdzie reakcja chemiczna?
Hipoteza:
W wyniku zmieszania dwóch wodnych roztworów – wodorotlenku sodu i siarczanu miedzi – powstanie związek trudno rozpuszczalny (wytrąci się osad).
Co było potrzebne:
probówki;
statyw na probówki;
zlewki
łyżeczki
woda destylowana
wodorotlenek sodu
siarczan miedzi.
Przebieg doświadczenia:
. Do zlewki wlano wody destylowanej i wsypano pół łyżeczki wodorotlenku sodu. Całość mieszano do otrzymania klarownego roztworu.
. W drugiej zlewce powtórzono procedurę z punktu 1 dla siarczanu miedzi.
. Do probówki wlano wodnego roztworu siarczanu miedzi.
. Dodano do niego podobną objętość wodnego roztworu wodorotlenku sodu.
. Obserwano zachodzące zmiany.
Obserwacje:
Wytrąca się niebieski (galaretowaty) osad.
Wnioski:
Wodorotlenek sodu reaguje w roztworze wodnym z siarczanem miedzi, a w wyniku zachodzącej reakcji powstaje substancja trudno rozpuszczalna w wodzie.
Napisz obserwacje i wniosek do przeprowadzonego doświadczenia.
Na podstawie odnotowanych obserwacji można wnioskować, że po zmieszaniu wodnych roztworów wodorotlenku sodu i siarczanu miedzi, pomiędzy obiema substancjami zaszła reakcja chemiczna, w wyniku której wytrącił się osad.
Osadem możemy w uproszczeniu nazwać substancję stałą, która w podanych warunkach temperatury (i ciśnienia) praktycznie nie rozpuszcza się w środowisku, w którym się znajduje, np. w wodzie. Osady powstają zarówno w wyniku przemian fizycznych, jak i na skutek reakcji chemicznych.
Wytrącanie osadu w reakcji soli z wodorotlenkiem
W powyższym eksperymencie osad wytrącił się na skutek reakcji chemicznych. Jaka substancja w tym przypadku stanowi osad?
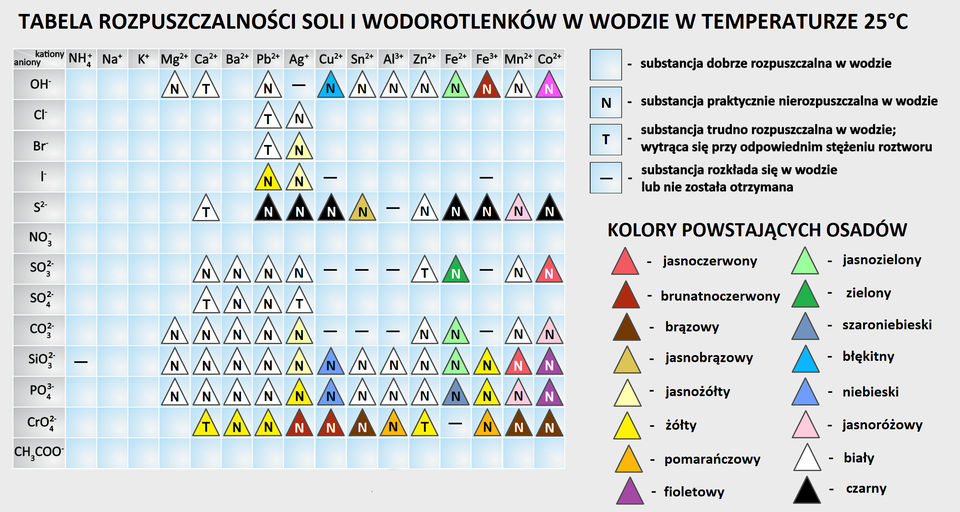
Wykorzystując tablicę rozpuszczalności, sprawdźmy rozpuszczalność wszystkich reagentów w wodzie.
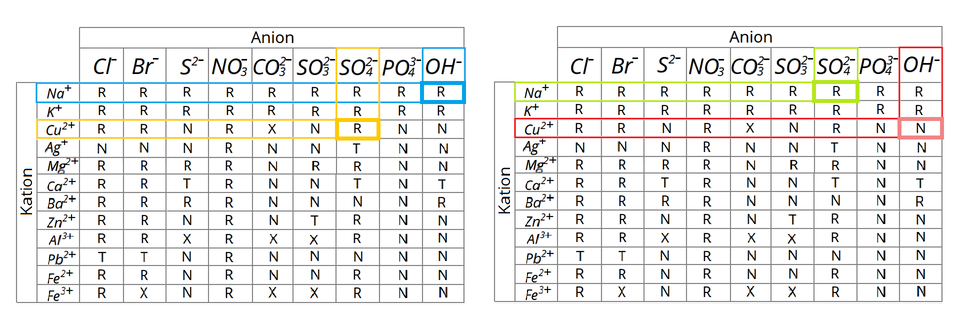
Substraty analizowanej reakcji chemicznej, a więc wodorotlenek sodu i siarczan() miedzi(), to substancje dobrze rozpuszczalne w wodzie, podobnie jak siarczan() sodu, czyli sól będąca produktem tej reakcji. Drugi z produktów rozważanej reakcji – wodorotlenek miedzi() – jest praktycznie nierozpuszczalny w wodzie i to on wytrącił się z roztworu w postaci niebieskiego (galaretowatego) osadu.
Pamiętając, że sole i wodorotlenki dobrze rozpuszczalne w wodzie ulegają w niej dysocjacji elektrolitycznej, możemy zapisać równanie reakcji chemicznej zachodzącej podczas doświadczenia w formie jonowej (zapis pełny):
oraz stosując tzw. zapis jonowy skrócony:
Po uwzględnieniu rozpuszczalności wszystkich reagentów w analizowanym doświadczeniu oraz procesu dysocjacji elektrolitycznej soli i wodorotlenków, schemat obrazujący przebieg tego doświadczenia możemy opisać:
Reakcję przebiegającą z wytrąceniem osadu w roztworze wodnym między solą a wodorotlenkiem, możemy przedstawić jako:
Drugi z produktów opisanej reakcji chemicznej (sól 2) również może być substancją trudno rozpuszczalną w wodzie, lecz zwykle reagenty dobiera się tak, aby tylko jeden z produktów był trudno rozpuszczalny.
Reakcje soli z solami
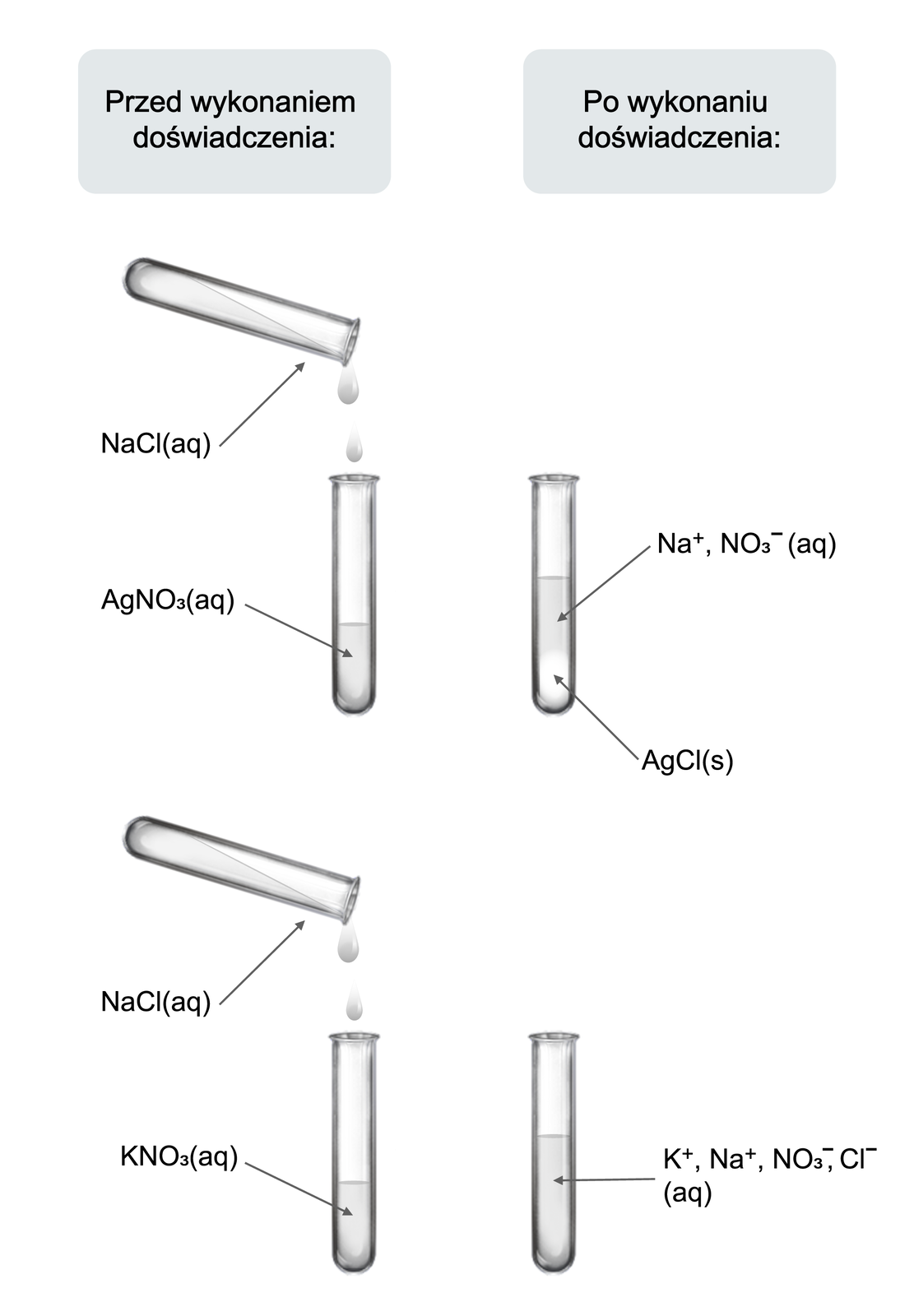
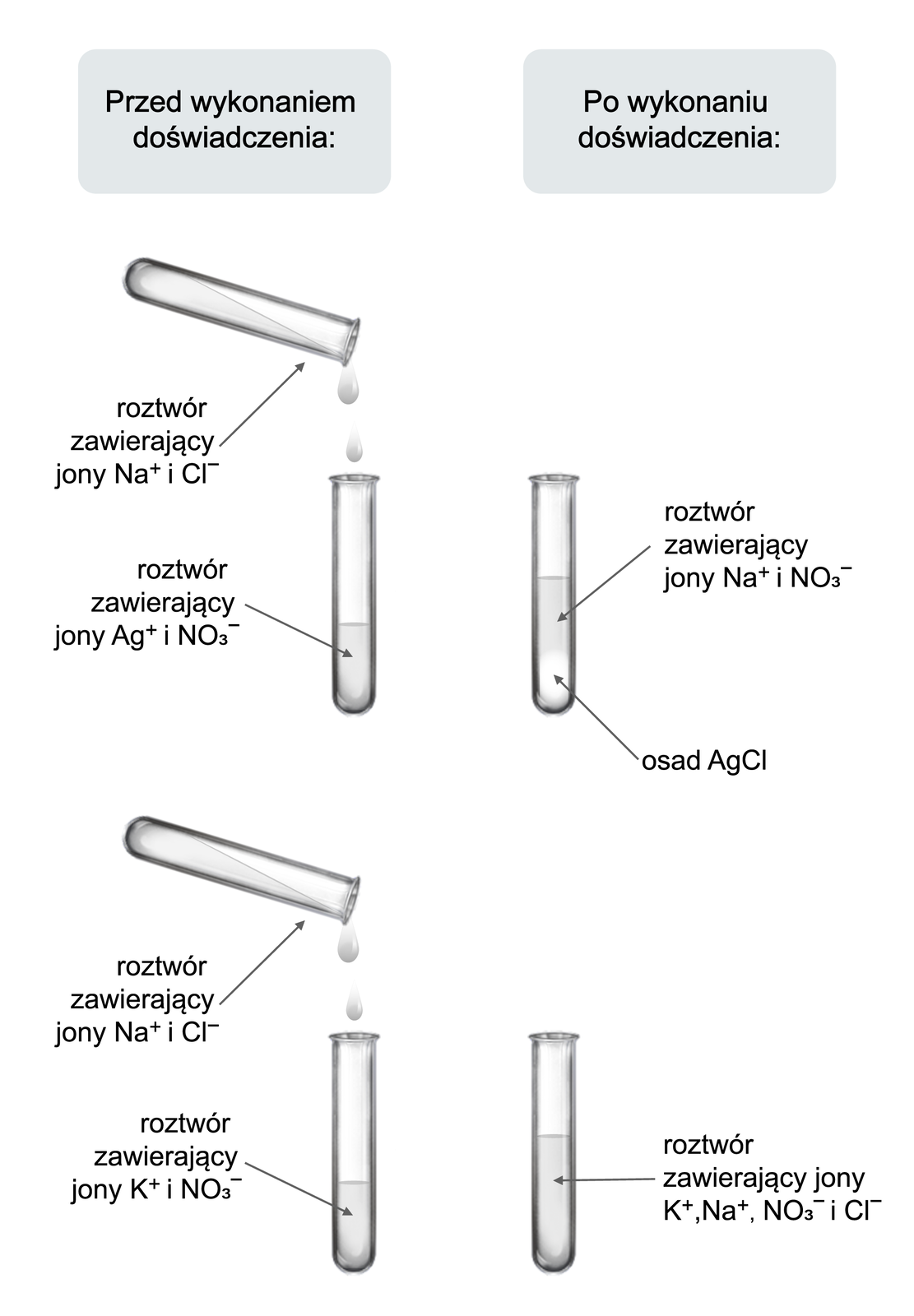
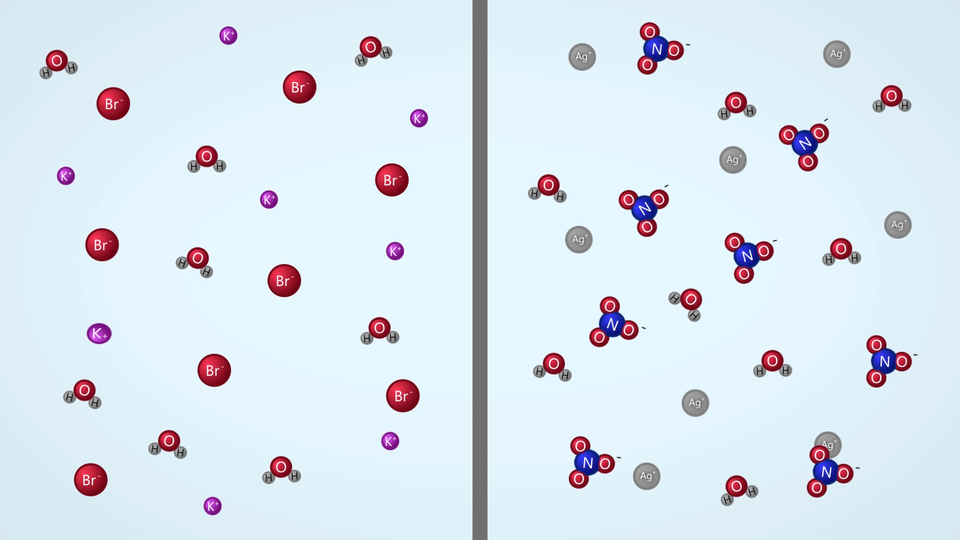
Sprawdź, czy po zmieszaniu wodnych roztworów chlorku sodu i azotanu potasu oraz chlorku sodu i azotanu srebra.
Przygotuj niezbędne odczynniki i przyrządy laboratoryjne. Wybierz hipotezę i zweryfikuj ją przeprowadzając doświadczenie wg załączonej instrukcji. Jeśli nie masz możliwości samodzielnego przeprowadzenia doświadczenia, zapoznaj się ze schematycznymi rysunkami, obrazującymi jego przebieg. Napisz obserwacje oraz sformułuj odpowiedni wniosek.
Przeprowadzono doświadczenie, w którym sprawdzono, czy po zmieszaniu wodnych roztworów chlorku sodu i azotanu potasu oraz chlorku sodu i azotanu srebra, zostaną zaobserwowane objawy reakcji chemicznych.
Problem badawczy:
Czy chlorek sodu reaguje w roztworze wodnym z solami: azotanem potasu i azotanem srebra?
Hipoteza:
Chlorek sodu w roztworze wodnym reaguje tylko z azotanem srebra.
Co było potrzebne:
probówki;
statyw na probówki;
zlewki
łyżeczki
woda destylowana
chlorek sodu
azotan potas
azotanu srebra.
Przebieg doświadczenia:
. Do zlewki wlano wody destylowanej i wsypano pół łyżeczki chlorku sodu. Całość mieszano do otrzymania klarownego roztowru.
. Punkt 1 powtórzono dla azotanu potasu i azotanu srebra.
. Do dwóch probówek wlano takie same objętości (po około ) wodnych roztworów soli: do pierwszej azotanu srebra, a do drugiej azotanu potasu.
. Do każdej z probówek dodawano kroplami jednakową objętość (około ) wodnego roztworu chlorku sodu.
. Obserwowano zachodzące zmiany.
Obserwacje:
W pierwszej z probówek (zawierającej wodny roztwór azotanu srebra) wytrąca się biały osad, a roztwór nad osadem jest bezbarwny. W drugiej (zawierającej wodny roztwór azotanu potasu) nie zaobserwowano objawów świadczących o przebiegu reakcji chemicznej.
Wniosek:
Chlorek sodu reaguje w roztworze wodnym z azotanem srebra, ale nie reaguje z azotanem potasu.
Napisz obserwacje i wniosek do przeprowadzonego doświadczenia.
Na podstawie odnotowanych obserwacji można wnioskować, że po zmieszaniu wodnych roztworów chlorku sodu i azotanu srebra, pomiędzy obiema solami zaszła reakcja chemiczna, w wyniku której otrzymano trudno rozpuszczalną w wodzie substancję. Co to za substancja? Na podstawie charakterystycznego dla chemii nieorganicznej podziału reakcji chemicznych możemy stwierdzić, że pomiędzy wspomnianymi solami, w roztworze wodnym, zachodziła reakcja wymiany (podwójnej), której przebieg możemy opisać za pomocą równania:
Aby sprawdzić, który z reagentów jest substancją trudno rozpuszczalną w wodzie, musimy skorzystać z tablicy rozpuszczalności soli i wodorotlenków. Sprawdźmy rozpuszczalność wszystkich reagentów opisanej reakcji chemicznej w wodzie:
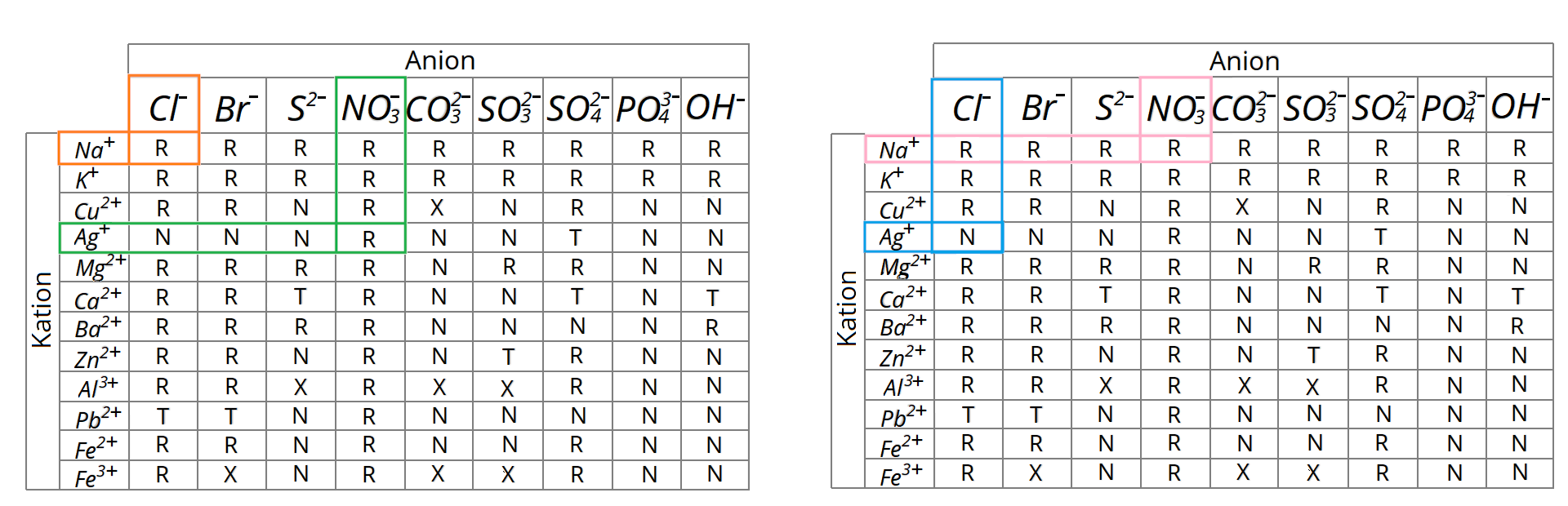
Na podstawie tablicy rozpuszczalności wnioskujemy, że obydwie użyte w doświadczeniu sole (chlorek sodu i azotan srebra) są dobrze rozpuszczalne w wodzie. Z kolei jeden z produktów opisanej reakcji chemicznej, chlorek srebra, jest substancją praktycznie nierozpuszczalną w wodzie. To właśnie ta sól, wchodzi w skład otrzymanego w doświadczeniu osadu (w równaniu reakcji możemy ten fakt zaznaczyć, zapisując za wzorem trudno rozpuszczalnej soli strzałkę skierowaną w dół). Drugi z produktów, azotan sodu to sól dobrze rozpuszczalna w wodzie, zatem znajduje się ona w roztworze nad osadem.
Sole dobrze rozpuszczalne w wodzie, ulegają pod wpływem działania jej cząsteczek, procesowi dysocjacji elektrolitycznej. Podając zapis jonowy pełny równań reakcji chemicznych sole te rozbijamy na jony. Z kolei soli praktycznie nierozpuszczalnych w wodzie, w zapisie jonowym, nie rozbijamy na jony. Analizowane równanie reakcji w zapisie jonowym pełnym, będzie miało zatem postać:
Ponieważ równanie reakcji to najprostszy matematyczny zapis przebiegu reakcji chemicznej możemy uprościć (skrócić) wyrazy podobne, a więc jony znajdujące się po obydwu stronach zapisanego równania:
W ten sposób otrzymamy tzw. zapis jonowy skrócony równania reakcji:
z którego możemy wnioskować, że w rzeczywistości w reakcji chemicznej wzięły udział jedynie jony, które po połączeniu się utworzyły osad.
Po zmieszaniu wodnych roztworów chlorku sodu i azotanu() potasu nie zaobserwujemy objawów reakcji chemicznej, np. pojawienia się osadu, tak jak to miało miejsce w omówionym wyżej przykładzie. Możemy zatem wnioskować, że reakcja chemiczna pomiędzy tymi dwiema solami nie zachodzi. Dlaczego? Zapiszmy w formie cząsteczkowej, równanie hipotetycznej reakcji chemicznej (reakcji wymiany), która mogłaby przebiegać pomiędzy analizowanymi solami w roztworze wodnym:
Wykorzystując tablicę rozpuszczalności, sprawdźmy rozpuszczalność substratów i produktów tej hipotetycznej reakcji w wodzie.
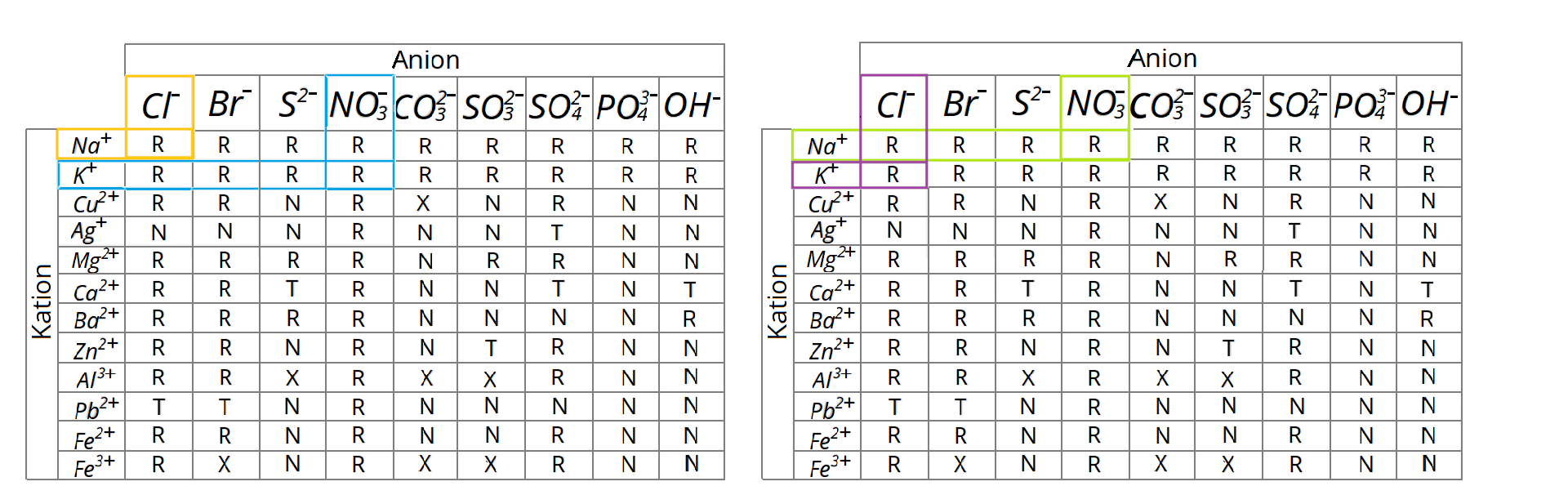
Okazuje się, że w tym przypadku wszystkie reagenty są w wodzie dobrze rozpuszczalne, a więc ulegają procesowi dysocjacji elektrolitycznej. W zapisie jonowym (pełnym) musielibyśmy zatem wszystkie sole rozbić na jony:
Po uproszczeniu wyrazów podobnych:
okaże się, że wszystkie jony w zapisanym równaniu trzeba skrócić, więc analizowana reakcja w roztworze wodnym nie zachodzi. Po zmieszaniu wodnych roztworów chlorku sodu i azotanu potasu otrzymamy roztwór, w którym znajdują się jony pochodzące z dysocjacji elektrolitycznej obydwu soli.
Uwzględniając rozpuszczalność wszystkich reagentów w analizowanym doświadczeniu oraz proces dysocjacji elektrolitycznej soli, możemy doprecyzować schemat obrazujący przebieg tego doświadczenia:
Reakcję, w trakcie której po zmieszaniu ze sobą roztworów dwóch rozpuszczalnych substancji powstaje trudno rozpuszczalny związek chemiczny, nazywa się reakcją strącania osadu (reakcją strąceniową). Jej istotą jest reakcja pomiędzy niektórymi jonami, powstałymi z dysocjacji elektrolitycznej mieszanych ze sobą substancji. Reakcje strącania osadów są reakcjami wymiany podwójnej. Substraty użyte w reakcji strąceniowej muszą być dobrze rozpuszczalne w wodzie, a przynajmniej jeden z produktów reakcji musi być substancją w wodzie praktycznie nierozpuszczalną. Jeżeli reakcja strąceniowa przebiega w roztworze wodnym pomiędzy dwiema solami, to jej schemat możemy przedstawić jako:
Przy czym druga z soli, będąca produktem opisanej reakcji chemicznej (sól ), również może wytrącić się z roztworu w postaci osadu (z praktycznego punktu widzenia, otrzymywanie soli trudno rozpuszczalnych w wodzie, podczas gdy w wyniku zachodzącej reakcji powstają dwa osady, nie jest wykorzystywane – otrzymane osady trudno bowiem rozdzielić).
Reakcja strąceniowa sól‑kwas
Przykładem reakcji strąceniowej sól‑kwas może być wytrącenie chlorku srebra w reakcji azotanu(V) srebra(I) z kwasem chlorowodorowym.
Zarówno kwas chlorowodorowy, azotan(V) srebra, jak i kwas azotowy(V) są rozpuszczalne w wodzie. Po zapisaniu równania reakcji w formie jonowej można usunąć jony towarzyszące, a następnie napisać równanie w formie jonowej skróconej, z którego wynika, że aniony chlorkowe reagują z kationami srebra, w wyniku czego powstaje nierozpuszczalny osad chlorku srebra.
Pewną reakcję chemiczną przedstawiono w sposób jonowy skrócony:
Analizując tablicę rozpuszczalności soli i wodorotlenków, zaproponuj dwa odczynniki chemiczne, których roztwory wodne należy zmieszać w celu otrzymania tego produktu.
Do brązowego roztworu zawierającego chlorek żelaza(III) dodano roztworu chromianu(VI) potasu. Napisz, co możesz zaobserwować. Zapisz równania cząsteczkowe oraz jonowe (pełne i skrócone) zachodzącej reakcji chemicznej.
Na podstawie poniższej animacji oraz przedstawionych wcześniej informacji, zaproponuj za pomoca jakich odczyniików można wytrącić osad siarczanu(VI) ołowiu(II).
Film dostępny pod adresem /preview/resource/RyTYHYmsM6BOi
Film nawiązujący do treści materiału dotyczącej korzystania z tabeli rozpuszczalności.
Korzystając z tabeli rozpuszczalności, zaznacz, które związki są praktycznie nierozpuszczalne w wodzie.

Mając do dyspozycji wodny roztwór amoniaku, roztwór chlorku żelaza(III), siarczek żelaza(III) i wodorotlenek niklu, zaproponuj metodę otrzymania wodorotlenku żelaza(III). Co zaobserwujesz w trakcie reakcji? Zapisz równanie cząsteczkowe, jonowe pełne oraz skrócone.
Podsumowanie
W celu podsumowania zdobytych wiadomości i umiejętności obejrzyj poniższy film, a następnie sporządź krótką notatkę wyjaśniającą na czym polegają reakcje strąceniowe. Pisząc notatkę nie używaj wzorów substancji ani równań reakcji.

Film dostępny pod adresem /preview/resource/R1MCrklLOWb2a
Film opowiada o zapisywaniu równań reakcji chemicznych, w których powstają osady.