O chmurze elektronowej w sposób bardziej zaawansowany (dla bardziej dociekliwych)
Konfiguracje elektronoweKonfiguracje elektronowe atomów możemy zapisać na różne sposoby. Do najbardziej podstawowych należy zapis graficzny oraz zapis powłokowy, o których już była mowa. Na przykład konfigurację elektronową atomu sodu możemy zapisać następująco:
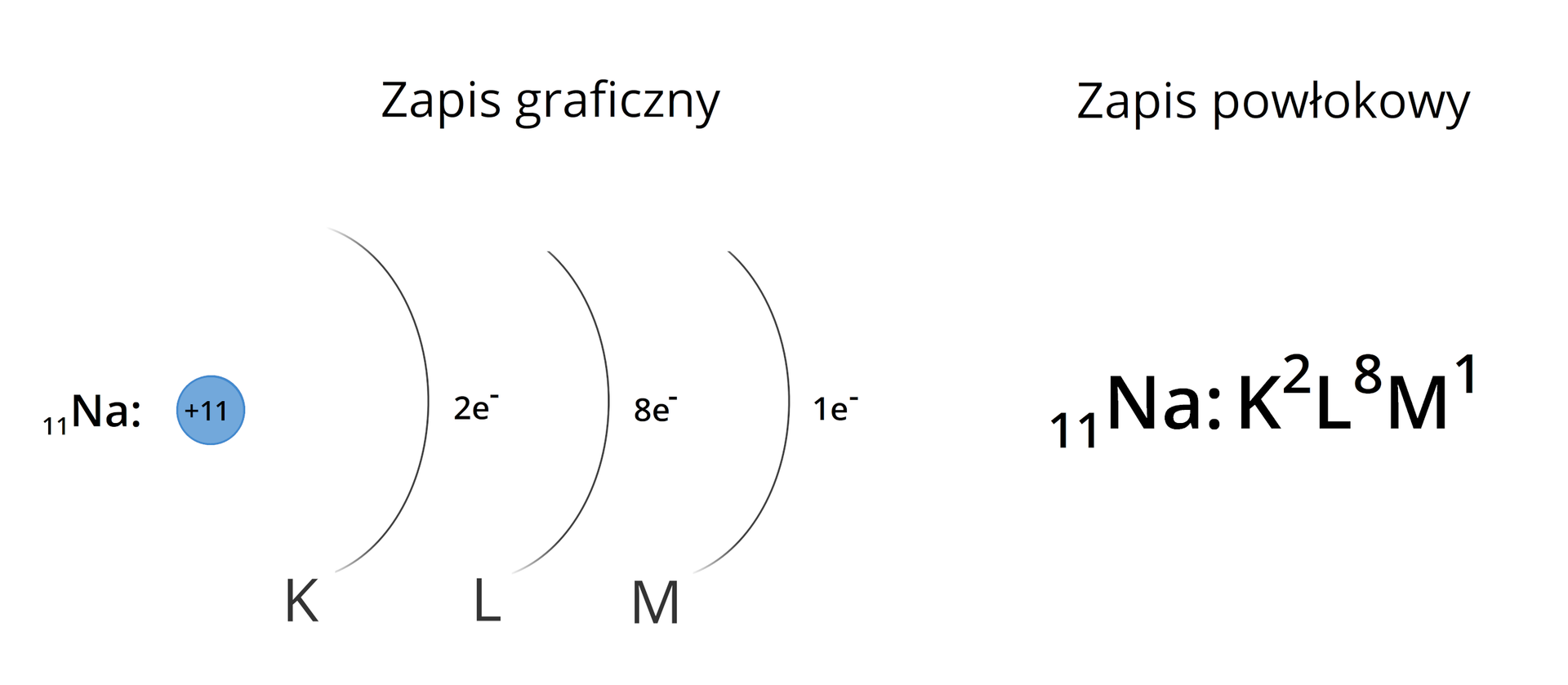
Zapisy te pokazują wyłącznie, ile elektronów mieści się na konkretnej powłoce elektronowej, a nie sposób, w jaki są one na niej rozmieszczone. Musimy bowiem pamiętać, że w obrębie powłok istnieją również podpowłoki, a w obrębie podpowłok – przestrzenie orbitalne, zwane poziomami orbitalnymi. Dlatego wprowadzony został podpowłokowy zapis konfiguracji elektronowej atomów, aby uwzględnić rodzaje podpowłok oraz orbitalny (klatkowy) zapis konfiguracji elektronowej. Dzięki temu możemy określić sposób rozmieszczenia elektronów na poszczególnych poziomach orbitalnych. Poniższe rozważania opierają się na konfiguracjach elektronowych atomów w stanie podstawowym, czyli o najmniejszej możliwej energii.
Ile elektronów mogą pomieścić powłoki elektronowe?
Maksymalną liczbę elektronów na danej powłoce możemy obliczyć ze wzoru , gdzie n oznacza numer powłoki. Na przykład powłokę pierwszą mogą zajmować maksymalnie elektrony, gdyż . Powłokę drugą może z kolei zajmować maksymalnie elektronów, gdyż , a powłokę trzecią – maksymalnie elektronów, gdyż .
Wskaż maksymalną liczbę elektronów w obrębie powłoki piątej.
Czym jest podpowłoka?
Podpowłoki to pewne poziomy energetyczne w obrębie danej powłoki. Każda z nich zawiera inną liczbę podpowłok, równą n (gdzie n to numer powłoki). Zatem pierwsza, oznaczona symbolem K (), zawiera jedną podpowłokę. Powłoka L () zawiera z kolei dwie podpowłoki, powłoka M () – trzy podpowłoki itd. Poszczególnym typom podpowłok przypisujemy symbole literowe: s, p, d oraz f.
Aby określić konkretną podpowłokę, stosuje się zapis składający się z numeru powłoki (, , ,…) oraz symbolu podpowłoki (s, p, d, f). Na przykład zapis oznacza podpowłokę p powłoki trzeciej, a zapis oznacza podpowłokę s powłoki pierwszej.
W obrębie podpowłok istnieją również przestrzenie (poziomy) orbitalne, stanowiące najmniejszy fragment przestrzeni wokół jądra atomowego, gdzie prawdopodobieństwo znalezienia elektronu jest największe. Poziomy te czasami nazywa się orbitalami. Jednak to określenie nie jest do końca poprawne. Przestrzenie orbitalne nie mają wyraźnych granic, gdyż dopiero w odległości nieskończenie wielkiej od jądra atomowego prawdopodobieństwo znalezienia elektronu wynosi zero. Jednak dla ułatwienia, wprowadzone zostały pewne kontury poziomów orbitalnych, na zewnątrz których prawdopodobieństwo znalezienia elektronu jest nikłe.
W podpowłoce typu s kształt przestrzeni orbitalnej odpowiada sferze.
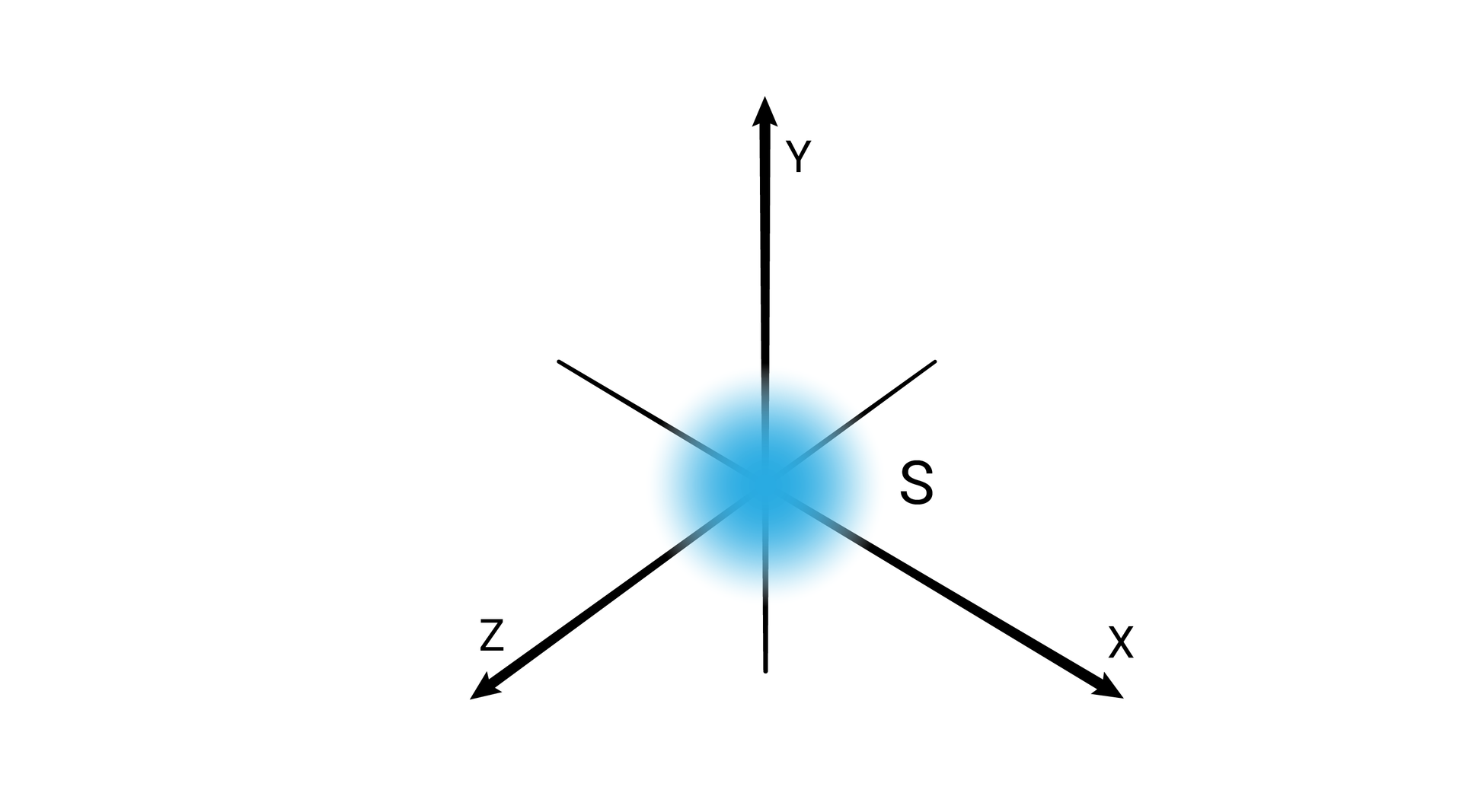
Poziomy orbitalne typu s różnią się od siebie wielkością. Poziom orbitalny ma mniejszy promień niż poziom orbitalny , a ten mniejszy od poziomu orbitalnego itd.
W podpowłoce typu p istnieją trzy poziomy orbitalne, różniące się orientacją przestrzenną.
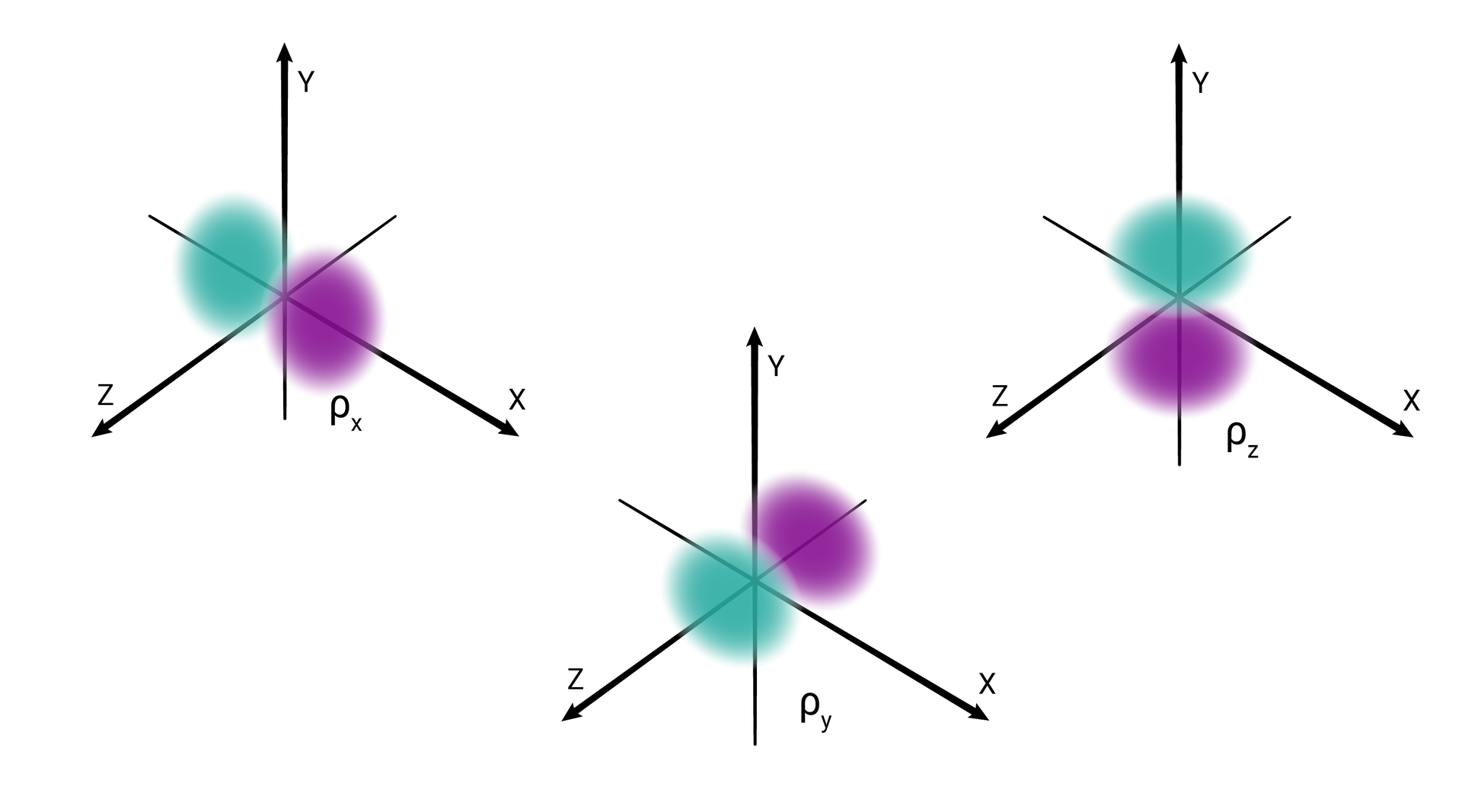
Przestrzenie orbitalne w podpowłoce p oznacza się symbolami: , oraz .
W podpowłoce typu d istnieje pięć poziomów orbitalnych, różniących się orientacją przestrzenną oraz kształtem.*
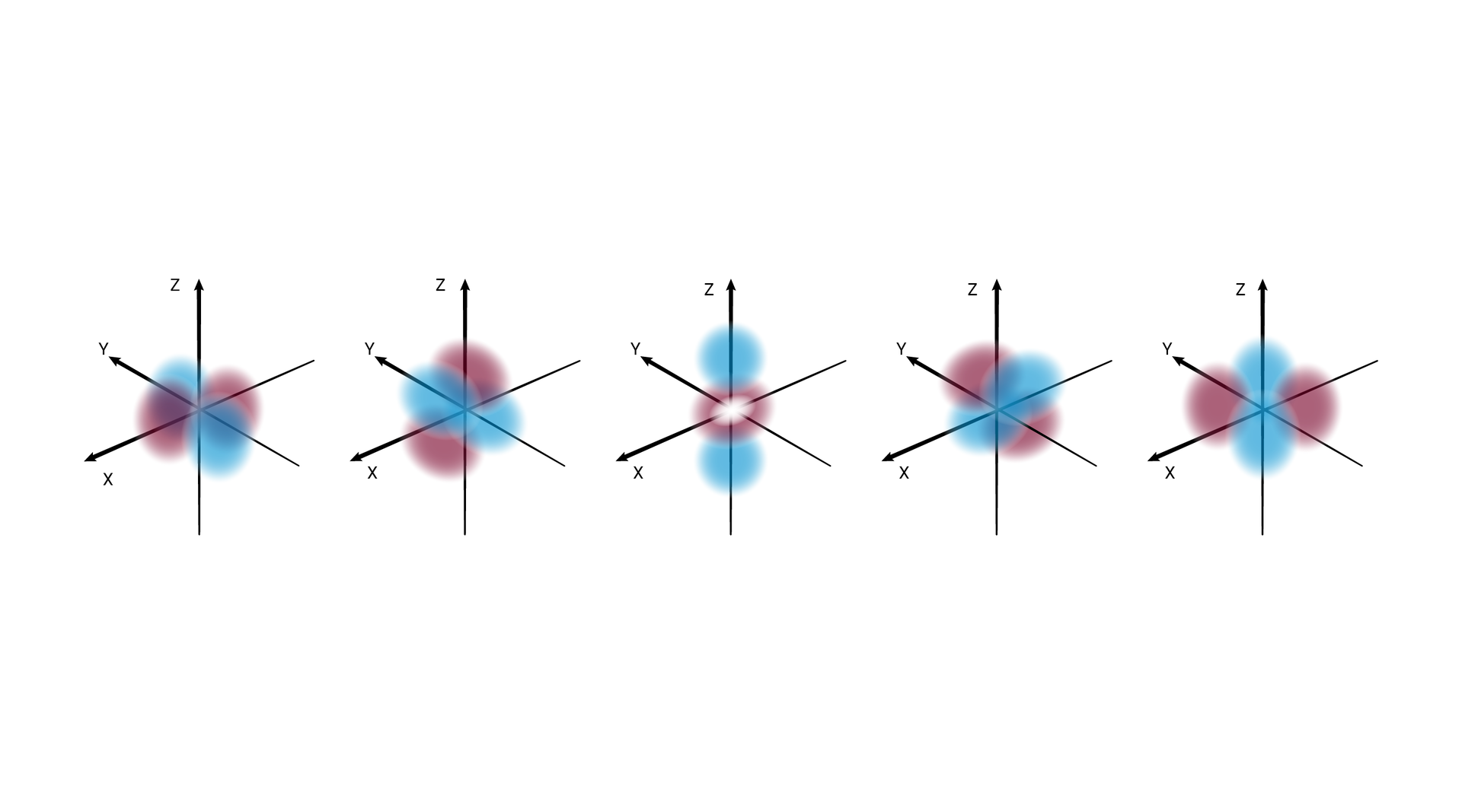
W podpowłoce typu f istnieje siedem poziomów orbitalnych, różniących się orientacją przestrzenną oraz kształtem.*
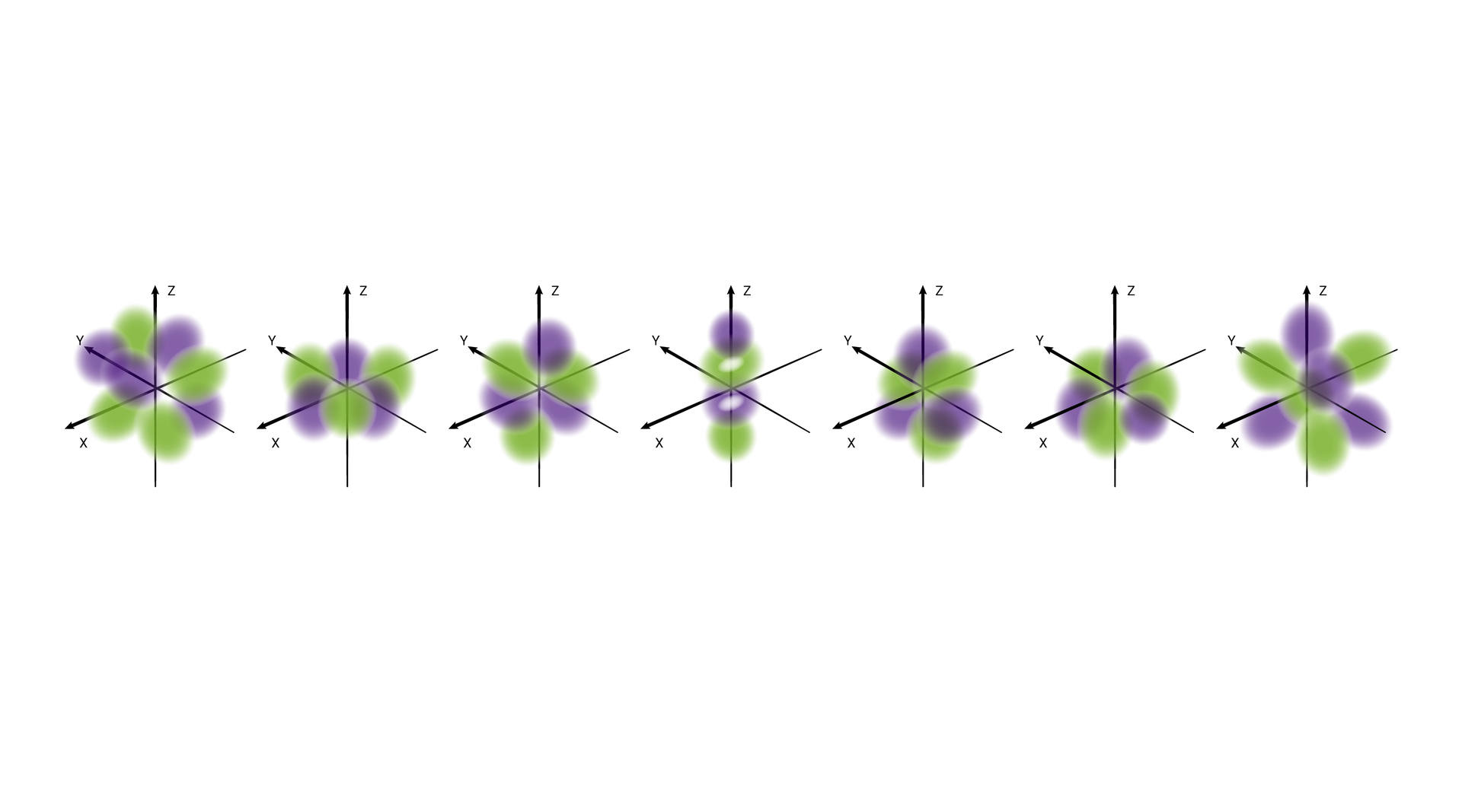
O poziomach orbitalnych w obrębie podpowłoki d oraz f będziesz się uczyć w dalszych etapach nauki.
Podsumujmy zatem powyższe informacje w tabeli.
Numer powłoki | Symbol powłoki | Maksymalna liczba elektronów w obrębie powłoki | Liczba podpowłok | Typy przestrzeni orbitalnych | |||||
|---|---|---|---|---|---|---|---|---|---|
s | p | d | f | ||||||
K | 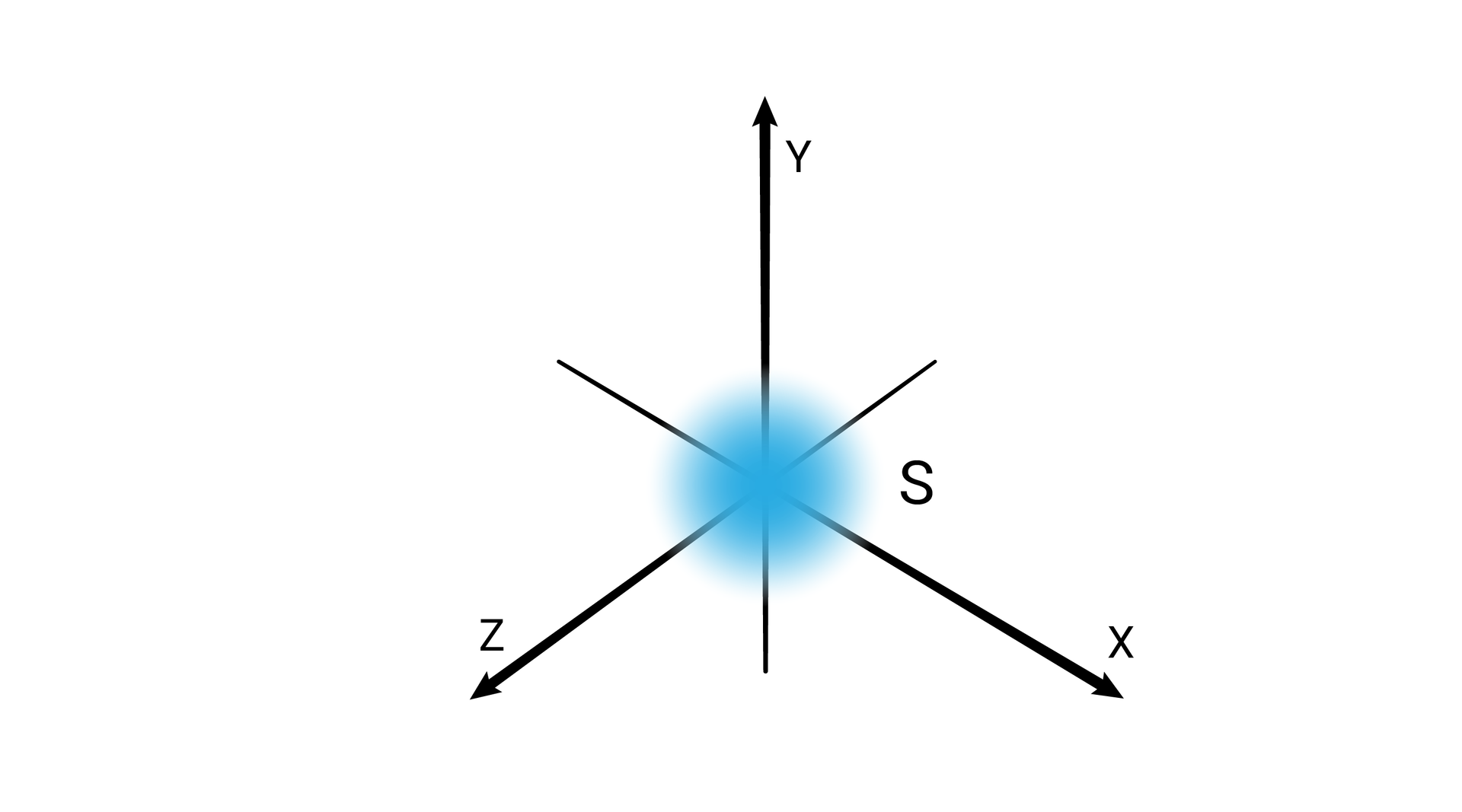 Orbital s Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | ||||||||
L | 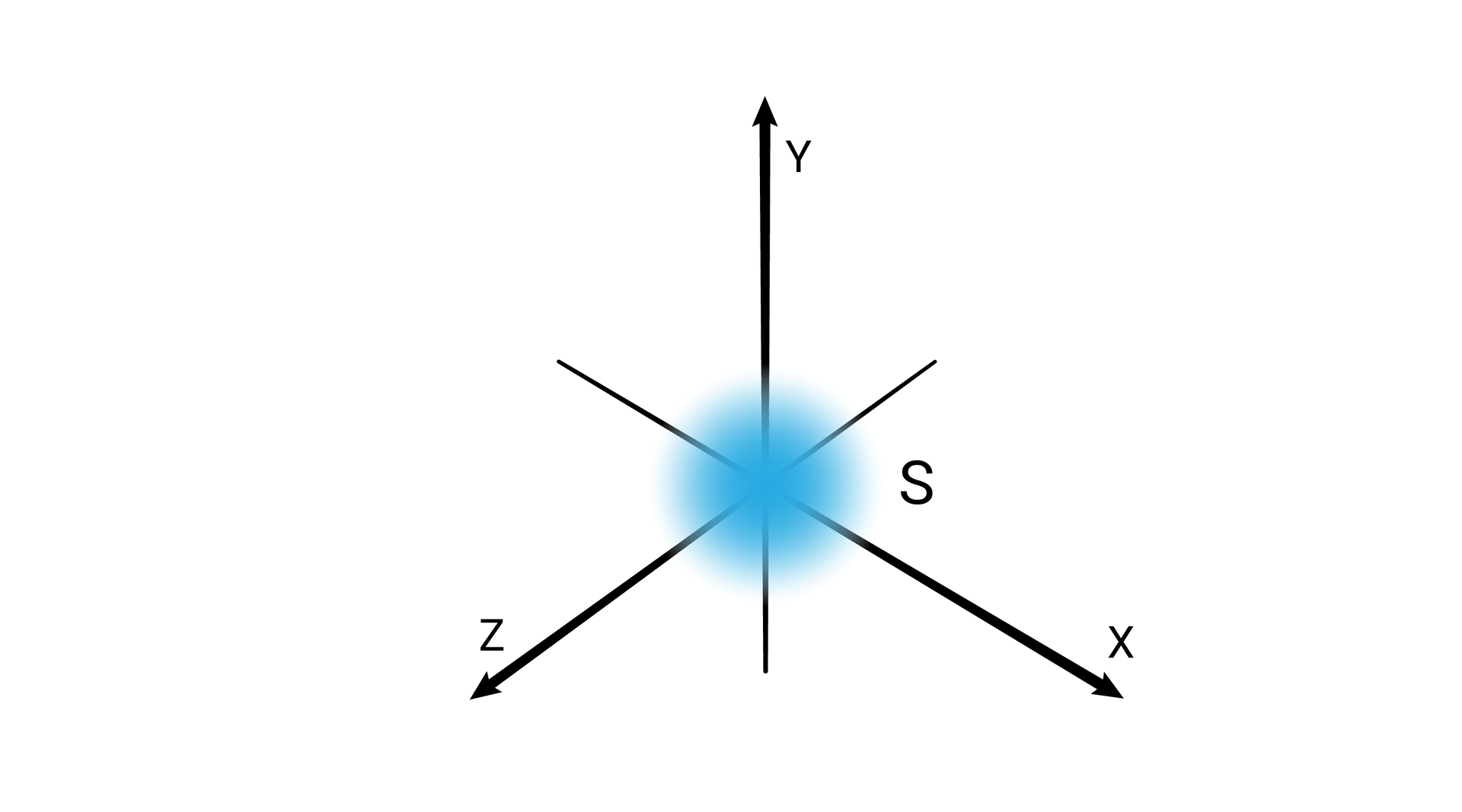 Orbital s Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 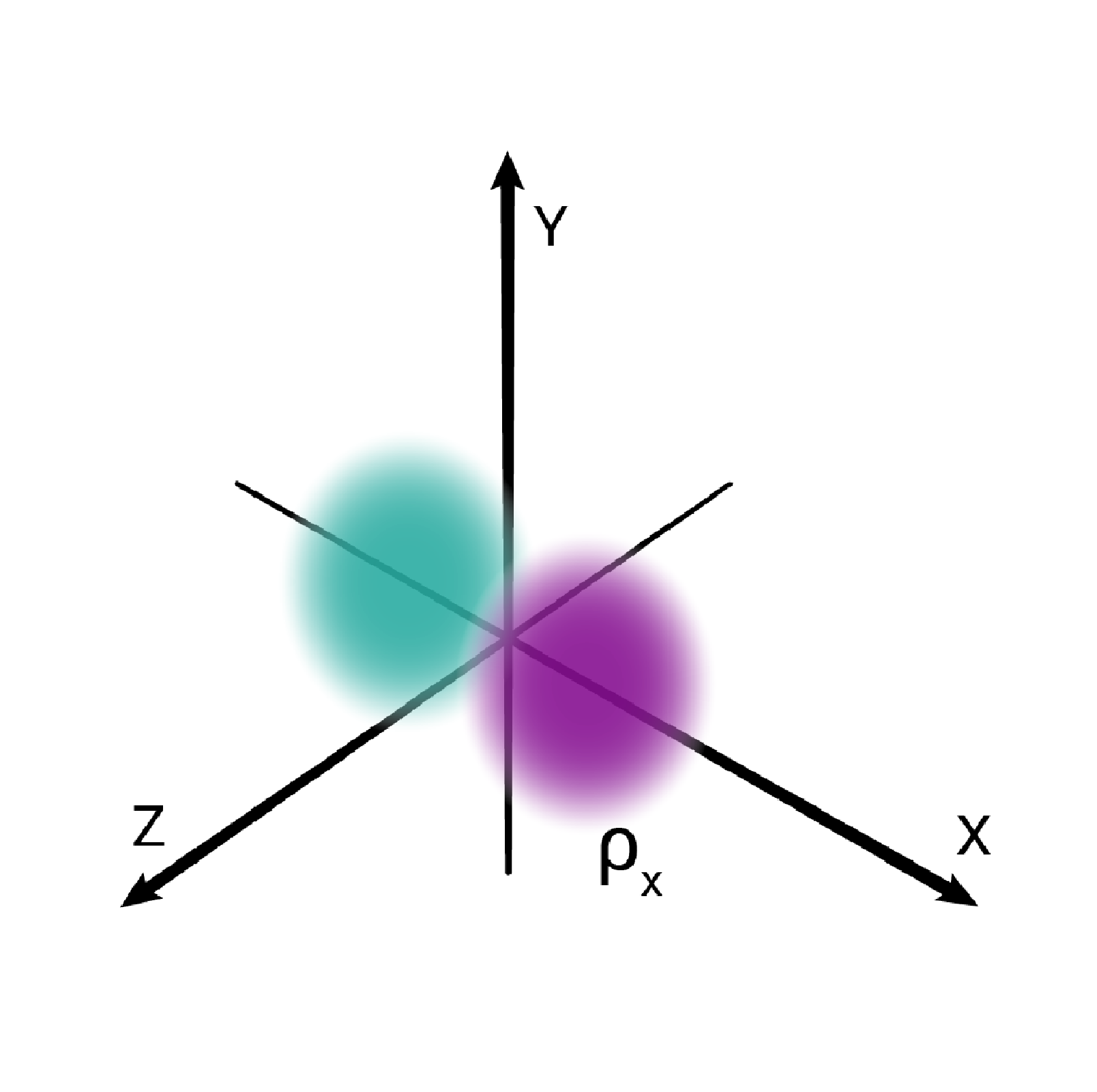 Orbital p Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 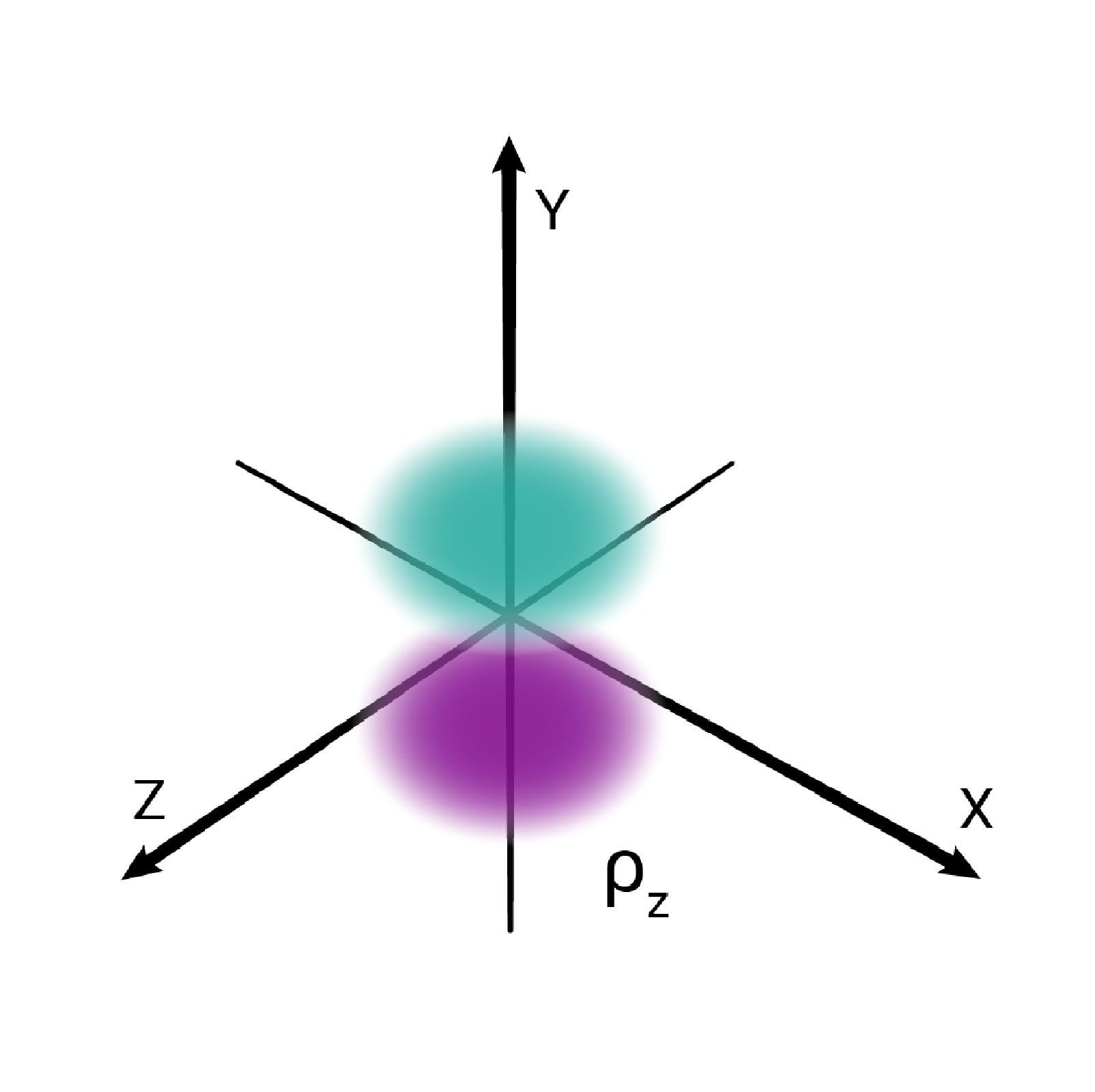 Orbital p Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 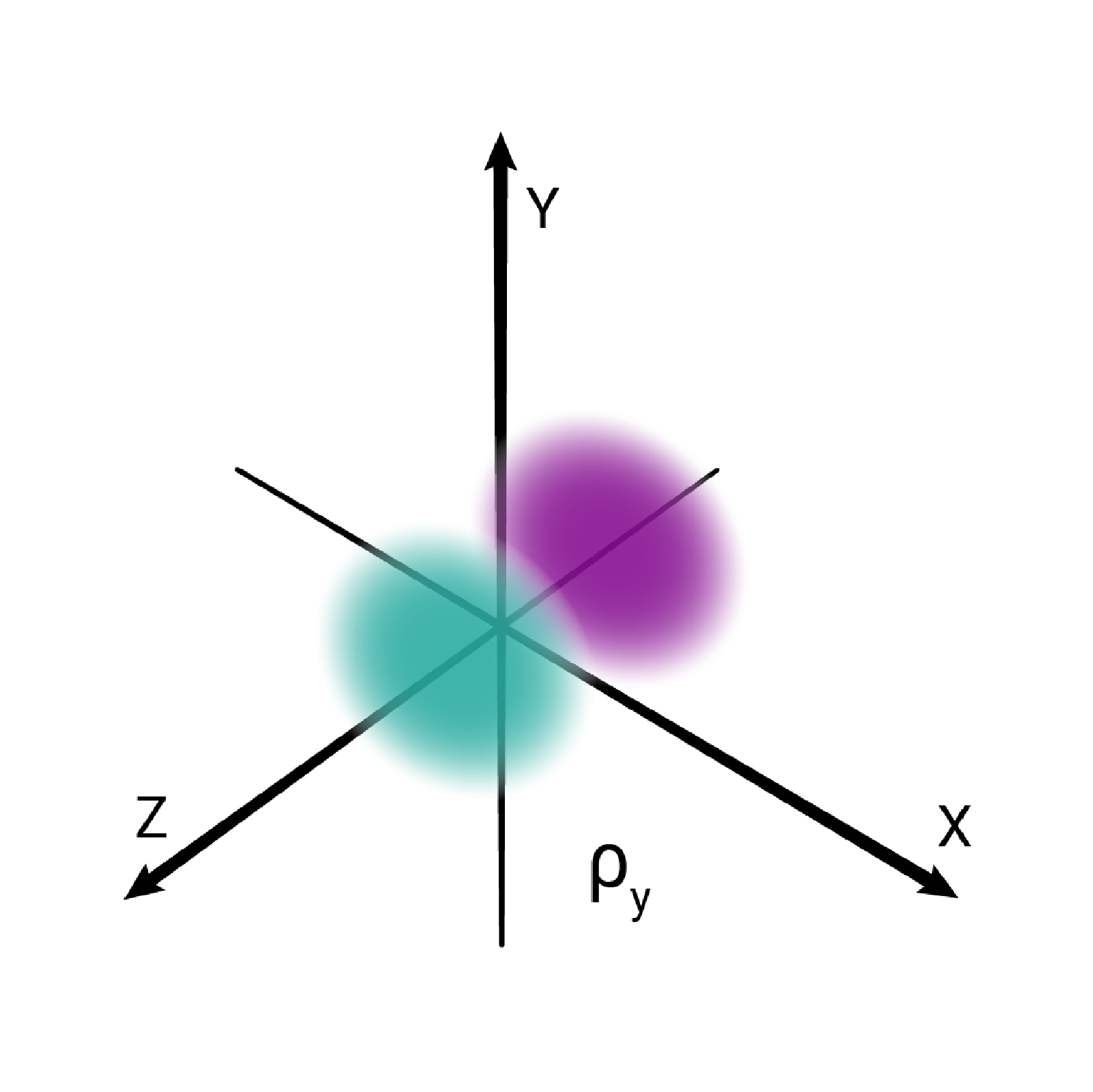 Orbital p Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | |||||
M | 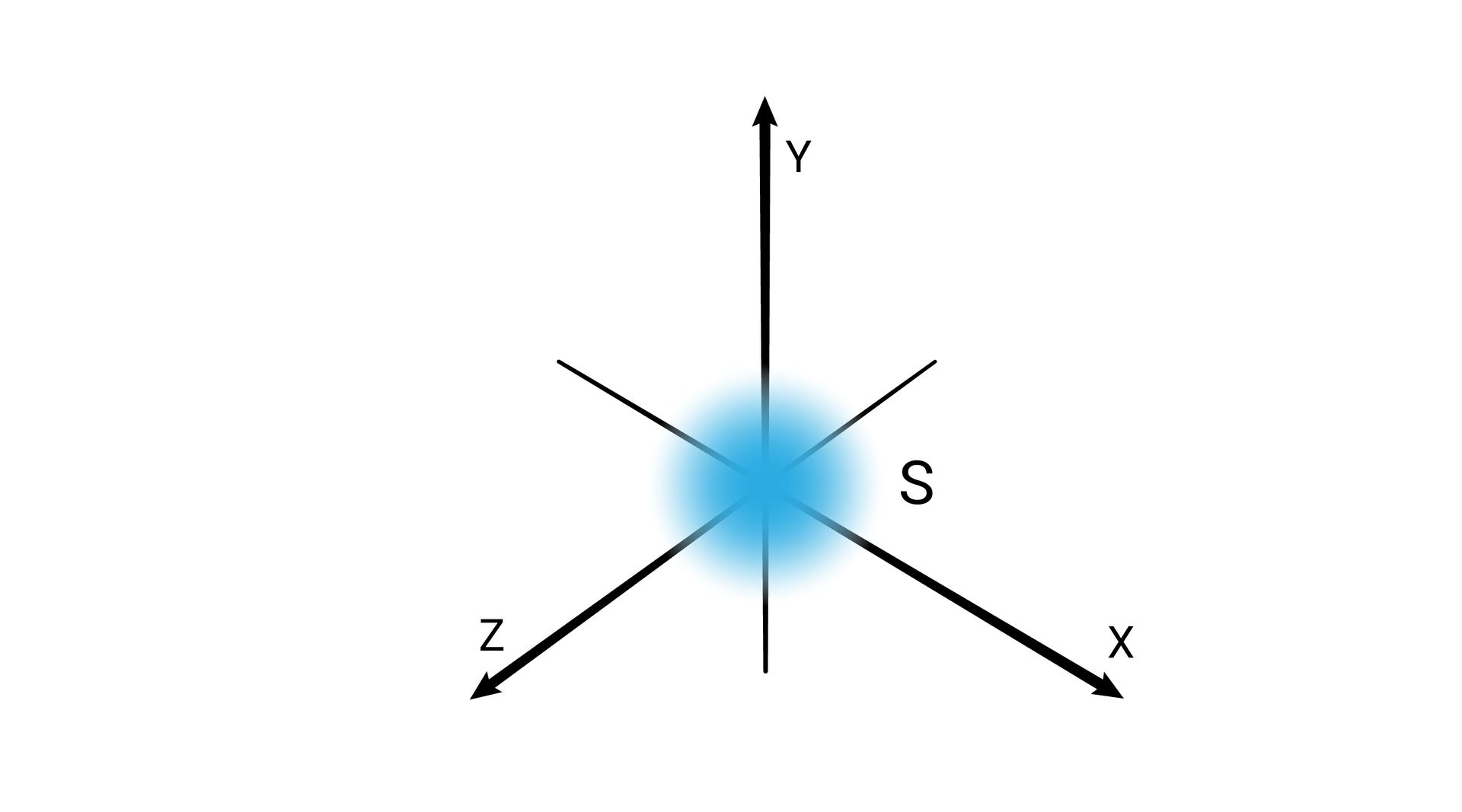 Orbital s Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 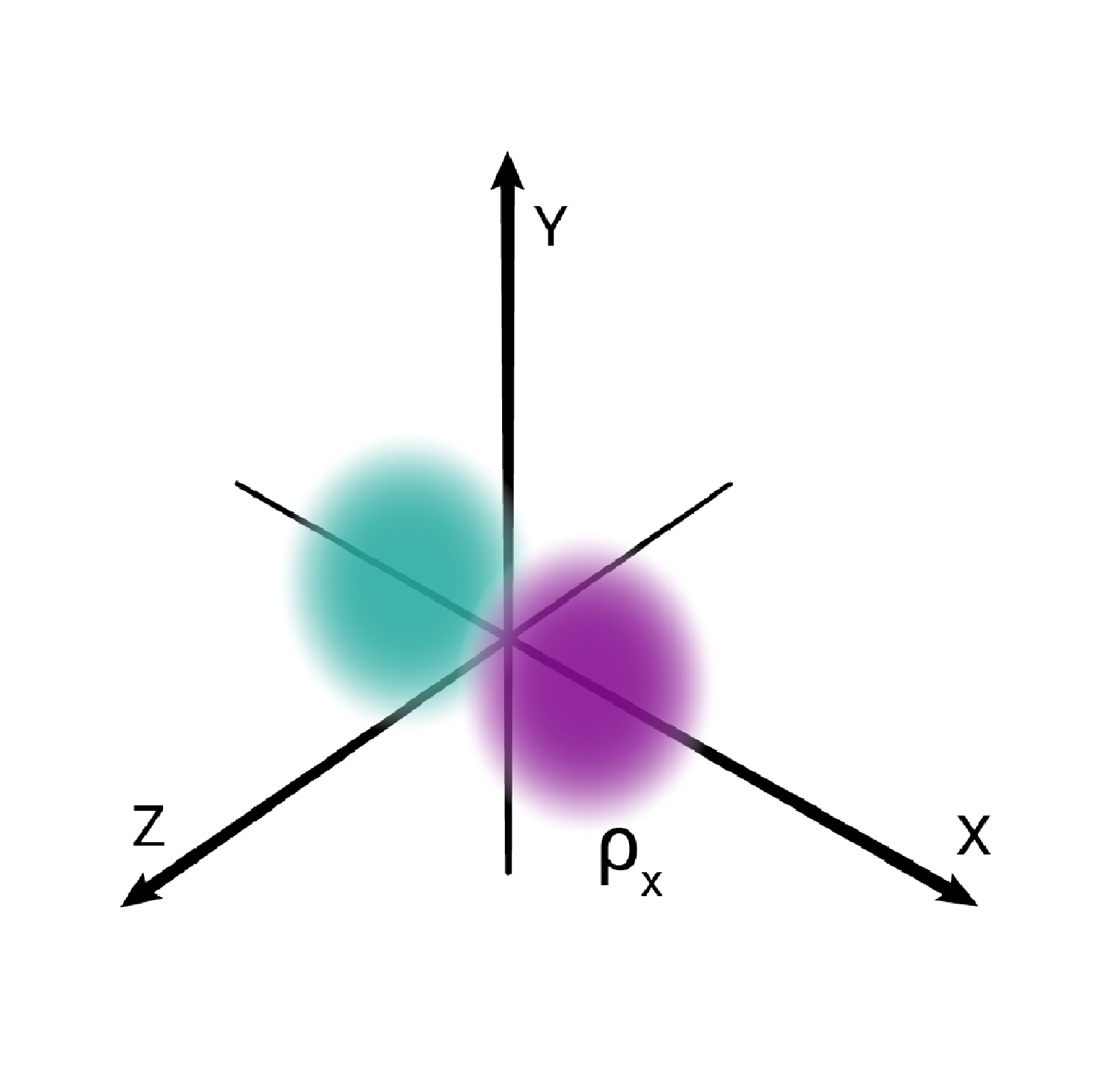 Orbital p Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 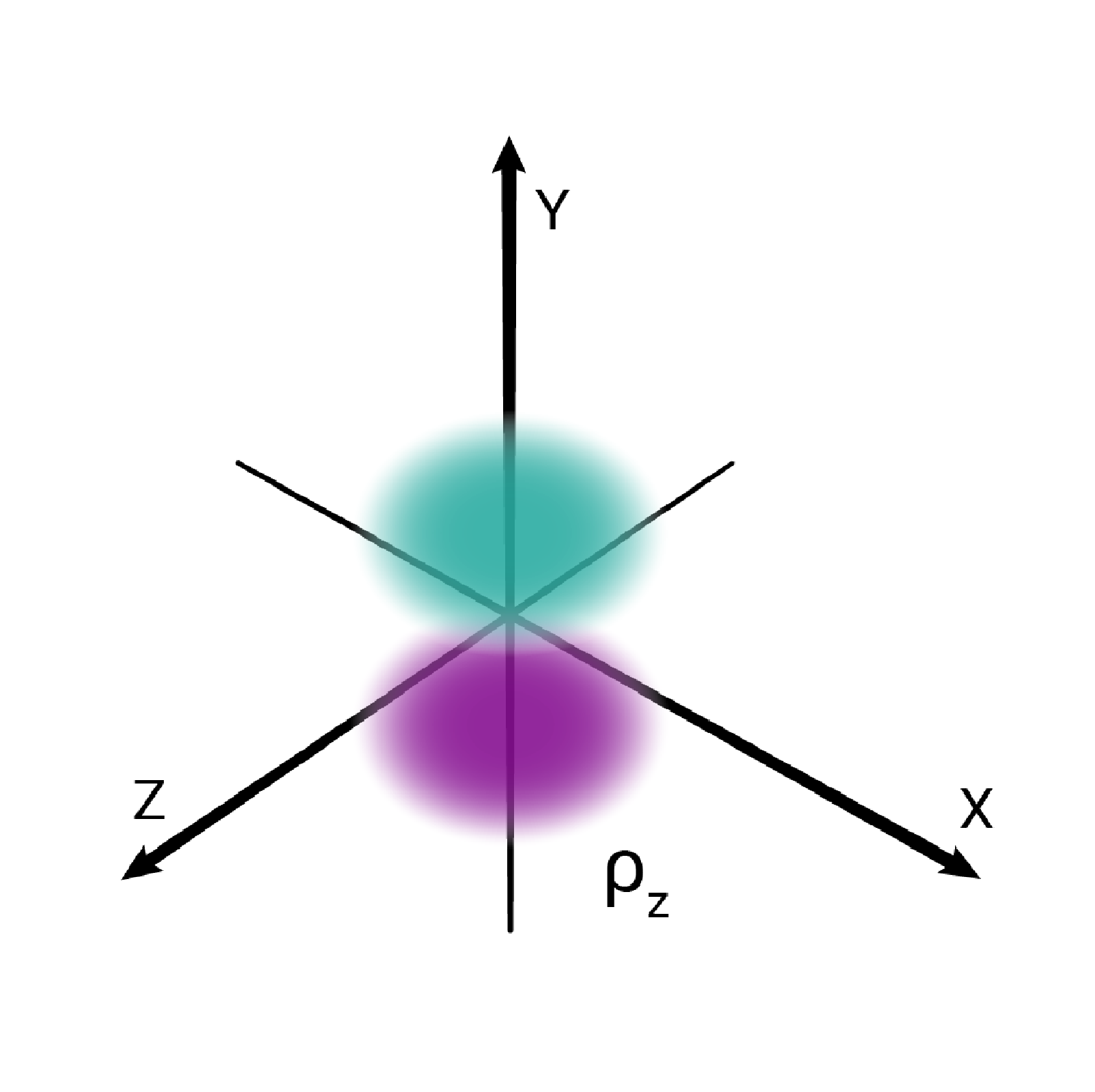 Orbital p Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 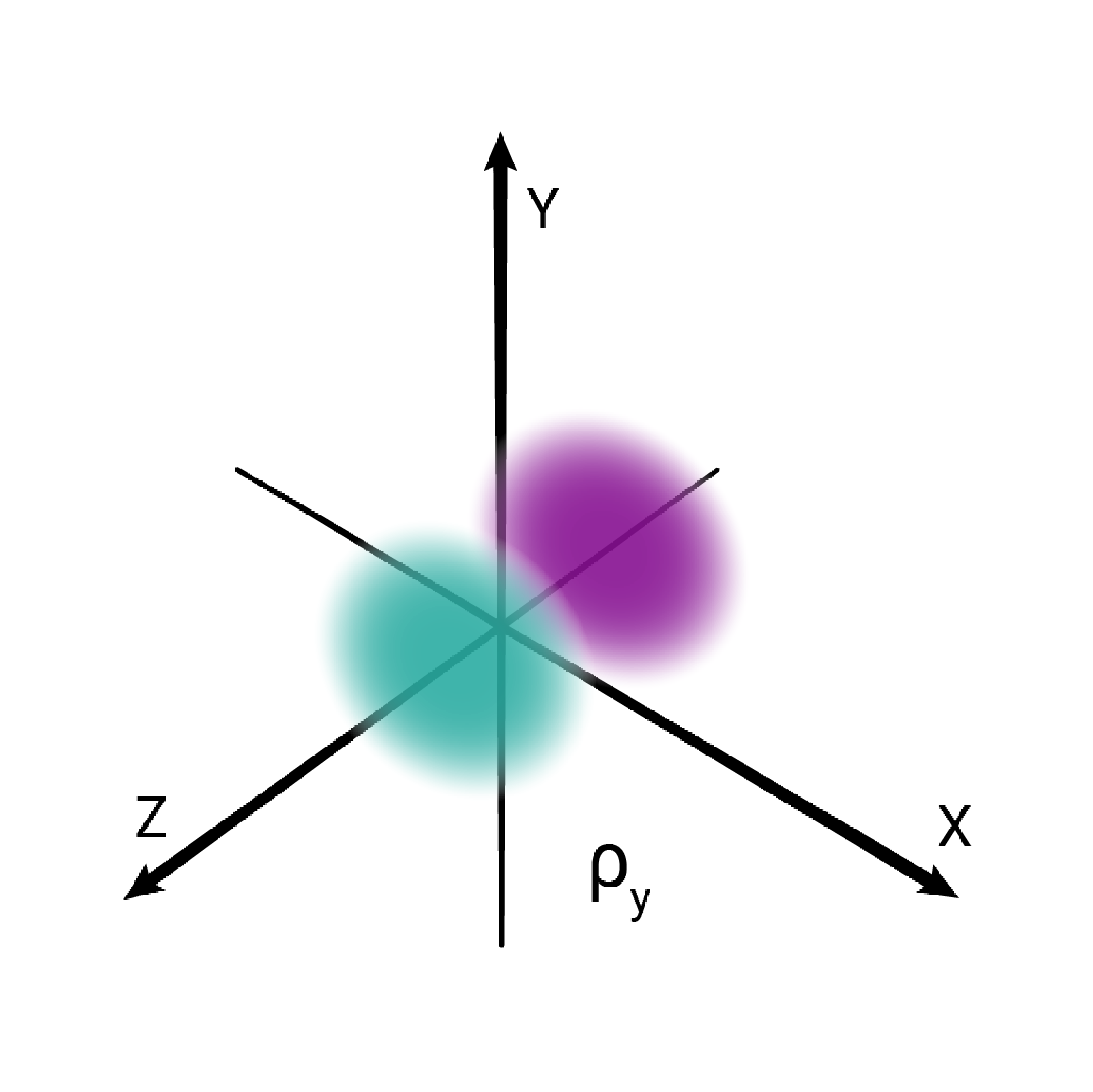 Orbital p Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 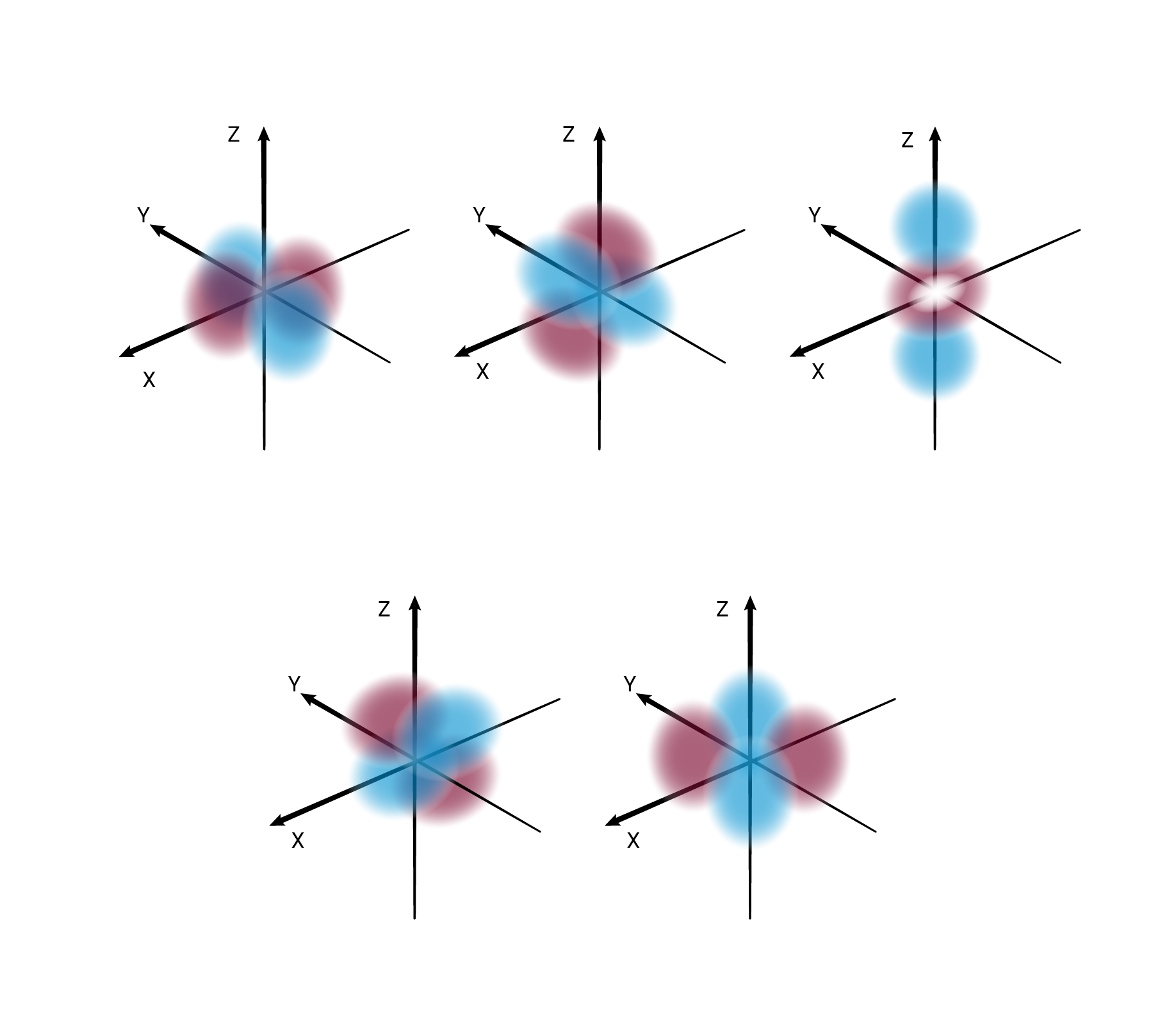 Orbitale d Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | ||||
N | 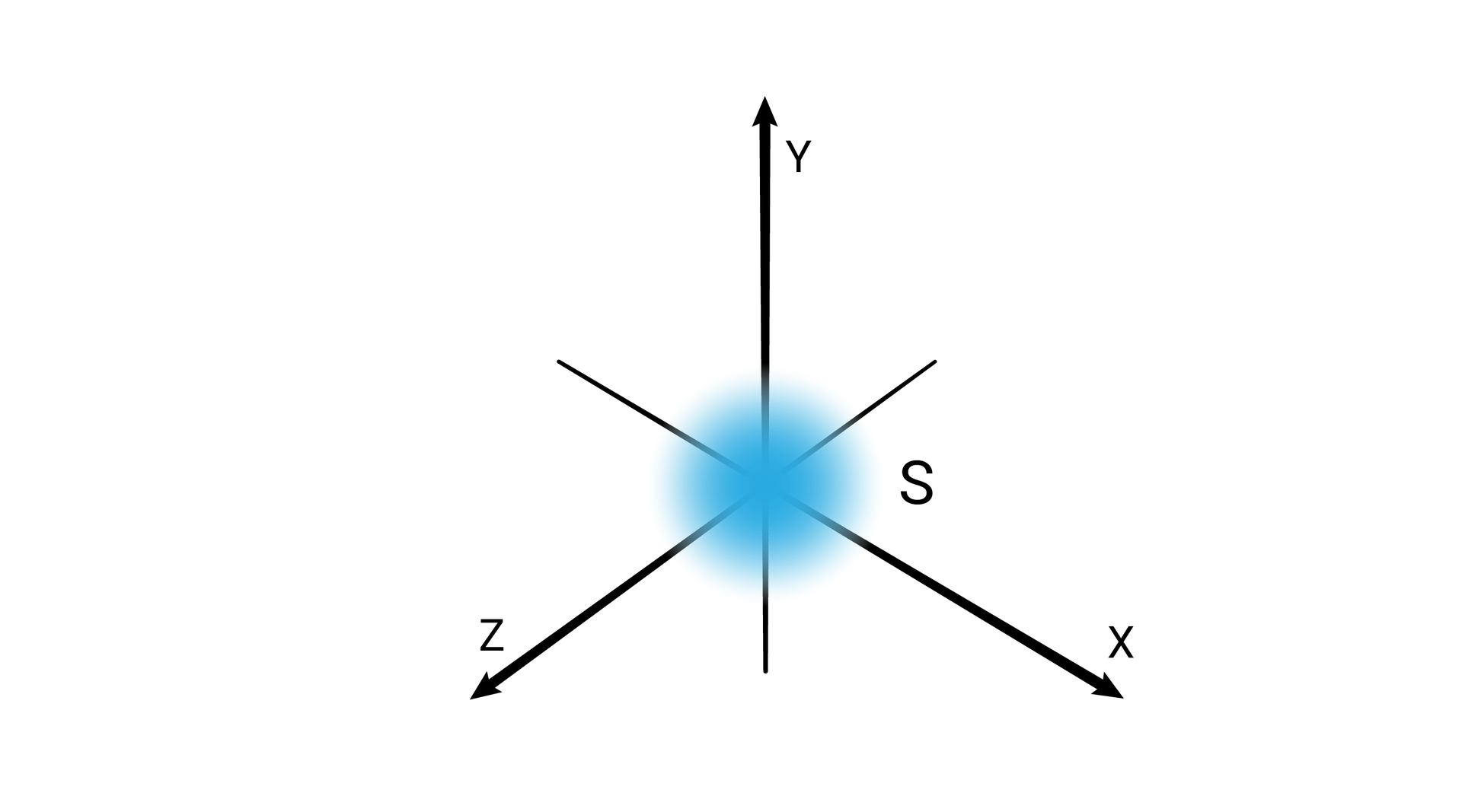 Orbital s Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 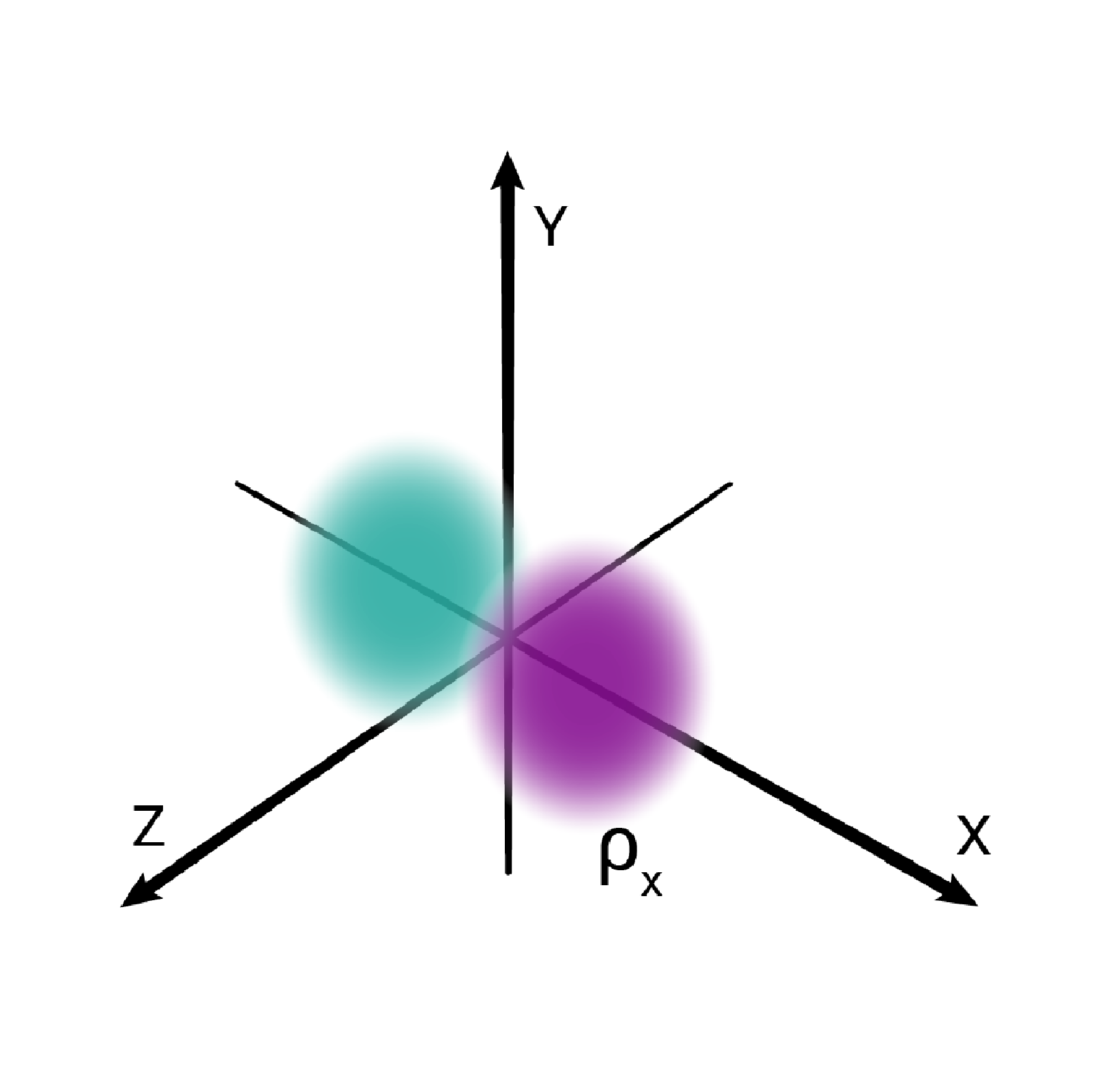 Orbital p Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 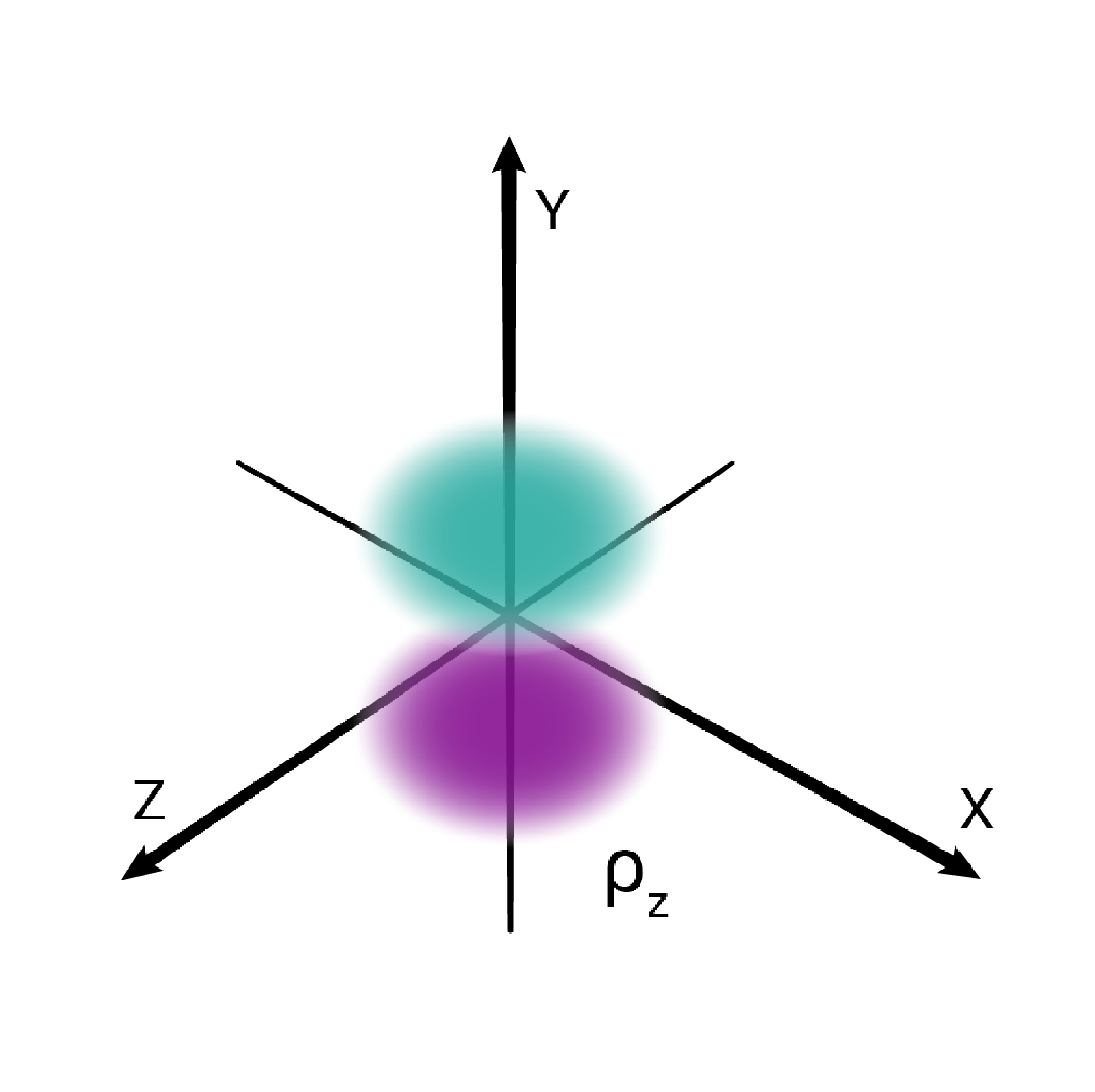 Orbital p Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 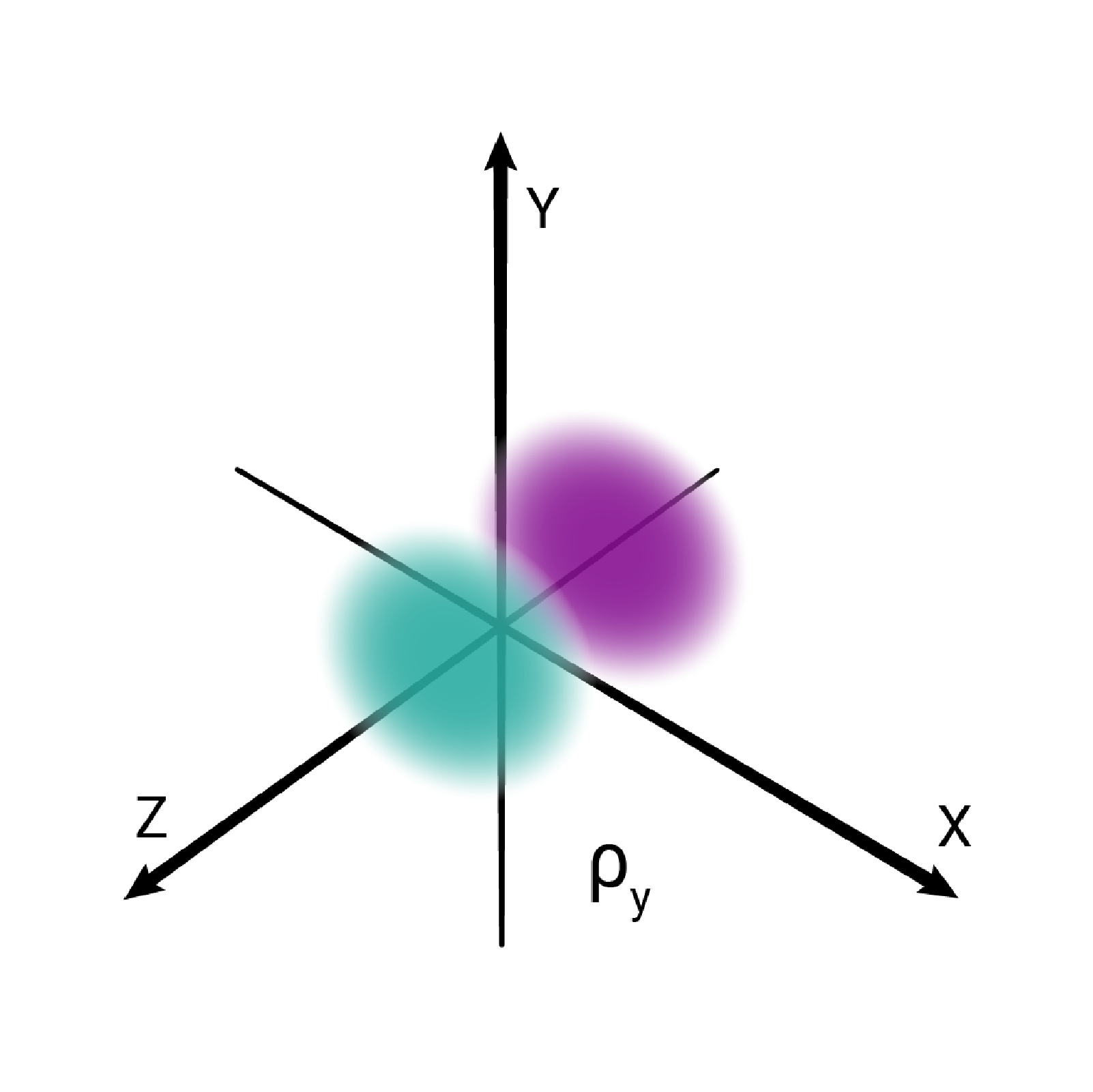 Orbital p Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 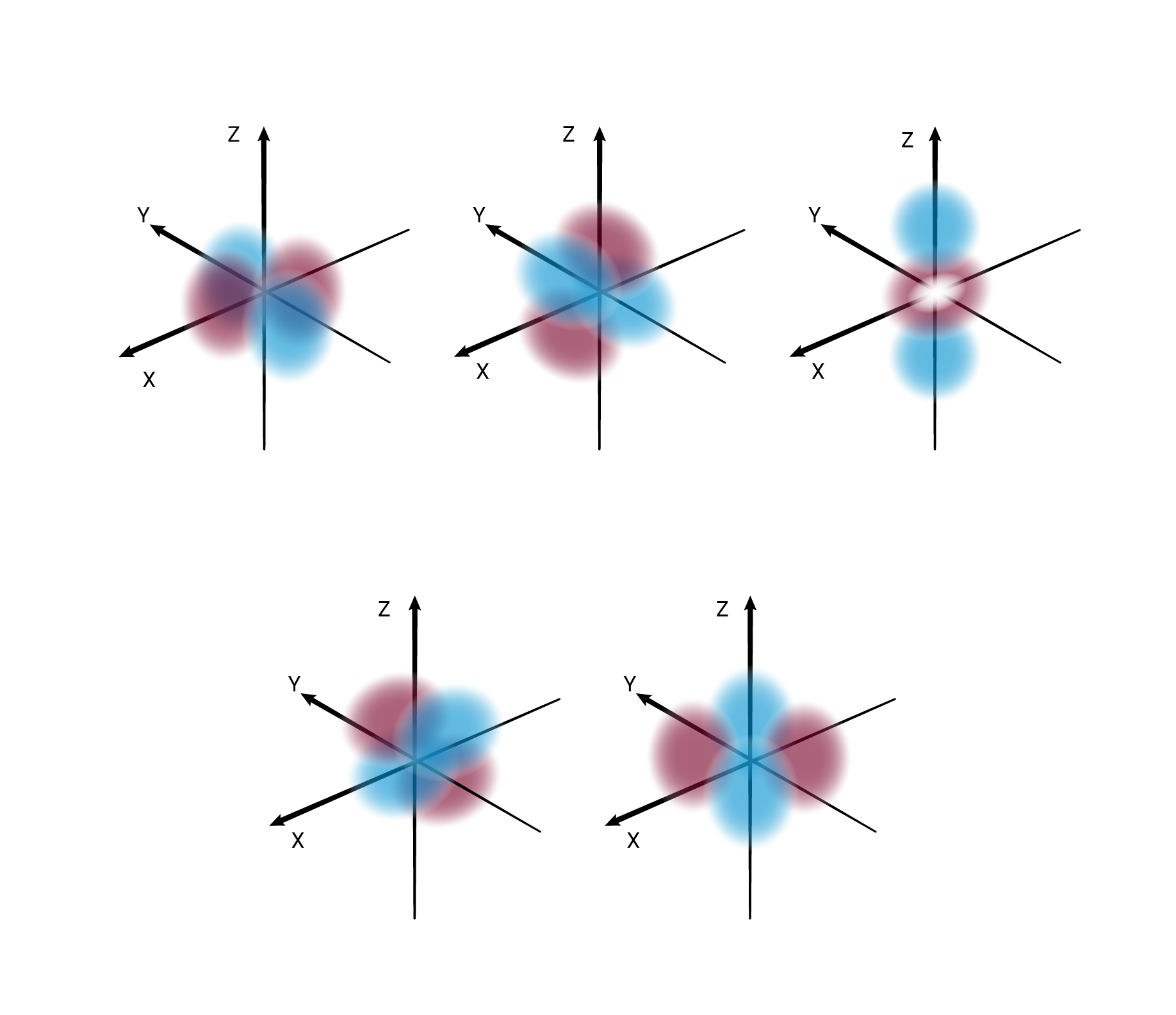 Orbitale d Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | 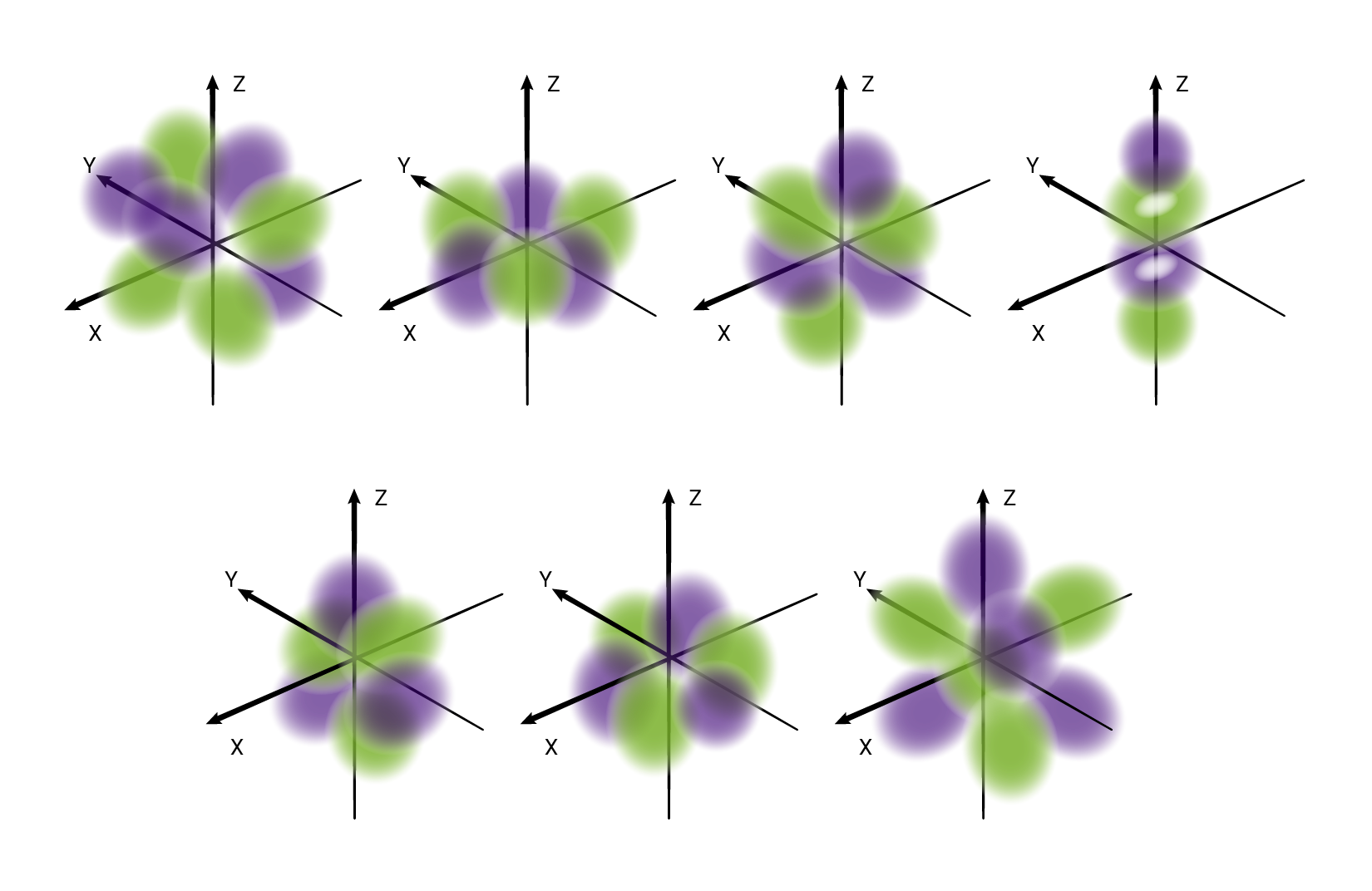 Orbitale f Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | |||
Rozmieszczenie elektronów w poziomach orbitalnych możemy przedstawić również w postaci graficznej, gdzie każdy poziom orbitalny odpowiada jednej klatce rysowanej jako kwadrat. W każdym poziomie orbitalnym znajdują się maksymalnie dwa elektrony. Jeden z nich zaznacza się symbolem strzałki skierowanej w górę , a drugi – symbolem strzałki skierowanej w dół , ze względu na różniący oba elektrony spin, czyli tak zwany kręt wewnętrzny. Wartość spinu elektronu jest jego podstawową cechą, obok masy i ładunku, wynoszącą bądź .
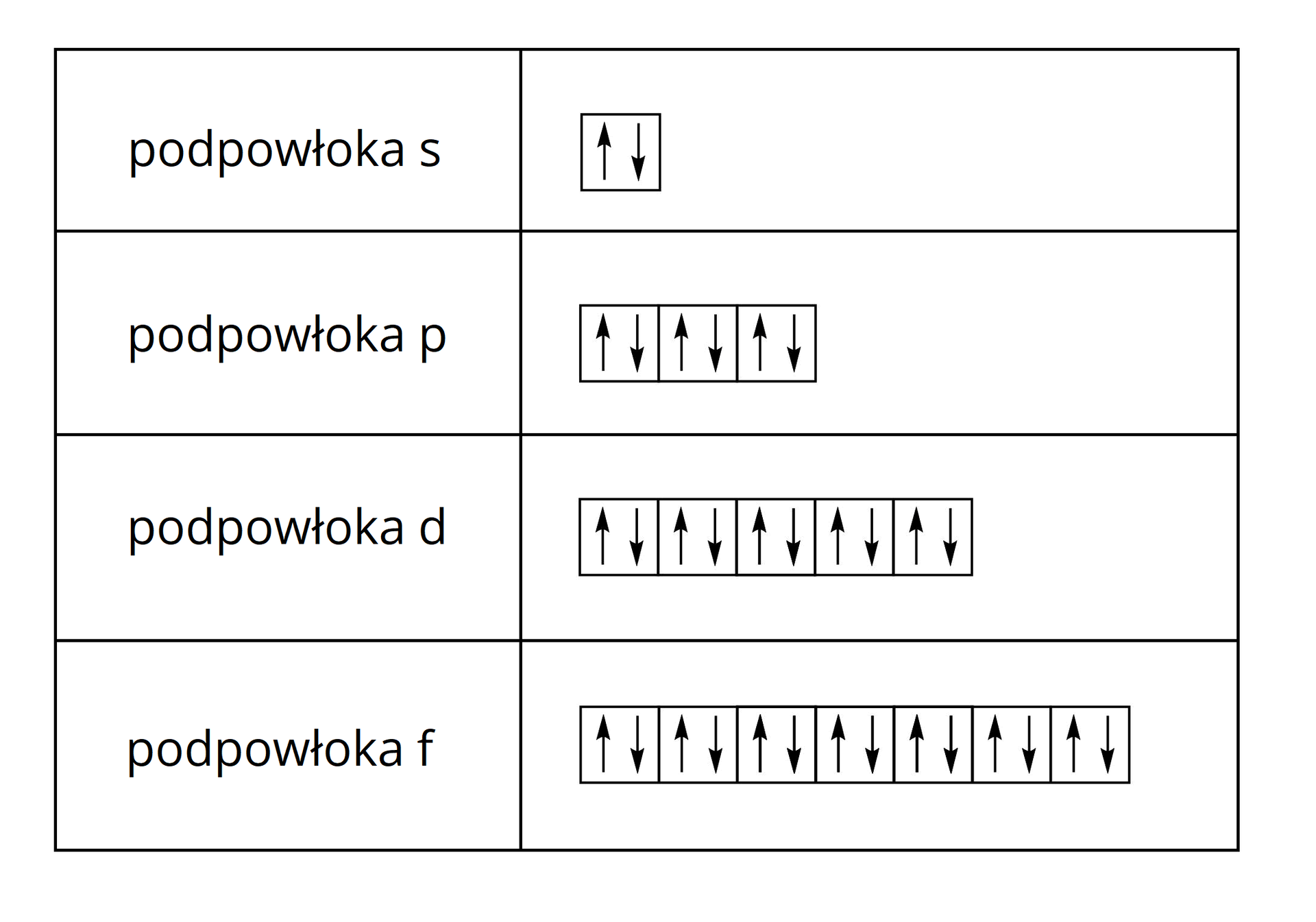
W jaki sposób krok po kroku zapisać podpowłokową konfigurację elektronową?
Konfigurację podpowłokową zapisuje się w ciągu symboli oznaczonych jako:
gdzie n oznacza numer powłoki, p – symbol podpowłoki a, a – liczbę elektronów w obrębie podpowłoki.
Przykładowo, zapis , czytane jako „ jeden es dwa”, oznacza elektrony rozmieszczone w podpowłoce s powłoki pierwszej.
W obrębie powłoki pierwszej, o symbolu K, mieści się jedna podpowłoka oznaczana symbolem . Podpowłokę stanowi jeden poziom orbitalny, oznaczany również jako .
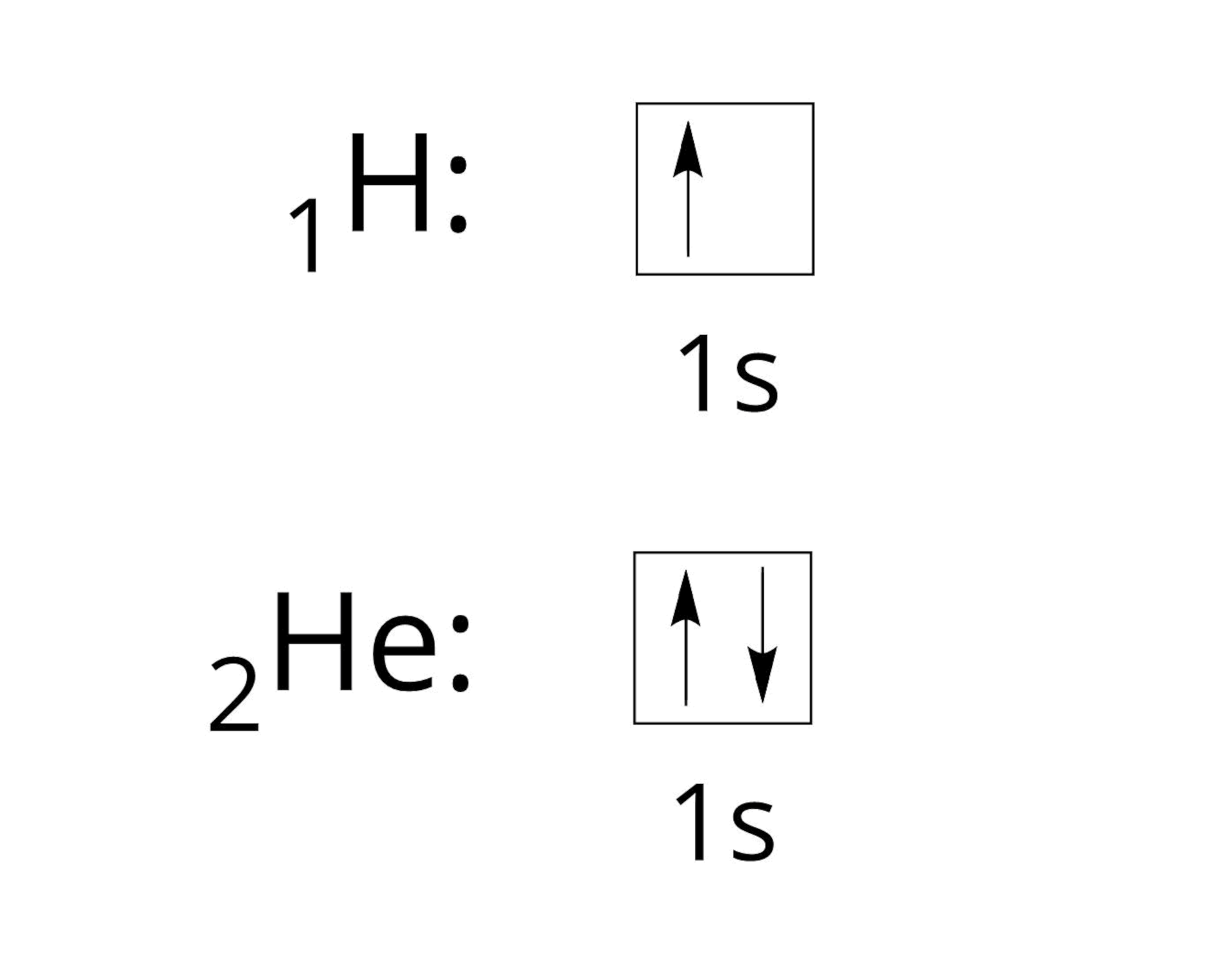
Elektrony atomów pierwiastków, należących do pierwszego okresu układu okresowego, rozmieszczone są na pierwszej powłoce. Do pierwiastków pierwszego okresu należy wodór oraz hel. Spójrzmy, w jaki sposób zapisuje się dla nich podpowłokową konfigurację elektronową.
gdzie oznacza nr powłoki, – symbol podpowłoki, a liczba w indeksie górnym – liczbę elektronów w obrębie tej podpowłoki.
Rozmieszczenie elektronów możemy również zapisać w postaci graficznej, która pokazuje, w jaki sposób elektrony rozmieszczone są na danych poziomach orbitalnych w obrębie podpowłok. Uzyskujemy wówczas tak zwaną konfigurację orbitalną (klatkową), która dla atomu wodoru i helu jest następująca:
W obrębie powłoki drugiej, o symbolu L, mieszczą się dwie podpowłoki oznaczane literą oraz . Podpowłokę stanowi jeden orbital oznaczany jako . Z kolei podpowłokę stanowią trzy orbitale oznaczane jako: , , . Na powłoce drugiej mieści się maksymalnie elektronów. Wiemy również, że na jednym poziomie orbitalnym mieszczą się maksymalnie elektrony. Zatem w obrębie podpowłoki możemy rozmieścić tylko elektrony, a w obrębie podpowłoki – elektronów, na trzech poziomach orbitalnych.
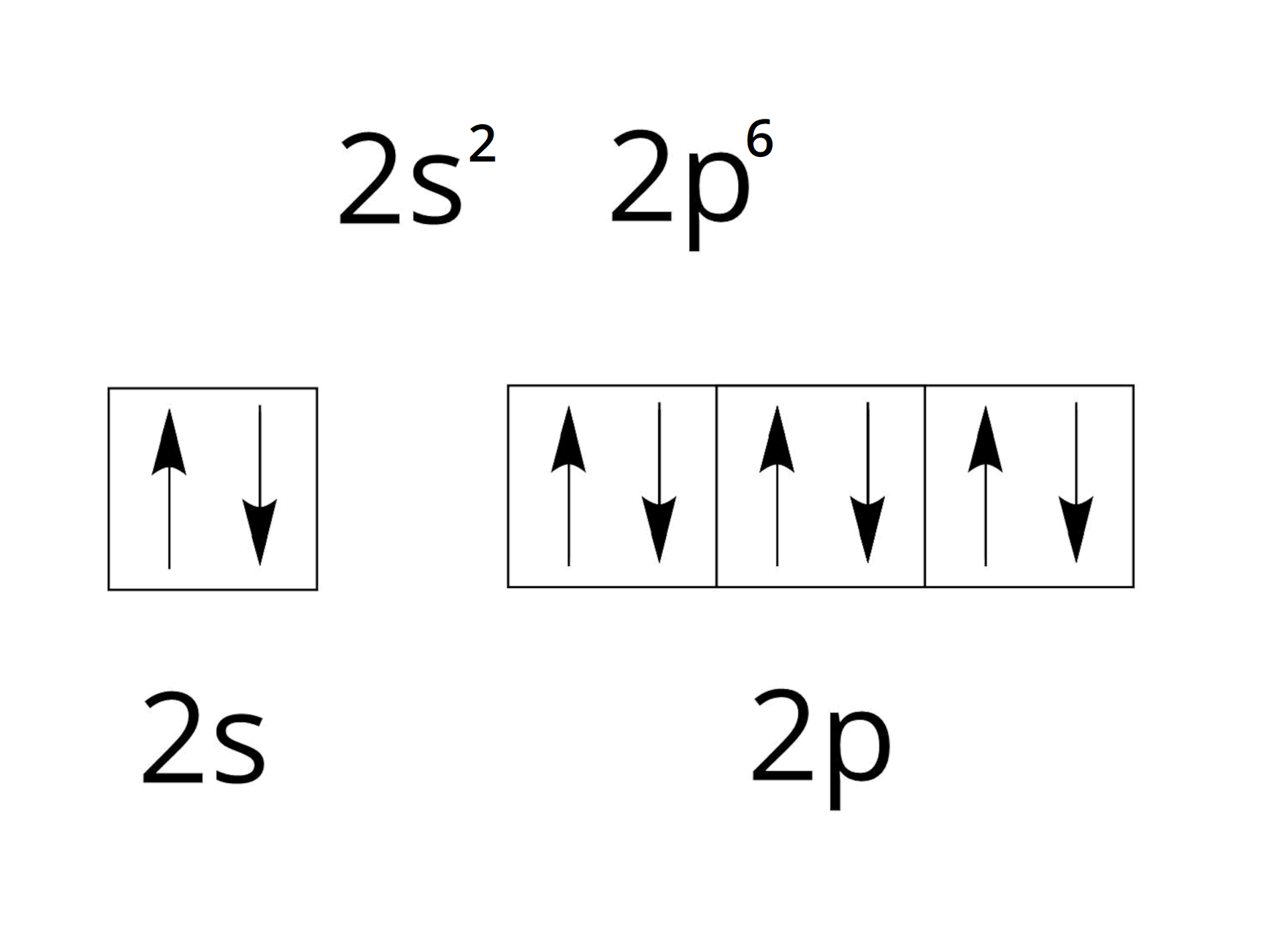
W drugim okresie znajduje się osiem pierwiastków. Ich podpowłokowe konfiguracje elektronowe zapisujemy następująco:
;
;
;
;
;
;
;
.
Natomiast rozmieszczenie elektronów w poziomach orbitalnych (klatkach) dla pierwiastków drugiego okresu zapisujemy następująco:
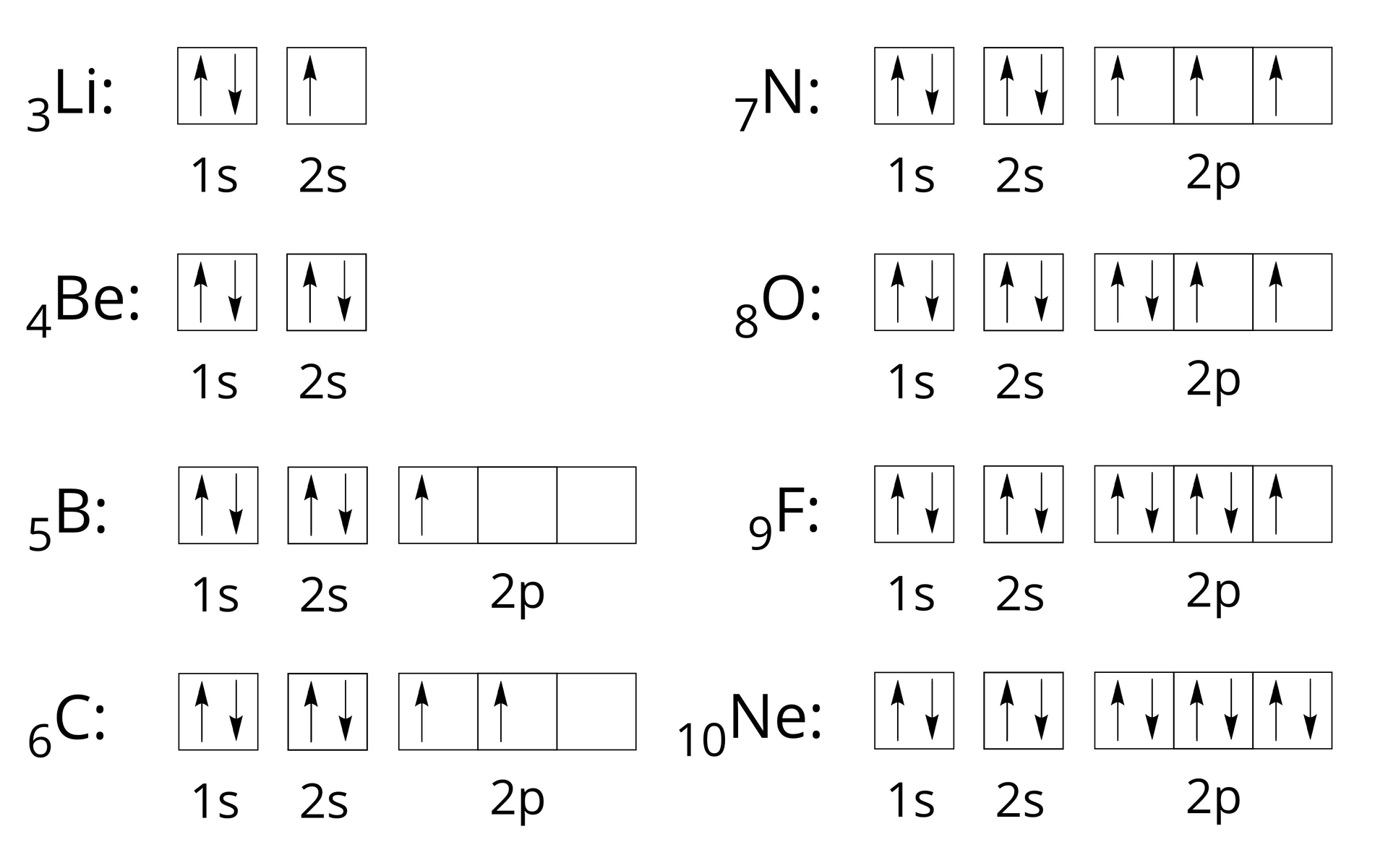
Należy przy tym pamiętać o kolejności zapełniania poziomów orbitalnych przez elektrony. Decyduje o tym reguła Hunda, według której liczba niesparowanych elektronów w obrębie danej podpowłoki musi być możliwie jak największa. Natomiast pary elektronowe tworzą się dopiero po zapełnieniu wszystkich orbitali danej podpowłoki przez elektrony niesparowane. Należy również pamiętać, że niesparowane elektrony muszą mieć tą samą orientację (np. wszystkie niesparowane elektrony rysujemy jako strzałkę skierowaną w górę).
Na powłoce trzeciej, którą oznaczamy literą M, mieści się maksymalnie elektronów – elektrony rozmieszczone są w obrębie podpowłoki , elektronów – w obrębie podpowłoki , a pozostałe elektronów – w obrębie podpowłoki .
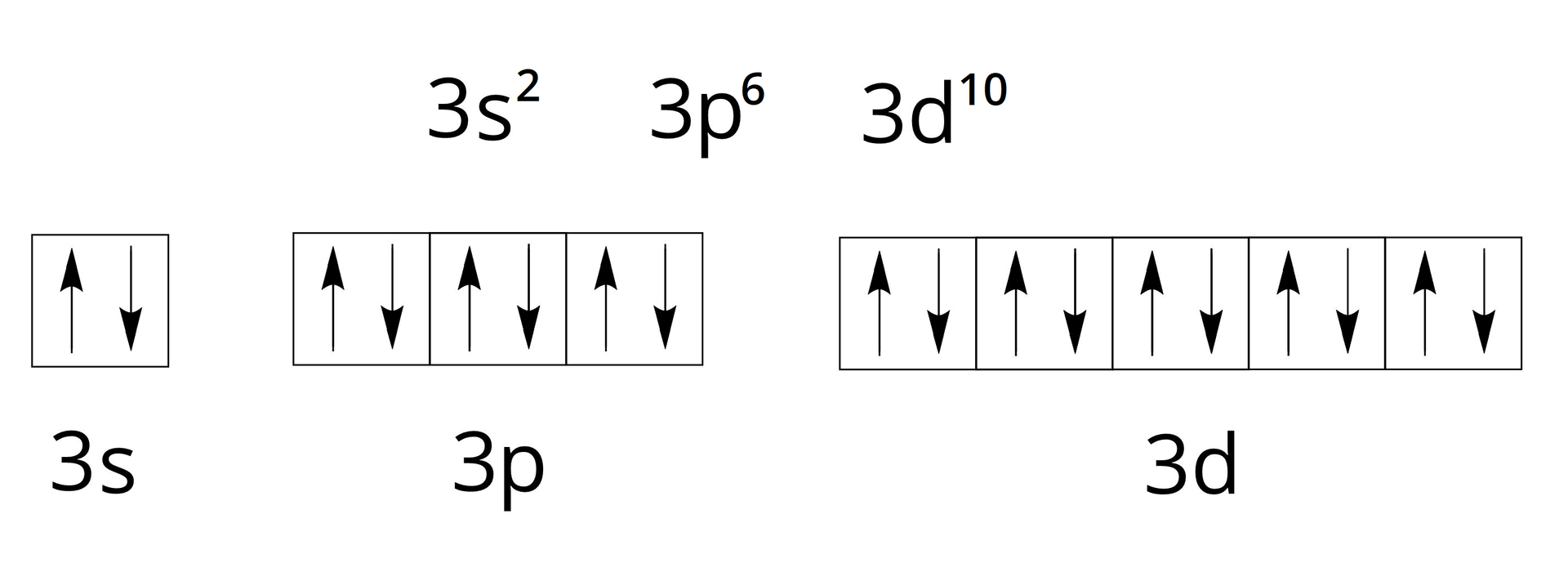
Zauważ, że w trzecim okresie umieszczonych jest tylko pierwiastków. Pozostałe znajduje się w czwartym okresie, w grupach od do Takie rozmieszczenie pierwiastków w układzie okresowym wynika z różnic wartości energii danych podpowłok. Bowiem podpowłoka ma niższą energię (znajduje się bliżej jądra atomowego) niż podpowłoka .
W jaki sposób zapiszemy zatem podpowłokową konfigurację elektronową dla pierwiastków trzeciego okresu?
Pamiętajmy, że wszystkie pierwiastki trzeciego okresu mają również elektrony rozmieszczonej na powłokach i podpowłokach o niższych wartościach energii, które należy uwzględnić w zapisie, jak poniżej:
;
;
;
;
;
;
;
.
Rozmieszczenie elektronów w poziomach orbitalnych dla pierwiastków trzeciego okresu zapisujemy następująco:
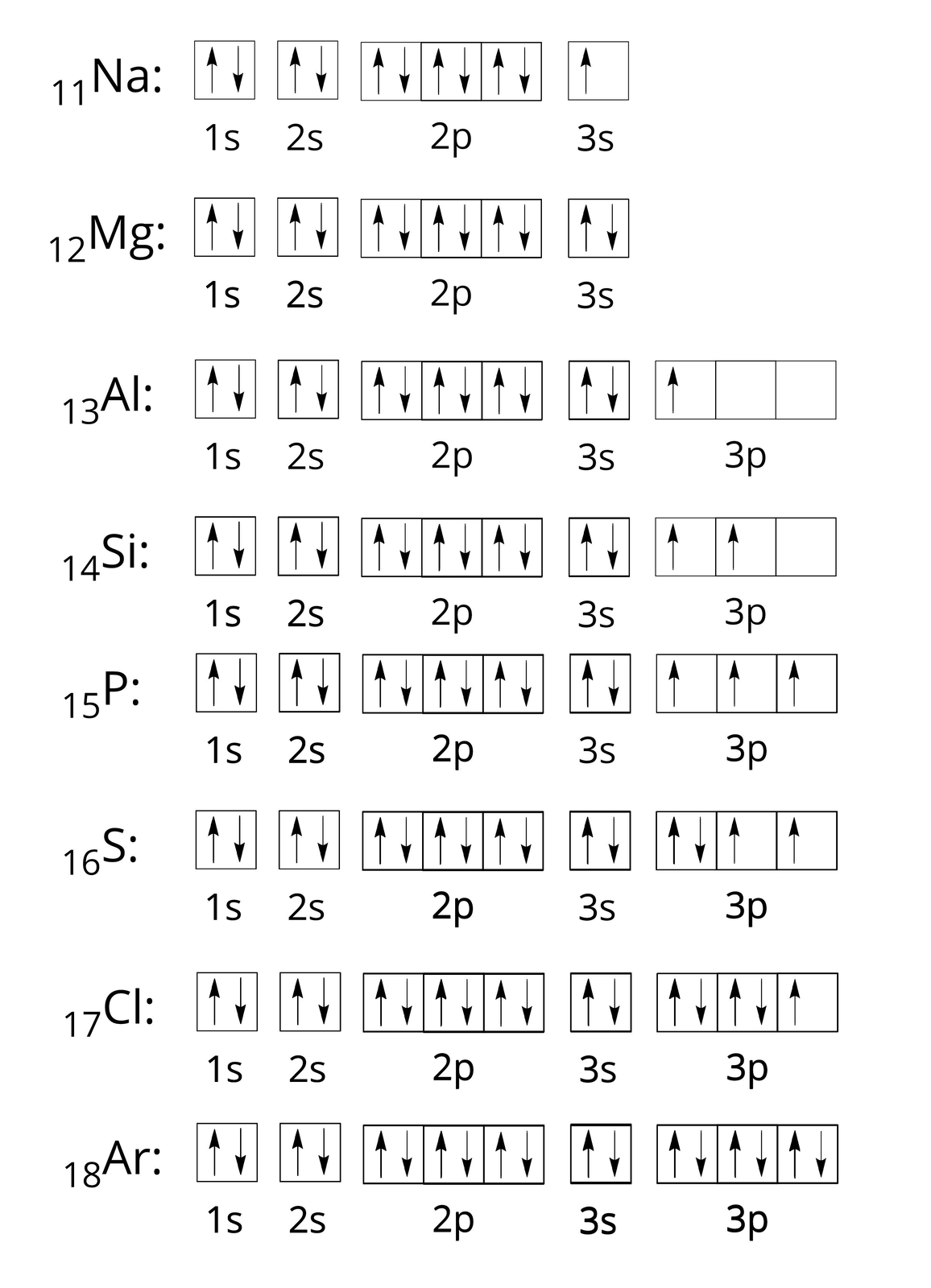
Pozostałe elektronów dotyczy atomów od skandu do cynku, zajmujących podpowłokę . Pierwiastki te uwzględnione zostaną w rozważaniach dotyczących czwartego okresu.
Na powłoce czwartej, którą oznaczamy literą N, mieszczą się maksymalnie elektrony – elektrony rozmieszczone są w obrębie podpowłoki , elektronów – w obrębie podpowłoki , kolejne elektronów – w obrębie podpowłoki . Pozostałe elektronów rozmieszczonych jest w obrębie podpowłoki .
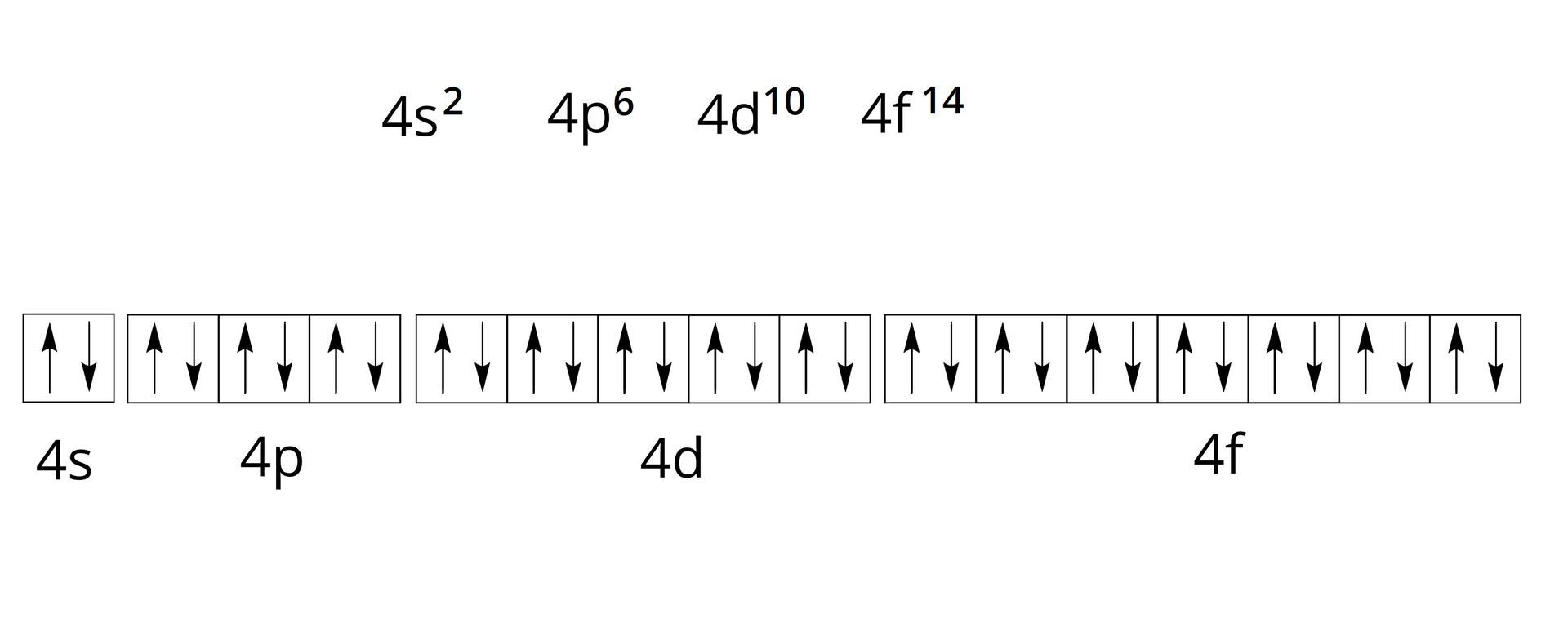
W czwartym okresie umieszczonych jest pierwiastków. Elektrony dziesięciu z nich (od skandu do cynku) należą do podpowłoki . Jednak elektrony podpowłok oraz należą do pierwiastków leżących w piątym i szóstym okresie układu okresowego.
Rozmieszczenie elektronów w podpowłokach dla pierwiastków czwartego okresu zapisujemy następująco:
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
.
W atomach pierwiastków, których elektrony walencyjneelektrony walencyjne zaznaczono na czerwono, czyli w atomach chromu i miedzi, dochodzi do zmiany konfiguracji elektronowej, czyli tak zwanej promocji elektronowej. Dla atomu chromu oczekiwalibyśmy następującej konfiguracji elektronowej elektronów walencyjnych: . Jednak jeden z elektronów podpowłoki przechodzi do podpowłoki . Uzyskujemy wówczas konfigurację . Podobnie dla atomu miedzi – oczekiwalibyśmy następującej konfiguracji elektronowej elektronów walencyjnych: . Jednak jeden z elektronów podpowłoki przechodzi do podpowłoki . Uzyskujemy wówczas konfigurację . Połowicznie lub całkowicie zapełniona podpowłoka stanowi energetycznie korzystny układ. Otrzymujemy wówczas konfiguracje elektronową o całkowitej niższej energii.
Rozmieszczenie elektronów w poziomach orbitalnych dla wybranych pierwiastków czwartego okresu zapisujemy następująco:

W kolejnych powłokach zapełnianie elektronami poziomów orbitalnych w podpowłokach jest analogiczne. Jednak należy pamiętać o kolejności zapełniania podpowłok, którą można przedstawić schematycznym rysunkiem:
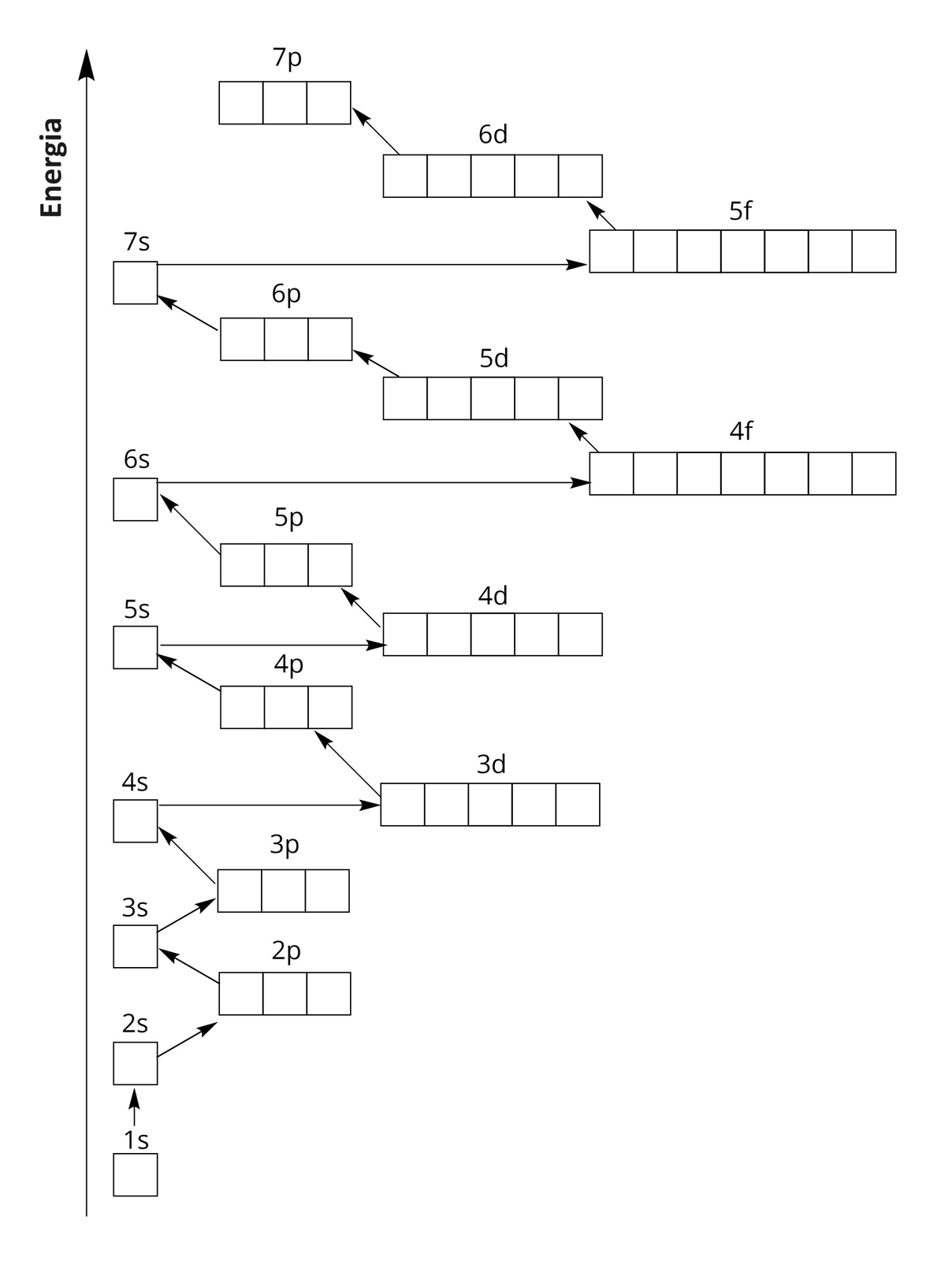
Rozmieszczenie elektronów w atomie można również przedstawić w postaci skróconego zapisu. Polega on na zapisaniu symbolu gazu szlachetnego, poprzedzającego dany pierwiastek chemiczny w układzie okresowym. Symbol ten zastępuje jego konfigurację elektronową. Za symbolem gazu szlachetnego zapisujemy pozostały fragment konfiguracji elektronowej.
Na przykład gazem szlachetnym, poprzedzającym magnez (), jest neon (). Dlatego zamiast pełnego zapisu:
możemy zastosować zapis skrócony:
Gazem szlachetnym, poprzedzającym brom (), jest argon (). Dlatego zamiast pełnego zapisu:
możemy zastosować zapis skrócony:
Zaznacz, który z poniższych zapisów przedstawia skróconą podpowłokową konfigurację elektronową atomu tlenu.
Naucz się zapisywać konfiguracje elektronowe
Korzystając z poniższej aplikacji naucz się zapisywać konfigurację elektronową wybranych atomów w różnej formie. Pomiń na razie konfigurację elektronową jonów.
Wskaż symbol pierwiastka, którego konfigurację elektronową przedstawiono poniżej:
Dokończ poniższy zapis podpowłokowej konfiguracji elektronowej atomu krzemu, wstawiając odpowiednie liczby elektronów w puste miejsca.
Ułóż podane symbole podpowłok w kolejności ich zapełniania przez elektrony.
Słownik
elektrony poruszające się w zewnętrznej (często położonej najdalej od jądra atomowego; ostatniej) powłoce elektronowej w atomie
rozmieszczenie elektronów w atomie
powłoka, na której znajdują się elektrony walencyjne, często ostatnia (najbardziej zewnętrzna) powłoka elektronowa w atomie