Na dobry początek
Układ okresowy nazywany jest często „legalną ściągą chemika”. Czy wiesz skąd wzięło się to sformułowanie? Co takiego może nam podpowiedzieć układ okresowy? Czy możemy z niego odczytać informacje na temat budowy atomów poszczególnych pierwiastków chemicznych?
Atomy pierwiastków, które należą do tej samej grupy układu okresowego, mają jednakową liczbę elektronów walencyjnych (wyjątek, jak już wspomniano, stanowi atom helu). Ponieważ liczba elektronów walencyjnych jest jednym z parametrów mających wpływ na właściwości chemiczne pierwiastka, możemy wnioskować, że pierwiastki z tej samej grupy wykazują podobne właściwości. Da się to zaobserwować szczególnie w przypadku litowców (pierwsza grupa układu okresowego z wyjątkiem wodoru), berylowców (druga grupa układu okresowego), fluorowców ( grupa układu okresowego) i helowców ( grupa układu okresowego).
Sprawdź, czy litowce wykazują podobne właściwości chemiczne w kontakcie z wodą.
W tym celu wykonaj doświadczenie 1. Wykonaj je w asyście osoby dorosłej. Pamiętaj o zachowaniu wszelkich środków ostrożności – doświadczenie wykonaj w okularach ochronnych, pod dygestorium, z dala od źródeł ognia. Zapisz obserwacje i sformułuj odpowiednie wnioski.
Problem badawczy:
Czy litowce wykazują podobne właściwości chemiczne w kontakcie z wodą?
Hipoteza:
Metale należące do pierwszej grupy układu okresowego reagują z wodą.
Co było potrzebne?
lit;
sód;
potas;
woda destylowana;
metalowe szczypce;
bibuła filtracyjna;
nóż;
trzy wysokie zlewki (o pojemności ).
Instrukcja:
Do trzech zlewek wlano po około wody destylowanej i ustawiono je w rzędzie obok siebie. Z pojemnika zawierającego metal wyjęto próbkę metalu i położono na suchej bibule. Suchym nożem odcięto kawałek metalu wielkości dwóch ziarenek ryżu. Niewykorzystany kawałek metalu odłożono ponownie do pojemnika, a pojemnik odsunięto od miejsca wykonywania doświadczenia. W ten sam sposób postąpiono z każdym z trzech metali. Każdy kawałek wrzucono do innej zlewki z wodą i obserwowano zachodzące zmiany.
Obserwacje:
Każdy z metali, po wprowadzeniu go do wody, unosił się na jej powierzchni. Potas zapalił się zaraz po wprowadzeniu go do wody. W każdej ze zlewek zaobserwowano roztwarzanie się (zanik) ciała stałego (metalu) oraz wydzielanie się bezbarwnego, bezwonnego gazu. Najbardziej intensywne wydzielanie się gazu zaobserwowano w zlewce z potasem, a najmniej intensywne – w zlewce z litem.
Wnioski:
Postawiona hipoteza jest prawdziwa – poczynione obserwacje świadczą o tym, że litowce reagują z wodą. Można również wnioskować, że lit, sód oraz potas wykazują różną aktywność wobec wody. Najbardziej aktywny z analizowanych metali w reakcji z wodą jest potas, a najmniej aktywny lit. Unoszenie się metali na powierzchni wody informuje, że każdy z użytych w doświadczeniu metali ma gęstość mniejszą od gęstości wody.
Podobieństwo we właściwościach chemicznych objawia się tym, że pierwiastki z tej samej grupy układu okresowego reagują z tymi samymi substancjami chemicznymi, a z innymi pierwiastkami tworzą podobny typ związków chemicznych. Każdy z wykorzystanych w doświadczeniu 1 metali ulega reakcji chemicznej z wodą (świadczy o tym m.in. wydzielanie się gazu – powstaje nowa substancja chemiczna).
Reakcja ta dla każdego z użytych metali zachodzi z różną intensywnością (zmiany obserwowane są z różną intensywnością). W przypadku potasu, reakcja z wodą zachodzi najszybciej (potas w kontakcie z wodą zapala się), nieco wolniej przebiega reakcja sodu z wodą, a najwolniej reakcja litu z wodą. Możemy zatem wnioskować, że litowce to metale aktywne – łatwo reagują z wodą, przy czym aktywność użytych w doświadczeniu metali rośnie w szeregu: lit, sód, potas.
W tym samym szeregu rośnie liczba atomowa wymienionych pierwiastków chemicznych. Pewne prawidłowości, związane ze zmianą aktywności pierwiastków chemicznych tej samej grupy, możemy również określić dla pozostałych grup układu okresowego.
Berylowce, a więc pierwiastki należące do drugiej grupy układu okresowego, podobnie jak litowce, są aktywnymi metalami. Aktywność berylowców rośnie wraz ze wzrostem liczby atomowej. Znajdujące się po drugiej stronie układu okresowego fluorowce (grupa ) tworzą grupę aktywnych chemicznie niemetali, wśród których największą aktywnością odznacza się fluor. Ich aktywność rośnie więc wraz ze zmniejszaniem się liczby atomowej. Ostatnia grupa, helowce, to zbiór najmniej aktywnych pierwiastków w całym układzie okresowym. Z powodu małej aktywności chemicznej, nazwano je gazami szlachetnymi.
Pierwiastki chemiczne, które należą do jednego okresu układu okresowego, nie wykazują podobieństw we właściwościach chemicznych. W okresach następuje zmiana charakteru pierwiastków – od aktywnych metali (pierwszej i drugiej grupy z wyjątkiem berylu), poprzez metale o mniejszej aktywności i aktywne niemetale, aż do biernych chemicznie helowców (gazów szlachetnych).
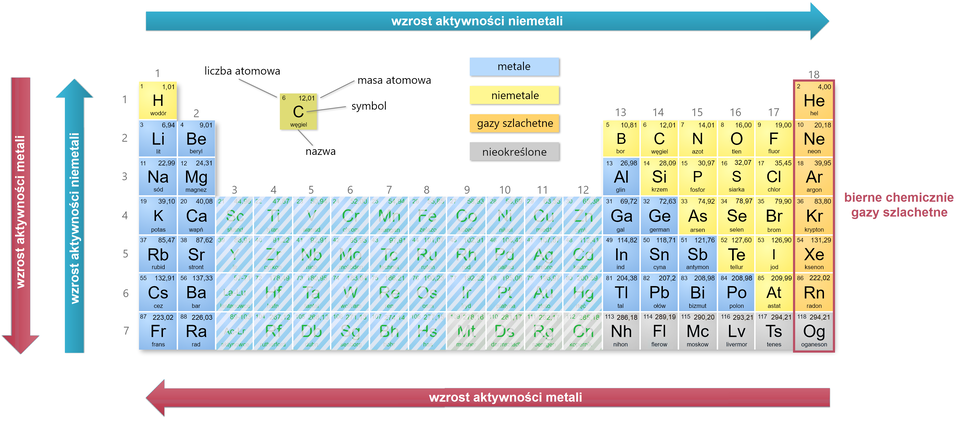
Tak jak pierwiastki z jednej grupy mają podobne właściwości, tak pierwiastki należące do jednego okresu już takich podobieństw nie wykazują. W okresach następuje zmiana charakteru pierwiastków – od aktywnych metali ( i grupy) poprzez aktywne niemetale do biernych chemicznie helowców (gazów szlachetnych).
Napisz obserwacje odnotowane w trakcie wykonywania doświadczenia oraz wynikające z nich wnioski.