Jakie właściwości posiadają substancje chemiczne?
Zimą do spryskiwaczy i chłodnic samochodowych wlewa się specjalne płyny, które zamarzają w temperaturze poniżej –20 °C, a nawet –37 °C. Do szlifowania i polerowania kamieni szlachetnych, a także do cięcia szkła używa się diamentu, który jest najtwardszym z materiałów. Zastosowania substancji są związane z ich cechami charakterystycznymi, takimi jak np. temperatura krzepnięcia lub twardość. Zastanów się, jakie inne właściwości mają substancje nas otaczające i w jaki sposób można je wykorzystywać.
Każda substancja ma swoje charakterystyczne cechy – właściwości, które możemy podzielić na:
fizyczne,
chemiczne.
Jakie właściwości nazywamy fizycznymi?

Film dostępny pod adresem /preview/resource/RE0gEIuRTWoVj
Film przedstawia badanie właściwości fizycznych substancji stałych.
Zaplanuj doświadczenie, przeprowadź je i zapisz obserwacje oraz wnioski.
Znajdź podobieństwa i różnice we właściwościach fizycznych następujących substancji: soli kamiennej, cukru, mąki, kawałka kredy, oleju, miedzianego drutu oraz żelaznej szpilki krawieckiej. Porównaj ich barwy, stan skupienia, rozpuszczalność w wodzie.
Przeprowadzono doświadczenie polegające na znalezieniu podobieństwa i różnic we właściwościach fizycznych następujących substancji: soli kamiennej, cukru, mąki, kawałka kredy, oleju, miedzianego drutu oraz żelaznej szpilki krawieckiej. Porównano ich barwy, stan skupienia, rozpuszczalność w wodzie.
Problem badawczy
W jaki sposób można zidentyfikować właściwości fizyczne substancji i ich mieszanin?
Hipoteza
Właściwości fizyczne substancji i ich mieszanin można zidentyfikować za pomocą zmysłów.
Co będzie potrzebne
sól kamienna;
cukier;
mąka;
kawałek kredy;
woda;
miedziany drut;
żelazna szpilka krawiecka;
siedem szalek Petriego;
siedem zlewek;
bagietka.
Instrukcja
Na pięciu szalkach Petriego umieszczono kolejno po łyżeczce: soli kamiennej, cukru, mąki, rozdrobionej kredy oraz wody. Na szóstej szalce położono kawałek miedzianego drutu, a na siódmej - żelazną szpilkę krawiecką. Określono stan skupienia oraz barwę badanych substancji. Do zlewek wlano wodę do połowy ich objętości, dodano badane substancje z szalek Petriego i zamieszano bagietką. Określono rozpuszczalność w wodzie.
Obserwacje
Zanotowano następujące obserwację:
sól kamienna, stan skupienia: stały, barwa: biała, rozpuszczalność w wodzie: dobra;
cukier, stan skupienia: stały, barwa: biała, rozpuszczalność w wodzie: dobra;
mąka, stan skupienia: stały, barwa: biała, rozpuszczalność w wodzie: słaba;
kawałek kredy, stan skupienia: stały, barwa: biała, rozpuszczalność w wodzie: nierozpuszczalna;
olej, stan skupienia: ciekły, barwa: żółty, rozpuszczalność w wodzie: bardzo słaba;
miedziany drut, stan skupienia: stały, barwa: pomarańczowo‑brunatna, rozpuszczalność w wodzie: nierozpuszczalna;
żelazna szpilka krawiecka, stan skupienia: stały, barwa: srebrzystoszara, rozpuszczalność w wodzie: nierozpuszczalna;
Wnioski
Do właściwości fizycznych należą m. in. stan skupienia, barwa oraz rozpuszczalność w wodzie.
Uzupełnij tabelę z obserwacjami.
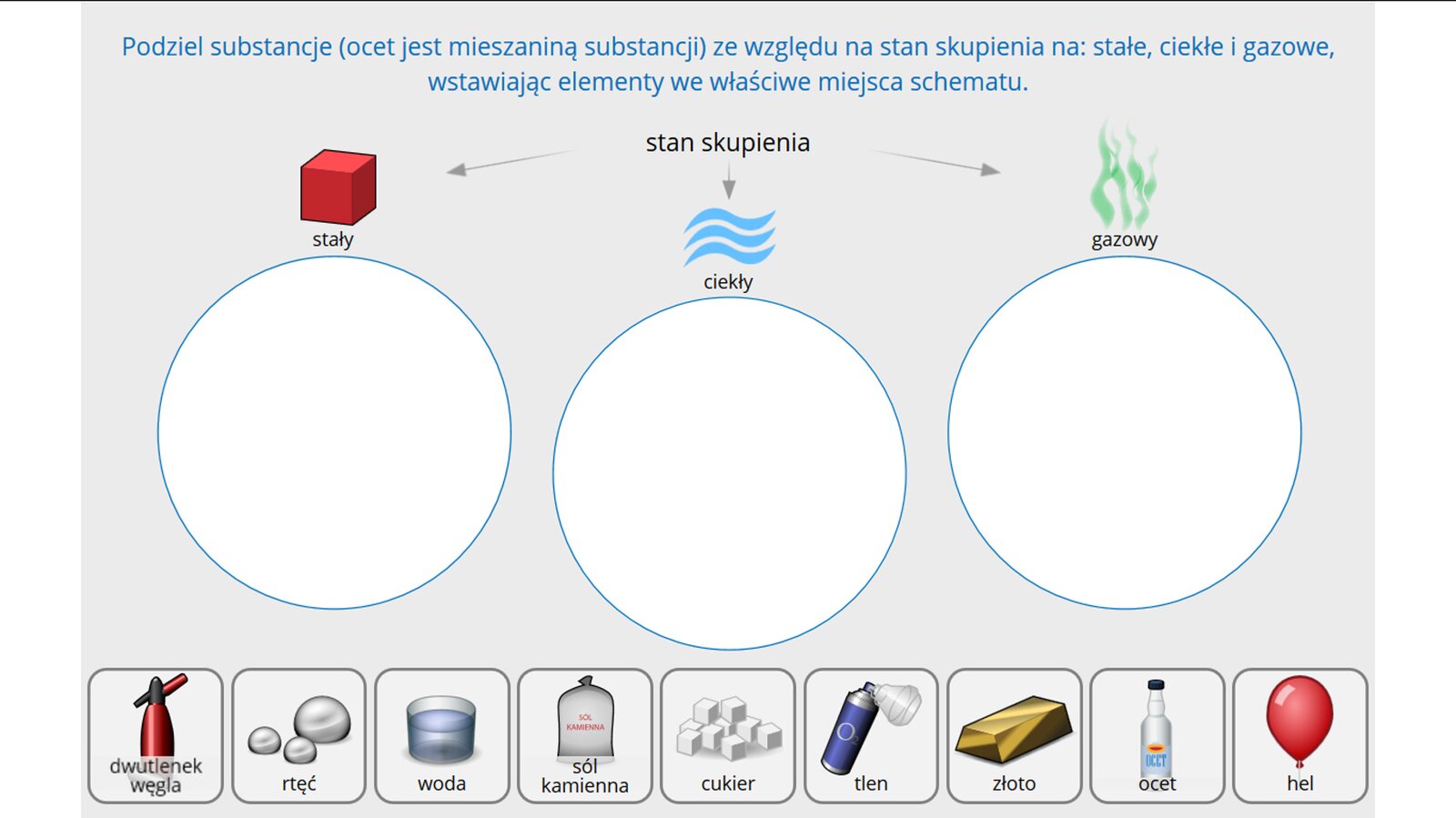
Do właściwości fizycznych należą m.in. stan skupienia. Jakie znasz możliwe stany skupienia i ewentualne przykłady? Odpowiedź zapisz poniżej.

Film dostępny pod adresem /preview/resource/R1TdhX8RXKQfJ
Film przedstawia badanie właściwości fizycznych substancji ciekłych.

Jakie właściwości nazywamy chemicznymi?
Obejrzyj fotografie. Obie drabiny przez kilka miesięcy były narażone na działanie podobnych warunków atmosferycznych.
Zastanów się i napisz, jakimi właściwościami różnią się substancje, z których wykonano obie drabiny.

Dwie drabiny - żelazna i aluminiowa - przez kilka miesięcy były narażone na działanie podobnych warunków atmosferycznych.
Obie drabiny przez kilka miesięcy były narażone na działanie podobnych warunków atmosferycznych. Drabina żelazna po pewnym czasie zardzewiała, drabina aluminiowa nie. Zastanów się i napisz, jakimi właściwościami różnią się substancje, z których wykonano obie drabiny.
Właściwościami chemicznymi nazywamy te cechy substancji, które można określić na podstawie jej zachowania wobec innych substancji. Są to np.:


Film dostępny pod adresem /preview/resource/RBwKGKgo4TqBU
W filmie przedstawiono doświadczenie porównujące właściwości tlenu i tlenku węgla(IV).
Przeprowadź doświadczenie w wirtualnym laboratorium chemicznym, polegające na zbadaniu wybranych właściwości fizykochemicznych następujących substancji: kwasu octowego, mąki, soli kuchennej, jodu, siarki, cukru, benzyny, miedzianej blaszki, oliwy z oliwek oraz etanolu. Rozwiąż problem badawczy i zweryfikuj hipotezę. W formularzu zapisz obserwacje, a następnie sformułuj wnioski.
Zapoznaj się z opisem doświadczenia przeprowadzonego w wirtualnym laboratorium chemicznym, polegającego na zbadaniu wybranych właściwości fizycznych następujących substancji: kwasu octowego, mąki, soli kuchennej, jodu, siarki, cukru, benzyny, miedzianej blaszki, oliwy z oliwek oraz etanolu. Zapoznaj się z problemem badawczym, hipotezą, obserwacjami oraz wnioskami wyciągniętymi z eksperymentu.
Temat:
Badanie właściwości fizykochemicznych kwasu octowego, mąki, soli kuchennej, jodu, siarki, cukru, benzyny, miedzianej blaszki, oliwy z oliwek oraz etanolu.
Problem badawczy:
Jakie właściwości fizykochemiczne posiadają: kwas octowy, mąka, sól kuchenna, jod, siarka, cukier, benzyna, miedziana blaszka, oliwa z oliwek oraz etanol? W jaki sposób można zbadać podstawowe właściwości fizykochemiczne substancji?
Hipoteza:
Do podstawowych właściwości fizykochemicznych substancji należą barwa, zapach, stan skupienia, rozpuszczalność w wodzie oraz palność. Substancje, które nas otaczają charakteryzują różnymi właściwościami fizycznymi.
Sprzęt laboratoryjny:
10 probówek – podłużne U‑kształtne naczynia szklane do przeprowadzania prostych reakcji chemicznych;
pręciki szklane (bagietki) – szklany trzonek służący do mieszania cieczy;
łyżeczki laboratoryjne – długi trzonek wykonany ze szkła, porcelany lub metalu zakończony z jednej strony łyżeczką;
pipety Pasteura – wąska rurka pobierania i przenoszenia niewielkiej ilości cieczy przy pomocy ssawki;
uniwersalne papierki wskaźnikowe – kawałki bibuły nasączone substancją będącą indykatorem, a następnie wysuszone, które umożliwiają badanie odczynu roztworu.
Odczynniki chemiczne:
kwas octowy;
mąka;
sól kuchenna;
jod;
siarka;
cukier;
benzyna;
blaszka miedziana;
oliwa z oliwek;
etanol;
woda destylowana.
Przebieg eksperymentu:
Do 10 probówek wprowadzono niewielkie ilości następujących substancji: kwasu octowego, mąki, soli kuchennej, jodu, siarki, cukru, benzyny, miedzianej blaszki, oliwy z oliwek oraz etanolu.
Następnie określono stan skupienia, barwę oraz zapach badanych substancji, a obserwacje zapisać w załączonej tabeli.
Wykorzystując uniwersalne papierki wskaźnikowe sprawdzono pH badanych substancji. Obserwację zapisano w tabeli.
Do każdej probówki wlano kilka wody, a następnie zamieszano zawartość za pomocą pręcika szklanego. Obserwacje również zapisano w tabeli.
Obserwacje:
Substancja | Stan skupienia | Barwa | Zapach | Rozpuszczalność w wodzie | pH | Palność |
|---|---|---|---|---|---|---|
kwas octowy | ciekły | bezbarwny | charakterystyczny zapach octu | bardzo dobra | około 1 | palny, niebiesko‑fioletowy płomień |
mąka | stały | biała | bezwonna | słaba | około 6 | niepalna |
sól kuchenna | stały | przeźroczysta | bezwonna | bardzo dobra | 7 | palna, żółty płomień |
jod | stały | fioletowoczarny | ostry, kłujący zapach* | słaba | nie zbadano** | niepalny, powstaje fioletowy dym |
siarka | stały | żółta | bezwonna* | trudno rozpuszczalna | nie zbadano** | palny, niebieski płomień |
cukier | stały | biały | bezwonny | bardzo dobra | 7 | palny, żółty płomień |
benzyna | ciekły | żółta | charakterystyczny, ostry zapach* | trudno rozpuszczalna | nie zbadano** | palny, żółty płomień |
blaszka miedziana | stały | pomarańczowo‑różowa | bezwonna | praktycznie nierozpuszczalna | nie zbadano** | niepalny |
oliwa z oliwek | ciekły | żółta | przyjemny, świeży zapach | trudno rozpuszczalna | nie zbadano** | palny, żółty płomień |
etanol | ciekły | bezbarwny | ostry, drażniący zapach* | bardzo dobra | 7 | palny, niebieski płomień |
*Na podstawie danych dostępnych na stronie National Center for Biotechnology Information.
**Nie zbadano – w ten sposób opisano substancje, dla których pomiar pH za pomocą uniwersalnych papierków wskaźnikowych nie ma sensu praktycznego, ponieważ służą one do badania pH, a zatem określania odczynu kwasowego, obojętnego albo zasadowego roztworów wodnych. Wskazane substancje są jednak nierozpuszczalne albo trudno rozpuszczalne w wodzie, dlatego nie zostały zbadane za pomocą uniwersalnych papierków wskaźnikowych.
Wyniki:
Do właściwości fizycznych należą stan skupienia, barwa oraz rozpuszczalność w wodzie. Substancje, które nas otaczają charakteryzują różnymi właściwościami fizycznymi.
Wnioski:
Do właściwości fizycznych należą stan skupienia, barwa oraz rozpuszczalność w wodzie. Substancje, które nas otaczają, charakteryzują się różnymi właściwościami fizycznymi.
Hipoteza została potwierdzona.
Oceń prawdziwość każdego zdania. Zaznacz Prawda, jeśli zdanie jest prawdziwe, lub Fałsz, jeśli jest fałszywe.
| Prawda | Fałsz | |
| Substancja ma charakterystyczne właściwości, które umożliwiają jej identyfikację. | □ | □ |
| Stan skupienia materii to jedna z właściwości fizycznych substancji niezależna od temperatury i ciśnienia. | □ | □ |
| Właściwości chemiczne to cechy substancji, które można określić na podstawie jej zachowania wobec innych substancji. | □ | □ |
| Woda niezależnie od ciśnienia zawsze wrze w temperaturze 100 stopni Celsjusza, czyli przechodzi ze stanu ciekłego w gazowy. | □ | □ |
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D1076sLc4
Przyjrzyj się fotografiom 1–4 i na ich podstawie określ w tabeli po jednej właściwości charakterystycznej dla każdej z substancji. Pamiętaj, że w każdym wierszu można zaznaczyć tylko jedną odpowiedź.
Na podstawie opisów zdjęć określ w tabeli po jednej właściwości charakterystycznej dla każdej z substancji. Pamiętaj, że w każdym wierszu można zaznaczyć tylko jedną odpowiedź.
Uczniowie w grupach mieli zbadać właściwości wybranych substancji. Informacje z kart pracy zestawiono w tabeli.
Grupa I | Gaz, bezbarwny, bezwonny; ma gęstość najmniejszą spośród wszystkich gazów; podczas jego spalania powstaje woda. |
Grupa II | Ciało stałe, kruche; rozpuszczalne w wodzie; o gęstości 1,587 g/cm³ i temperaturze topnienia 184°C. |
Grupa III | Ciało stałe, bezwonne; barwy żółtej; nie przewodzi prądu elektrycznego; w reakcji ze srebrem tworzy substancję stałą o czarnej barwie. |
Grupa IV | Substancja stała, barwy czarnej; pod wpływem jej ogrzewania wydziela się m.in. woda. |
Która z grup określiła wyłącznie właściwości fizyczne? Wybierz prawidłową odpowiedź.
Uczniowie w grupach badali przewodnictwo elektryczne wybranych substancji. Informacje zapisali w kartach pracy w postaci tabeli.
Substancja | Obserwacje |
|---|---|
siarka | żarówka nie świeci się |
cukier | żarówka nie świeci się |
mąka | żarówka nie świeci się |
sól | żarówka nie świeci się |
miedź | żarówka świeci się |
żelazo | żarówka świeci się |
Spośród odpowiedzi wybierz te, które są wnioskami z doświadczenia, sformułowanymi na podstawie danych z tabeli.
Podsumujmy najważniejsze informacje

Słownik
cechy substancji, które można zaobserwować podczas reakcji chemicznych
cechy substancji nie związane z reakcjami chemicznymi




