Środki czyszczące i ich wpływ na środowisko
W życiu codziennym stosuje się często środki czyszczące, które nie są mydłami, ale spełniają podobną jak mydła rolę w procesach mycia i prania – wytwarzają pianę, usuwają brud. Związki te są nazywane detergentami. Co odróżnia detergenty od mydeł? Jakie inne związki chemiczne są wykorzystywane jako środki czyszczące? Co warto o nich wiedzieć, aby szybko, sprawnie i skutecznie zadbać o czystość i porządek?
co to są mydła i jakie mają właściwości;
na czym polega mechanizm działania mydła podczas mycia;
jak działają substancje powierzchniowo czynne.
co to są detergenty i jakie mają właściwości oraz jakie jest ich zastosowanie;
na czym polega zjawisko eutrofizacji, jakie są jego przyczyny i jak można mu zapobiegać;
jakie są główne składniki środków czyszczących, jakie mają właściwości oraz jak bezpiecznie i skutecznie stosować je w codziennym życiu.
1. Detergenty
DetergentyDetergenty to związki chemiczne, które współcześnie częściej niż mydła są wykorzystywane do mycia i prania. Związki te mają budowę podobną do mydeł, zbudowane są z części polarnej oraz niepolarnej i spełniają podobną jak mydła rolę w procesach mycia i prania – wytwarzają pianę, usuwają brud. Charakteryzują się dodatkowo pewnymi właściwościami, które sprawiają, że ich stosowanie jest korzystniejsze – między innymi zachowują doskonałe właściwości myjące i pieniące bez względu na stopień twardości wody.
Nazwa detergent pochodzi od łacińskiego słowa detergens – czyszczący.
W jaki sposób detergenty działają na wodę?
Detergenty, podobnie jak mydła, obniżają napięcie powierzchniowe wody.
dwie zlewki,
woda,
roztwór detergentu, np. płynu do mycia naczyń,
roztwór mydła,
mielony cynamon (lub mielony pieprz bądź papryka).
Do obu zlewek wlej wodę (ok. ¾ objętości).
Na powierzchnię wody w każdej zlewce nasyp trochę cynamonu.
Zanurz palec w roztworze mydła i delikatnie dotknij powierzchni wody w jednej ze zlewek. Obserwuj, co się dzieje.
Próbę powtórz, używając roztworu detergentu.
Można zaobserwować, że warstwa cynamonu (proszku) unosi się i pokrywając całą powierzchnię wody, „rozrywa się”. Dzieje się tak dlatego, że detergent obniża napięcie powierzchniowe wody, przez co błona tworząca się na powierzchni wody rozpada się. Obserwacje wskazują, że mydło i detergent w podobny sposób oddziałują z wodą.
Podobnie jak mydła, detergenty wpływają na obniżenie napięcia powierzchniowego wody, czyli są związkami powierzchniowo‑czynnymi. Detergenty nie tworzą jednak z jonami magnezu i wapnia osadów, ponieważ ich sole są rozpuszczalne. Detergenty (tak jak mydła) mają długie niepolarne łańcuchy węglowodorowe (ogony) związane z polarnymi grupami (głowami).
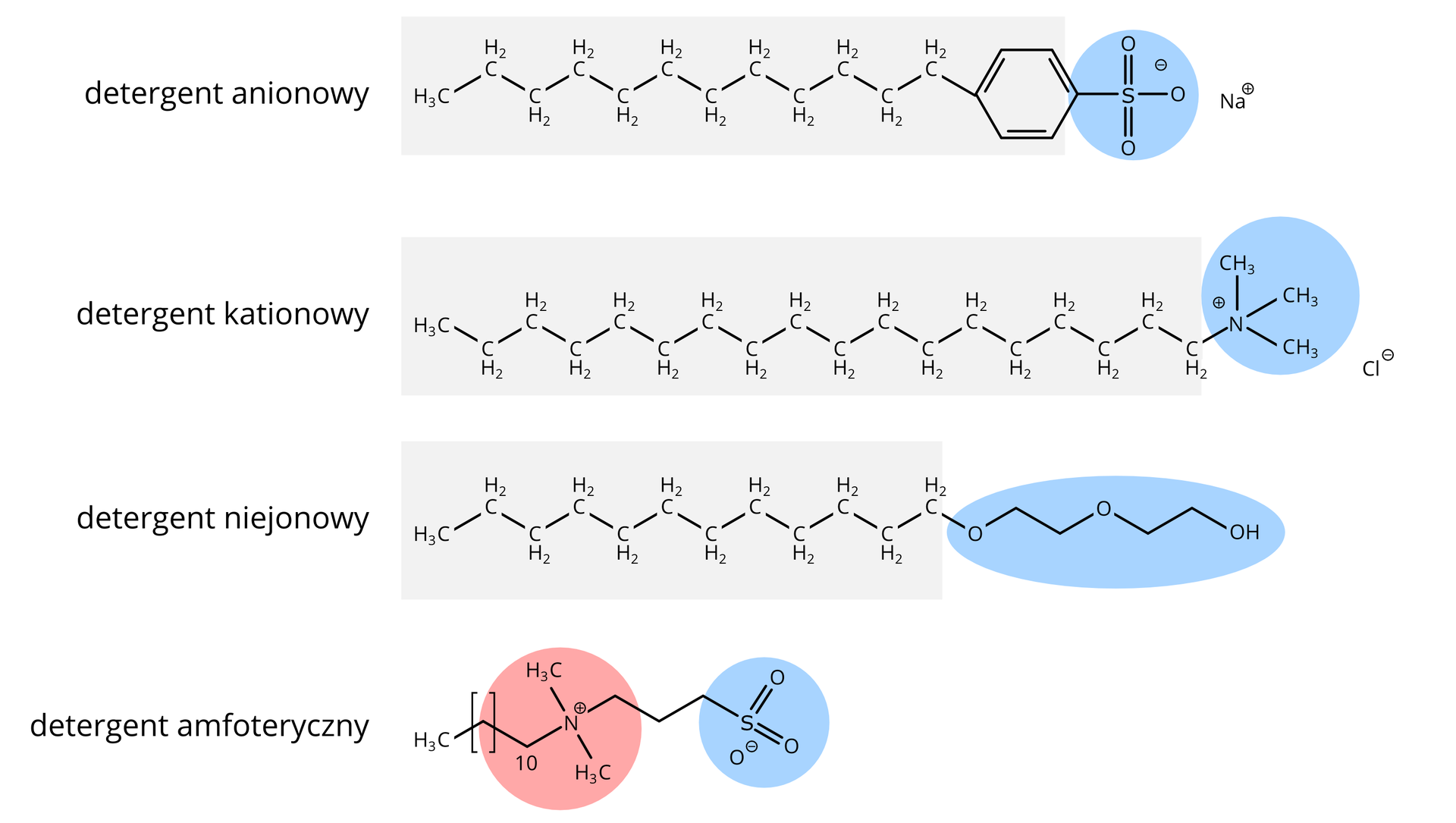
Roztwory wodne detergentów są mniej podatne na zmiany pH – takie właściwości mają detergenty anionowe, z ujemnie naładowanymi siarczanowymi grupami funkcyjnymi.
Detergenty kationowe wykazują często działanie bakteriobójcze, a ich zdolność do zmieniania powierzchniowego pH wykorzystuje się w produkcji płynów zmiękczających i odżywek do włosów.
W detergentach amfoterycznych w części aktywnej powierzchniowo (głowie) mogą być są obecne ładunki dodatnie i ujemne.
W detergentach niejonowych cześć hydrofilowa nie ma ładunku, lecz wykazuje właściwości polarne.
Detergenty są składnikami używanych powszechnie preparatów do mycia (szampony, płyny do kąpieli), prania (proszki, żele) i czyszczenia (płyny, mleczka do czyszczenia), dlatego produkcja detergentów stanowi jedną z podstawowych gałęzi przemysłu chemicznego. Detergenty dostępne w sprzedaży są mieszaninami. Większość z nich zawiera różne dodatki, takie jak wypełniacze (do zwiększenia objętości), środki zmniejszające pienienie oraz środki wybielające.
Szampony do włosów
Szampon, którego podstawową funkcją jest usuwanie z włosów i skóry głowy łoju i brudu, wykazuje doskonałe właściwości myjące. W przeciwieństwie do mydła jego działanie jest efektem takich składników, jak związki powierzchniowo czynne, stabilizatory piany, substancje zapachowe, koloryzujące, konserwujące itp. Detergenty – podstawowe składniki szamponów, są tak dobrane, aby doskonale usuwały brud z włosów i skóry, dobrze się pieniły oraz zachowały swoją funkcjonalność bez względu na stopień twardości wody.
Najczęściej stosowanymi w szamponach związkami powierzchniowo czynnymi są siarczany(VI) węglowodorów zawierających w łańcuchu od 10 do 18 atomów węgla, np.: bardzo popularny dodecylosiarczan(VI) sodu (laurylosiarczan(VI) sodu) – sól sodowa estru o wzorze: .
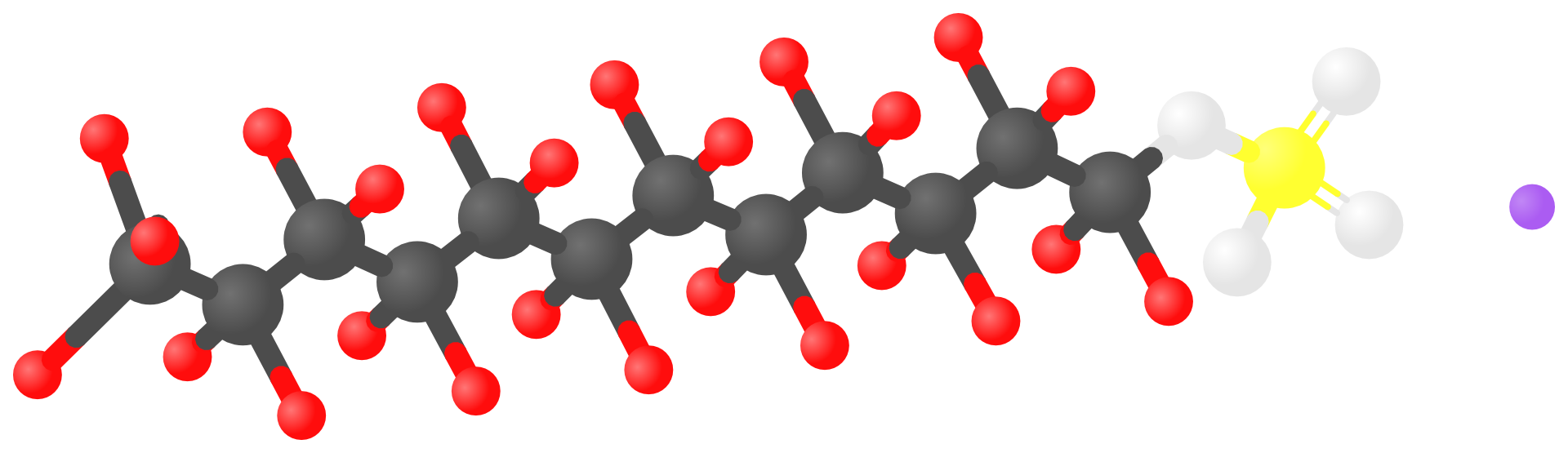
Zastanów się, jakie informacje o charakterze laurylosiarczanu(VI) sodu możesz odczytać, analizując model struktury tego związku. Czy potrafisz wyróżnić hydrofobowy ogon i hydrofilową głowę? Do jakiej grupy należy ten związek – do detergentów kationowych czy anionowych?
Jakie jony powstają w roztworze tego detergentu?
Związki te mają doskonałe właściwości pieniące (nawet w bardzo twardej wodzie) i łatwo dają się spłukać z włosów. Nic więc dziwnego, że podczas mycia włosów sięgamy po szampon, a nie po mydło.
Proszki do prania
Głównym składnikiem proszków do prania są detergenty, które usuwają większość brudu. Oprócz detergentów proszki do prania zawierają także środki zmiękczające wodę, wybielacze i enzymy.
Środki zmiękczające wodę mają zapobiegać strącaniu się trudno rozpuszczalnych soli wapnia i magnezu. Dawniej to tego celu używano związku o nazwie heksametafosforan sodu, którego działanie na środowisko okazało się szkodliwe. Obecnie jako substancje zmiękczające wodę stosowane są zeolity, pozwalające zmniejszyć ilość dodawanych do proszków fosforanów(V).
ZeolityZeolity to glinokrzemiany metali z 1. i 2. grupy wyróżniające się niezwykłą porowatą strukturą, a przez to unikalnymi właściwościami. Przykładem działania zeolitów jest usuwanie jonów wapnia z twardej wody. Dzięki swojej niezwykłej zdolności wymiany jonów zeolity wymieniają jony sodowe na jony wapnia (wychwytują je i zatrzymują w swoich porach). W ten sposób usuwają je z wody i woda staje się miękka.

Zeolity
Niektóre zeolity są tak bardzo porowate, że ich próbka o masie jednego grama może mieć powierzchnię styku o wielkości 1,5 tysiąca mIndeks górny 22 (czyli ok. dwóch boisk do piłki nożnej).
Nowoczesne proszki do prania zawierają w swoim składzie enzymy (biokatalizatory). Dzięki enzymom proszki mają zdolność szybkiego rozkładania związków pochodzenia organicznego tworzących plamy na ubraniach i powinny usuwać zabrudzenia z soków, jajka, krwi, trawy (zawierające w swoim składzie białka).
W skład enzymatycznych proszków do prania wchodzą najczęściej enzymy rozkładające białka (proteazy) oraz cukry (np. amylaza, celulaza) i tłuszcze (lipazy).
Czy działanie proszku enzymatycznego różni się od działania proszku niezawierającego enzymów?
Dodatek enzymów znacząco wpływa na skuteczność działania proszku w przypadku zabrudzenia substancjami białkowymi.
trzy zlewki,
woda,
jajko ugotowane na miękko,
proszek zawierający enzymy,
proszek niezawierający enzymów,
2 łyżeczki.
Przygotuj dwie zlewki z ciepłą wodą.
Do jednej zlewki nasyp łyżeczkę proszku enzymatycznego i zamieszaj, aż do rozpuszczenia. Do drugiej nasyp proszek niezawierający enzymów. Zamieszaj.
Przetnij jajko na pół.
Zanurz łyżeczkę w żółtku, tak aby żółtko przylepiło się do niej. Podobnie postępuj z drugą łyżeczką.
Włóż łyżeczki do przygotowanych wcześniej zlewek z roztworem proszku i odstaw na kilka minut. Obserwuj zachodzące zmiany.

Proteazy (enzymy) zawarte w proszku tną (rozkładają) białka na mniejsze fragmenty, które są rozpuszczalne w wodzie.
Wybielacze usuwają żółtawe lub szarawe zabarwienie długo używanych białych tkanin. Bezpośrednim czynnikiem wybielającym jest aktywna forma tlenu , która podczas prania jest uwalniana z odpowiednich składników proszku.
W proszkach do prania stosowane są, jako wybielacze, nadtlenek wodoru , nadtlenowęglan sodu lub odmiana boraksu – nadtlenoboran sodu, w którym jedna cząsteczka wody hydratacyjnej została zastąpiona cząsteczką nadtlenku wodoru.
Tlen atomowy uwalnia się z cząsteczki nadtlenku wodoru:
*Nadtlenowęglan sodu, mający postać białego proszku, rozkłada się w wodzie, gdzie jest źródłem aktywnego tlenu, a pozostałymi produktami są nieszkodliwe związki – węglan sodu i woda. Proces ten przebiega w dwóch etapach:
W przypadku nadtlenoboranu sodu proces rozkładu zachodzi dopiero w temperaturze 95°C. Dodanie do proszku substancji o nazwie TEAD (tetraacetylenodiamina) powoduje, że wspomniany rozkład przebiega w temperaturach niższych – ok. 40°C, co pozwala na stosowanie proszków z efektem wybielania także do prania tkanin syntetycznych.
Preparaty do mycia naczyń
Płynów do mycia naczyń używa się głównie do mycia ręcznego – usuwania brudu i resztek posiłku z naczyń kuchennych, zastawy stołowej i sztućców. Oprócz skuteczności środki te powinny wykazywać braki negatywnego wpływu na skórę rąk. Nie powinny również pozostawiać zacieków na szklanych naczyniach. Podstawowymi składnikami płynów do mycia naczyń są związki powierzchniowo czynne (5–15%) i woda. W ich skład wchodzą także anionowe związki powierzchniowo czynne wspomagające usuwanie tłuszczu, stabilizatory piany, enzymy, regulatory twardości wody (fosforany(V), krzemiany), gliceryna lub lanolina do ochrony skóry dłoni, etanol, chlorek sodu, kwas octowy.
Głównymi składnikami preparatów (proszki, kapsułki) przeznaczonych do mycia naczyń w zmywarkach są związki sodu – fosforany(V) i krzemiany. W wyniku reakcji krzemianu sodu z wodą powstaje wodorotlenek sodu, który bierze udział w reakcji zmydlania tłuszczu (głównego składnika brudu).
Produkty reakcji zmydlania tłuszczu są wypłukiwane przez silny strumień wody w zmywarce.
Do ręcznego zmywania naczyń nie można używać środków przeznaczonych do zmywarek, ponieważ zawierają składniki, które w reakcji z wodą tworzą roztwór silnie żrący.
2. Inne środki czyszczące
Środki do mycia szkła
Szkło cechuje się niewielką odpornością na zarysowania, dlatego środki do mycia szkła (okien, luster) mają zazwyczaj postać roztworu surfaktantów w wodzie i nie zawierają substancji ściernych. Natomiast w ich skład wchodzą związki lotne (łatwo parujące), np. amoniak , kwas octowy (etanowy) lub etanol , które mają zapobiegać powstawaniu smug.
Preparaty do udrażniania rur
Głównym składnikiem środków do udrażniania rur jest wodorotlenek sodu lub/i potasu w postaci granulek bądź stężonego roztworu. Związek ten ma właściwości żrące oraz wchodzi w reakcję z tłuszczem (zmydlanie tłuszczów), skutecznie likwidując powstające w rurach zatory.
Podczas stosowania preparatów zawierających , ze względu na silne właściwości żrące, należy używać rękawic ochronnych.
Nie wolno wlewać wrzątku do zatkanej rury z preparatem do udrażniania, gdyż może to skutkować gwałtowną reakcją i wypryśnięciem żrącego roztworu, który może spowodować niebezpieczne uszkodzenia ciała.
Metody czyszczenia metali
Przed użyciem wszelkich środków czyszczących trzeba zapoznać się z podanymi na etykiecie informacjami dotyczącymi składu i zasad bezpiecznego ich używania. Preparaty czyszczące należy przechowywać z dala od dzieci. Podczas używania tych, które zawierają substancje toksyczne, drażniące lub żrące, należy unikać rozpryśnięcia, potarcia oczu, kontaktu ze skórą.

Film dostępny na portalu epodreczniki.pl
Jak bezpiecznie używać środków czyszczących?
3. Wpływ środków czyszczących na środowisko przyrodnicze
Detergenty oraz inne składniki środków piorących i czyszczących mogą mieć działanie szkodliwe dla środowiska przyrodniczego. Szczególnie uciążliwe dla środowiska są dodawane do detergentów fosforany(V), które przedostają się wraz ze ściekami komunalnymi do wód, zanieczyszczając je i powodując ich eutrofizację.
EutrofizacjaEutrofizacja polega na intensywnym rozwoju roślin i mikroorganizmów wodnych wskutek wzrostu zawartości składników odżywczych w wodzie, głównie jonów fosforanowych(V), pochodzących ze ścieków zanieczyszczonych środkami myjącymi i czyszczącymi. Początkowo jest to zjawisko korzystne, sprzyjające zwiększeniu populacji ryb w jeziorach i rzekach. Jednak w kolejnych etapach przestaje być pozytywne. W zbiornikach wodnych dochodzi do silnego rozwoju glonów i tzw. zakwitu wód. Utrudnienie dostępu światła do niższych warstw wody powoduje zahamowanie wzrostu roślin żyjących w głębszych warstwach zbiornika. Proces obumierania i gnicia glonów sprawia, że zawartość tlenu w wodzie obniża się, co zmniejsza populację wielu gatunków roślin i zwierząt. Stopniowo może następować zarastanie zbiornika wodnego i przekształcenie go w bagno. Dlatego bardzo ważne jest racjonalne stosowanie przez człowieka środków czyszczących oraz poszukiwanie nowych produktów, które nie będą stwarzały takich zagrożeń. Coraz częściej w sprzedaży znajdują się już środki czyszczące bez fosforanów(V), które zawierają związki ulegające biodegradacji w oczyszczalniach ścieków. Kupując te preparaty, możemy okazać swoją troskę o środowisko.
*Związki fosforu są jednymi z bardziej uciążliwych dla środowiska naturalnego. Niezwykle ważne jest usuwanie ich ze ścieków odprowadzanych do rzek, aby zapobiec pogarszaniu jakości wody, a nawet zanikowi życia w środowisku wodnym. Fosfor może być usuwany ze ścieków metodami strąceniowymi i biologicznymi. Do strącania fosforanów używa się np. siarczanów(VI) glinu i żelaza.
Metody biologiczne polegają na wykorzystaniu bakterii, które w warunkach tlenowych pobierają fosfor i przetwarzają go na polifosforany. Związany fosfor wbudowuje się w komórki bakterii i jest usuwany razem z biomasą. Proces ten odbywa się w bioreaktorach, które są częścią systemu w mechaniczno‑biologicznych oczyszczalniach ścieków. Warunkiem biologicznego usuwania fosforu jest poddawanie osadu czynnego na zmianę warunkom tlenowym i beztlenowym. W warunkach beztlenowych bakterie fosforowe pozbywają się ze swoich komórek fosforu. Podczas tego procesu uwalnia się energia, zużywana przez te bakterie do pobierania ze ścieków łatwo przyswajalnych wysokoenergetycznych związków organicznych. Następnie w strefie tlenowej bioreaktora bakterie fosforowe pobierają duże ilości fosforu, gromadząc go w swoich komórkach. Ilość pobranego fosforu w warunkach tlenowych jest znacznie większa od ilości fosforu usuniętego z komórek bakterii w warunkach beztlenowych. Usuwając ze ścieków biomasę osadu czynnego zawierającą bakterie, jednocześnie usuwa się zgromadzony w ich komórkach fosfor. W ten sposób obniża się jego ilość w ściekach.

Podsumowanie
Detergenty syntetyczne (podobnie jak mydła) są substancjami powierzchniowo czynnymi, przez co pozwalają na skuteczne usuwanie brudu w procesach mycia i prania.
Obecnie do mycia i czyszczenia używa się wiele rodzajów preparatów. Ich starannie dobrany skład ma gwarantować skuteczność działania.
Niektóre ze środków czyszczących mają właściwości żrące bądź drażniące. Dlatego należy uważnie czytać instrukcje i podczas stosowania zachować wskazane środki ostrożności, np.: stosować rękawice ochronne.
Nawet małe stężenie detergentów i innych składników środków czyszczących w zbiornikach wodnych utrudnia proces oczyszczania wody, a zwłaszcza sedymentację zawiesin, co jest przyczyną degradacji środowiska przyrodniczego, dlatego dąży się do tego, aby stosowane detergenty były biodegradowalne.
Zaprojektuj doświadczenie, mające na celu zbadanie wpływu fosforanów(V) na rozwój roślin, np. rzeżuchy. Przygotuj opis doświadczenia oraz arkusz obserwacji. Przeprowadź zaplanowany eksperyment, zapisz obserwacje i sformułuj wnioski.
Do wyczyszczenia zardzewiałego przedmiotu można użyć napoju typu cola. Napisz cząsteczkowe równania reakcji chemicznych między tlenkami żelaza(II) żelaza(III) zawartymi w rdzy a kwasem fosforowym(V), wchodzącym w skład napoju typu cola. Podaj nazwy produktów reakcji oraz korzystając z tablicy rozpuszczalności, określ ich rozpuszczalność w wodzie.
Słowniczek
syntetyczne substancje powierzchniowo czynne (zmniejszające napięcie powierzchniowe wody)
proces prowadzący do nadmiernego przyrostu materii organicznej w zbiornikach wodnych; do rozwoju eutrofizacji przyczyniają się fosforany(V) trafiające do wód wraz ze ściekami z gospodarstw domowych
glinokrzemiany metali z 1. i 2. grupy, wyróżniające się niezwykłą porowatą strukturą; charakteryzują się unikalną zdolnością wymiany jonów; przykładem działania zeolitów jest usuwanie jonów wapnia z twardej wody
Zadania
Połącz nazwy środków czyszczących z nazwami ich głównych składników oraz z informacjami o ich działaniu.
wodorotlenek sodu – powoduje zmydlanie tłuszczów, chloran(I) sodu – ma właściwości bakteriobójcze, roztwór amoniaku – usuwa tłuste plamy, kwas octowy (etanowy) – roztwarza kamień kotłowy, zeolity – zmiękczają wodę
| środek do udrażniania rur | |
| płyn do mycia szyb | |
| odkamieniacz | |
| żel do mycia toalet | |
| proszek do prania |
Połącz nazwy środków czyszczących z podanymi przez producenta na etykiecie opisami ich składu.
SKŁAD:<br>5–15% anionowe środki powierzchniowo czynne <br>> 5% niejonowe środki powierzchniowo czynne<br>gliceryna<br>kompozycja zapachowa, SKŁAD:<br>< 30% związki wybielające na bazie tlenu<br>> 5% anionowe środki powierzchniowo czynne<br>niejonowe środki powierzchniowo czynne <br>zeolity<br>enzymy<br>rozjaśniacz optyczny, SKŁAD:<br> 30% fosforany(V) <br>5–15% niejonowe środki powierzchniowo czynne<br>związki wybielające na bazie tlenu<br>polikarboksylany <br>enzymy<br>kompozycja zapachowa, SKŁAD:<br>5–15% zeolity<br>> 5% anionowe środki powierzchniowo czynne <br>niejonowe środki powierzchniowo czynne <br>polikarboksylany<br>enzymy<br>kompozycja zapachowa
| wybielający odplamiacz do tkanin | |
| proszek do prania tkanin kolorowych | |
| płyn do mycia naczyń | |
| kapsułki do zmywarek automatycznych |
Przeprowadzono badanie stężenia fosforanów(V) w wodach gruntowych w dwóch punktach pomiarowych – nr 1 i 2. Przeanalizuj dane z tabeli. Wykonaj potrzebne obliczenia i zaznacz poprawne stwierdzenia.
Punkt poboru | Stężenie fosforanów(V) [mg/dmIndeks górny 33] | |||
czerwiec 2009 | lipiec 2009 | wrzesień 2009 | listopad 2009 | |
Nr 1 | 1,56 | 1,47 | 8,44 | 3,50 |
Nr 2 | 0,18 | 2,04 | 2,20 | 1,08 |
| Prawda | Fałsz | |
| Najwyższe stężenia fosforanów(V) zanotowano w punkcie poboru nr 2 w listopadzie. | □ | □ |
| Maksymalną wartość stężenia zaobserwowano we wrześniu w punkcie nr 1. | □ | □ |
| Maksymalne wartości stężeń tych związków wystąpiły we wrześniu, czyli poza sezonem wegetacyjnym roślin. | □ | □ |
| Próbka o objętości 5 pobrana w punkcie nr 1 w czerwcu zawierała 0,078 mg fosforanów(V). | □ | □ |
| Próbka o objętości 5 pobrana w punkcie nr 1 w czerwcu zawierała 0,00156 mg fosforanów(V). | □ | □ |






