Jak interpretować zapisy chemiczne?
Chemicy na całym świecie potrafią porozumiewać się bez słów, ponieważ wszyscy władają jednym wspólnym językiem chemicznym. Opiera się on na znajomości symboli pierwiastków chemicznych, wzorów związków chemicznych, cząsteczek i innych drobin, a także zapisie równań reakcji, czyli przede wszystkim na interpretacji różnych zapisów chemicznych. W tym materiale przeczytasz między innymi, jaka jest różnica między zapisami: , , , czy , oraz nauczysz się, w jaki sposób interpretujemy równania reakcji chemicznych.
Symbole chemiczne to międzynarodowe skróty łacińskich nazw pierwiastków chemicznych, składające się z pierwszej litery i czasami kolejnych liter nazwy. Symbole te stosuje się do zapisu substancji prostych, czyli pierwiastków chemicznych, ale również do zapisu wzorów związków chemicznych. Posługujemy się przy tym przede wszystkich wzorami sumarycznymi oraz wzorami elektronowymiwzorami elektronowymi bądź strukturalnymistrukturalnymi.
Interpretując różne zapisy chemiczne, należy pamiętać o kilku regułach:
Pojedynczy symbol pierwiastka interpretujemy jako jeden atom, np.:
– atom wodoru;
– atom sodu;
– atom ołowiu;
– atom tlenu;
– atom azotu.
Jeżeli przed pojedynczym symbolem pierwiastka chemicznego występuje liczba (współczynnik stechiometrycznywspółczynnik stechiometryczny), to jest to liczba atomów tego pierwiastka, np.:
– dwa atomy wodoru;
– pięć atomów potasu;
– trzy atomy chromu;
– dwa atomy helu;
– dziesięć atomów węgla.
Niektóre niemetale w stanie wolnym w przyrodzie występują jako cząsteczki homojądrowe. Są to między innymi: wodór, tlen, azot, fluor, chlor, brom, jod, tlen, siarka oraz fosfor. W równaniach reakcji chemicznych zapisujemy zatem czasami symbol pierwiastka chemicznego wraz z indeksem dolnym (indeksem stechiometrycznymindeksem stechiometrycznym), informującym o liczbie atomów budujących daną cząsteczkę. Powstają wówczas wzory sumarycznewzory sumaryczne cząsteczek, które wskazują, jakie atomy i w jakiej liczbie są zawarte w danej cząsteczce.
Interpretujemy je wówczas następująco:
– (dwuatomowa) cząsteczka wodoru
Jedna (dwuatomowa) cząsteczka wodoru jest zbudowana z dwóch atomów wodoru.– (dwuatomowa) cząsteczka tlenu
Jedna (dwuatomowa) cząsteczka tlenu jest zbudowana z dwóch atomów tlenu.– (dwuatomowa) cząsteczka azotu
Jedna (dwuatomowa) cząsteczka azotu jest zbudowana z dwóch atomów azotu.– (dwuatomowa) cząsteczka fluoru
Jedna (dwuatomowa) cząsteczka fluoru jest zbudowana z dwóch atomów fluoru.– (dwuatomowa) cząsteczka chloru
Jedna (dwuatomowa) cząsteczka chloru jest zbudowana z dwóch atomów chloru.– (dwuatomowa) cząsteczka bromu
Jedna (dwuatomowa) cząsteczka bromu jest zbudowana z dwóch atomów bromu.– (dwuatomowa) cząsteczka jodu
Jedna (dwuatomowa) cząsteczka jodu jest zbudowana z dwóch atomów jodu.– (ośmioatomowa) cząsteczka siarki
Jedna (ośmioatomowa) cząsteczka siarki jest zbudowana z ośmiu atomów siarki.– (czteroatomowa) cząsteczka fosforu
Jedna (czteroatomowa) cząsteczka fosforu jest zbudowana z czterech atomów fosforu.
W cząsteczkach tych atomy połączone są trwale za pomocą wiązań kowalencyjnych, co można przedstawić, używając wzorów strukturalnych oraz elektronowych (uwzględniających niewiążące pary elektronowe).
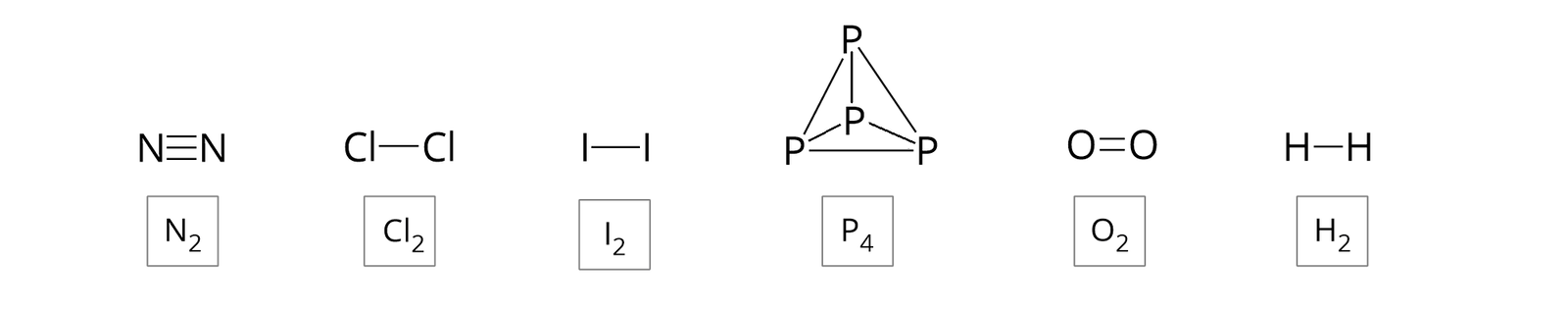
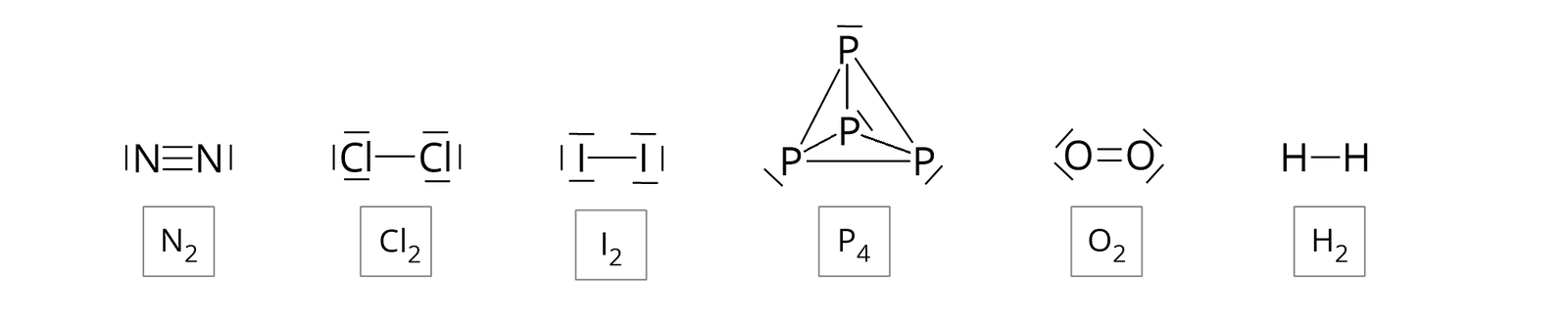
Jeżeli przed wzorem sumarycznym danej cząsteczki występuje liczba, to zapis interpretujemy następująco:
– trzy (dwuatomowe) cząsteczki chloru;
– dwie (czteroatomowe) cząsteczki fosforu;
– cztery (dwuatomowe) cząsteczki wodoru.
We wzorach sumarycznych związków chemicznych liczba atomów każdego pierwiastka jest zapisana jako indeks dolny. Gdy występuje tylko jeden atom danego pierwiastka, indeks dolny jest pomijany.
W jaki sposób interpretujemy wzory sumaryczne kowalencyjnych związków chemicznych?
Kowalencyjne związki chemiczne, czyli takie, w których pomiędzy atomami występują wyłącznie wiązania kowalencyjne, tworzą cząsteczki. Należą do nich przede wszystkim kwasy, wodorki niemetali oraz tlenki niemetali, np.:
– cząsteczka tlenku węgla()
Jedna cząsteczka tlenku węgla() składa się z jednego atomu węgla i dwóch atomów tlenu, połączonych za pomocą wiązań kowalencyjnych.
Uwaga! Pomimo tego, że tlen w przyrodzie występuje jako cząsteczka , złożona z dwóch atomów tlenu, połączonych za pomocą wiązań kowalencyjnych, to w cząsteczce tlenku węgla() nie występuje takie połączenie. Atomy tlenu połączone są wiązaniami kowalencyjnymi z atomem węgla.
– cząsteczka kwasu siarkowego()
Jedna cząsteczka kwasu siarkowego() jest złożona z dwóch atomów wodoru, jednego atomu siarki i czterech atomów tlenu, połączonych za pomocą wiązań kowalencyjnych.
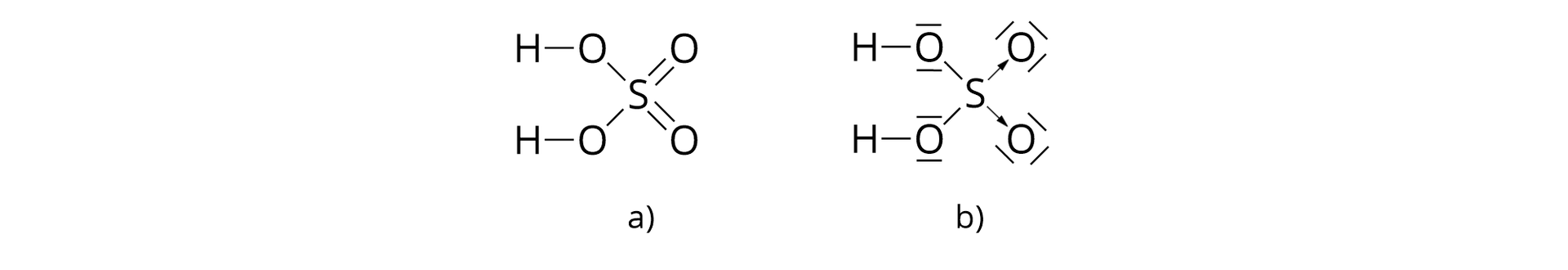
*Wiązanie oznaczone strzałką to wiązanie donorowo–akceptorowe, czyli koordynacyjne, o którym dowiesz się więcej w dalszych etapach nauki.
– cząsteczka bromowodoru
Jedna cząsteczka bromowodoru jest złożona z jednego atomu wodoru i jednego atomu bromu, połączonych za pomocą wiązania kowalencyjnego.

– cząsteczka kwasu azotowego()
Jedna cząsteczka kwasu azotowego() jest złożona z jednego atomu wodoru, jednego atomu azotu i dwóch atomów tlenu.
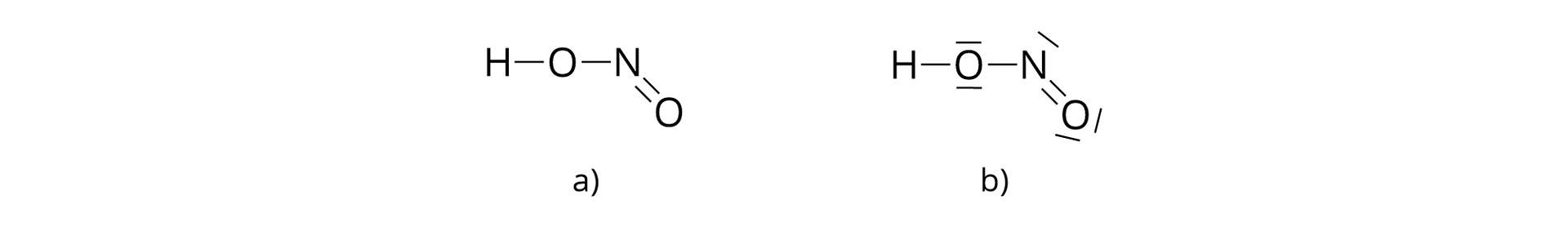
– cząsteczka amoniaku
Jedna cząsteczka amoniaku jest złożona z jednego atomu azotu i trzech atomów wodoru, połączonych za pomocą wiązań kowalencyjnych.
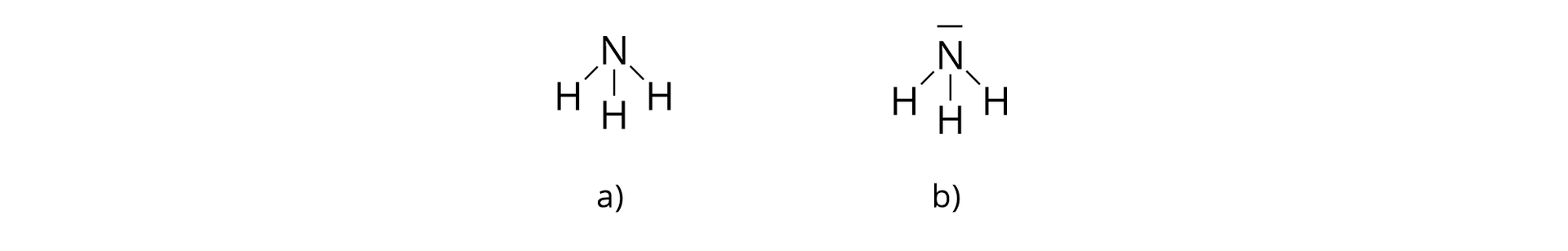
Jeżeli przed daną cząsteczką występuje liczba (współczynnik stechiometryczny), to interpretujemy zapis następująco:
– dwie cząsteczki kwasu fosforowego(),
– trzy cząsteczki tlenku siarki(),
– cztery cząsteczki wody,
– pięć cząsteczek kwasu metanowego.
Liczba atomów wodoru:1. , 2. , 3. , 4. , 5. , 6. , 7.
W jaki sposób interpretujemy wzory sumaryczne jonowych związków chemicznych?
Jonowe związki chemiczne nie tworzą cząsteczek, lecz stanowią zbiory jonów, które są związane za pomocą wiązań jonowych. Ułożone naprzemiennie jony tworzą uporządkowane struktury krystaliczne. Wzór sumaryczny związku jonowego przedstawia zatem najmniejszy zbiór powtarzających się jonów w krysztale.
Do jonowych związków chemicznych należy między innymi większość soli, tlenków metali i wodorotlenków. W jaki sposób zatem interpretować wzory sumaryczne związków jonowych?
– zbiór jonów, w którym na jeden kation sodu () przypada jeden anion bromkowy ()
– zbiór jonów, w którym na dwa kationy potasu () przypada jeden anion siarczanowy() ()
– zbiór jonów, w którym na jeden kation wapnia () przypada jeden anion tlenkowy ()
– zbiór jonów, w którym na dwa kationy litu () przypada jeden anion tlenkowy ()
– zbiór jonów, w którym na jeden kation magnezu () przypadają dwa aniony wodorotlenkowe ()
– dwa zbiory jonów, w których na jeden kation sodu () przypada jeden anion wodorotlenkowy ()
– sześć zbiorów jonów składających się z trzech kationów
wapnia () i dwóch anionów fosforanowych() () lub zbiór jonów złożony z osiemnastu kationów wapnia () i dwunastu anionów fosforanowych()
()
Liczba anionów siarczanowych():1. , 2. , 3. , 4. , 5. , 6. , 7.
Ponieważ związki jonowe nie tworzą cząsteczek, lecz zbiory jonów – kationów i anionów, to ma to również odzwierciedlenie we wzorach elektronowych. Wiązanie jonowe powstaje, gdy jeden z atomów (atom metalu) oddaje elektrony walencyjne drugiemu atomowi (atomowi niemetalu). Oba atomy uzyskują wówczas trwałe konfiguracje elektronowe najbliższych gazów szlachetnych. Atom, który oddał elektrony walencyjne, staje się kationem, a atom, który je przyjął, staje się anionem. Poniżej przedstawiono wzory elektronowe wybranych związków jonowych.
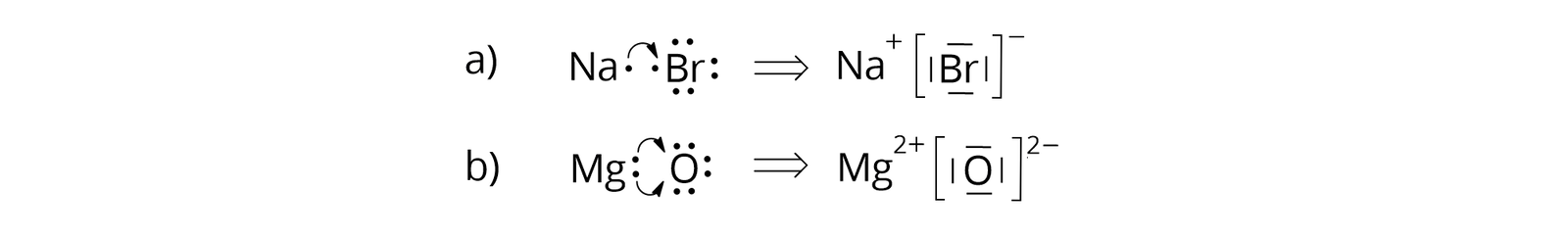
Poćwicz interpretację zapisów chemicznych
Skorzystaj z poniższego programu i potrenuj interpretację zapisów chemicznych. Pomiń na razie interpretację równań reakcji chemicznych.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DRs2jervU
Słownik
liczba umieszczana u dołu z prawej strony symbolu pierwiastka we wzorze chemicznym substancji; jest ona równa liczbie atomów tego pierwiastka w cząsteczce lub w najmniejszym zbiorze powtarzających się jonów w krysztale (tak zwanej jednostce formalnej)
liczba zapisywana przed symbolem lub wzorem chemicznym, która określa liczbę atomów, cząsteczek lub najmniejszych zbiorów powtarzających się jonów w krysztale
ilościowy zapis składu cząsteczek pierwiastków i związków chemicznych za pomocą symboli chemicznych
zapis wskazujący, w jaki sposób łączą się ze sobą atomy tworzące dany związek chemiczny; wzór elektronowy uwzględnia niewiążące pary elektronowe
ilościowy i jakościowy zapis składu cząsteczek pierwiastków i związków chemicznych za pomocą symboli chemicznych oraz wiązań chemicznych,