Metody otrzymywania soli
Poniższy materiał stanowi uzupełnienie treści zawartych w materiale: https://zpe.gov.pl/b/inne-metody-otrzymywania-soli/P125hGrRG
Czy wiesz, że jeżeli wrzucimy złoty lub srebrny pierścionek do kwasu chlorowodorowego, to nic się z nim nie stanie? W tym przypadku reakcja chemiczna nie zajdzie. Jeżeli jednak wrzucimy kawałek cynku, magnezu czy żelaza, to okaże się, że metale te roztworzą się w kwasie chlorowodorowym, a w naczyniu otrzymamy klarowne roztwory i zobaczymy pęcherzyki wydzielającego się gazu. Dzieje się tak, ponieważ metale różnią się aktywnością chemiczną, którą określa się na podstawie możliwości wypierania wodoru z roztworu kwasu. Metale, które są aktywniejsze od wodoru (np. cynk, magnez czy żelazo), będą reagowały z większością kwasów. W wyniku reakcji powstaje sól i wydziela się wodór. Jest to jedna z metod otrzymywania soli. Jakimi innymi sposobami możemy je otrzymać?
budowę soli;
podstawowe metody otrzymywania soli, np. w wyniku reakcji kwasu z wodorotlenkiem, kwasu z tlenkiem metalu, wodorotlenku z tlenkiem niemetalu;
reakcje strąceniowe, w wyniku których otrzymuje się sole.
przedstawiać równania reakcji kwasu z metalem aktywnym;
przedstawiać równania reakcji otrzymywania soli bezpośrednio z pierwiastków chemicznych;
przedstawiać równania reakcji węglanów i siarczanów(IV) z niektórymi kwasami;
przedstawiać równania reakcji tlenków metali z tlenkami niemetali;
przeprowadzać doświadczenie chemiczne polegające na otrzymaniu soli kwasu beztlenowego.
Sole to związki chemiczne, które można otrzymać, stosując wiele metod. Do najbardziej znanych należą:
W wyniku tych reakcji powstają sól oraz woda.
Do innych metod otrzymywania soli należą:
Reakcja pomiędzy metalem aktywnymmetalem aktywnym a kwasem. W jej wyniku powstaje sól i wodór. Schematycznie równanie reakcji można zapisać następująco:
Metale różnią się od siebie aktywnością chemiczną. Określamy ją na podstawie możliwości wypierania wodoru z roztworów kwasów. Aktywność chemiczną metali możemy sprawdzić w szeregu aktywności.
RHnRLUib5iE2W 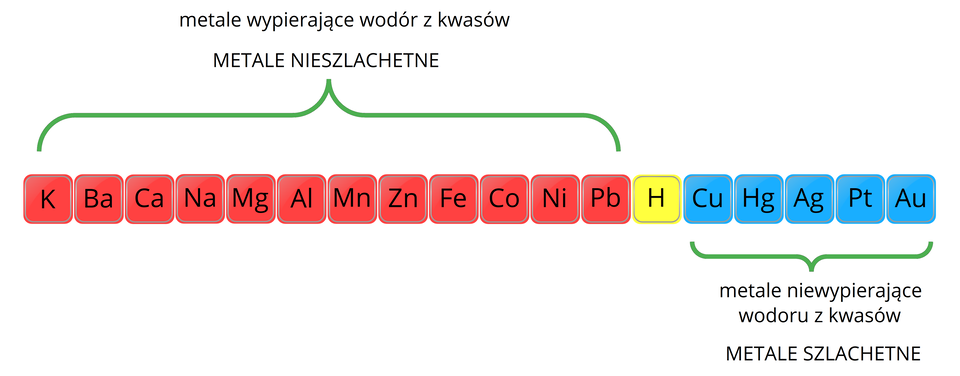 Szereg aktywności metaliŹródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Szereg aktywności metaliŹródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.Metale, które w szeregu aktywności leżą przed wodorem, wykazują wyższą aktywność chemiczną oraz niższy (bardziej ujemny) potencjał standardowy, to właśnie one będą reagowały z kwasami. Na przykład cynk reaguje z kwasem chlorowodorowym. Otrzymujemy wówczas chlorek cynku oraz wydziela się wodór, który opuszcza układ. Równanie tej reakcji zapisujemy następująco:
Jednak metale, które leżą w szeregu aktywności za wodorem, czyli wykazują niższą aktywność chemiczną oraz wyższy potencjał standardowy, nie będą reagowały z większością kwasów. Nie reagować będą też metale ulegające pasywacji. Na przykład:
Metale, które nie wypierają wodoru z kwasów, nazywamy metalami szlachetnymimetalami szlachetnymi. Nie reagują one z wieloma kwasami, jednak pod wpływem niektórych ulegają roztworzeniu (stężony kwas siarkowy(VI) oraz kwas azotowy(V)). Reakcje te nie polegają jednak na wypieraniu wodoru z tych kwasów. W wyniku reakcji otrzymujemy sole oraz charakterystyczne tlenki. Przykładem może być reakcja srebra z rozcieńczonym kwasem azotowym(V) lub reakcja miedzi ze stężonym gorącym kwasem siarkowym(VI). Równania tych reakcji zapisujemy następująco:
Reakcja pomiędzy metalem a niemetalem. W jej wyniku powstaje sól kwasu beztlenowego. Schematycznie równanie reakcji można zapisać następująco:
Reakcja ta zachodzi tylko pomiędzy niektórymi metalami a niektórymi niemetalami. Przykładami może być reakcja sodu z chlorem czy reakcja magnezu z siarką. Równania reakcji zapisujemy następująco:
Aby wyznaczyć wzór soli, należy pamiętać, jaki kwas tworzy dany niemetal. Na przykład chlor tworzy kwas chlorowodorowy o wzorze . Dlatego sól będzie zawierała resztę kwasowąresztę kwasową kwasu chlorowodorowego, czyli jon .
Reakcja pomiędzy tlenkiem metalu a tlenkiem niemetalu. W jej wyniku powstaje sól. Schematycznie równanie reakcji można zapisać następująco:
Przykładem może być reakcja pomiędzy tlenkiem wapnia a tlenkiem węgla(IV). W jej wyniku otrzymujemy węglan wapnia. Innym przykładem może być reakcja pomiędzy tlenkiem sodu a tlenkiem siarki(VI), prowadząca do otrzymania siarczanu(VI) sodu. Równania reakcji zapisujemy następująco:
Aby wyznaczyć wzór soli, należy pamiętać, od jakiego kwasu pochodzi dany tlenek niemetalu. Na przykład tlenek węgla(IV), o wzorze , pochodzi od kwasu węglowego o wzorze . Tlenek węgla(IV) będzie zatem tworzył sole, w których resztę kwasową stanowią jony .
Reakcja pomiędzy kwasem a solą. W wyniku reakcji powstaje druga sól oraz nietrwały kwas. Schematycznie równanie reakcji można zapisać następująco:
Reakcja ta zachodzi pomiędzy mocnym kwasem a solą słabego kwasu. W wyniku reakcji wyparty zostaje słabszy kwas. Na przykład:
Kwas węglowy i kwas siarkowy(IV) są nietrwałymi kwasami, które od razu rozpadają się do tlenku, od którego pochodzą, oraz wody.
Reakcja pomiędzy dwiema (dobrze rozpuszczalnymi w wodzie) solami. W jej wyniku powstają również dwie sole, przy czym jedna z nich jest trudno rozpuszczalna w wodzie. Schematycznie równanie reakcji można zapisać następująco:
Przykładem jest reakcja zachodząca pomiędzy chlorkiem sodu a azotanem(V) srebra. W jej wyniku otrzymujemy trudno rozpuszczalny w wodzie chlorek srebra oraz dobrze rozpuszczalny w wodzie azotan(V) sodu.
Wirtualne laboratorium
Zapoznaj się z możliwościami poniższego laboratorium chemicznego i zaproponuj doświadczenia, w wyniku przeprowadzenia których możesz otrzymać chlorek glinu oraz chlorek miedzi(II). Następnie zapoznaj się z problemem badawczym, sformułuj i zweryfikuj własną hipotezę. W formularzu zanotuj swoje obserwacje, wyniki oraz zapisz wnioski.
Zapoznaj się z opisem laboratorium chemicznego i zapoznaj się doświadczeniami, w wyniku których można otrzymać chlorek glinu oraz chlorek miedzi(II),. Zapoznaj się z problemem badawczym, hipotezą, obserwacjami oraz wnioskami wyciągniętymi z eksperymentu.
Temat:
Otrzymywanie bromku glinu różnymi sposobami.
Problem badawczy:
Czy bromek glinu można otrzymać, stosując pięć różnych metod?
Hipoteza:
Bromek glinu można otrzymać, stosując pięć różnych metod.
Sprzęt laboratoryjny:
probówki (x5) – podłużne naczynie szklane do przeprowadzania prostych reakcji chemicznych;
statyw – prostokątny sprzęt laboratoryjny z rzędami otworów, w których umieszczane są probówki;
łyżeczki – - długi trzonek wykonany ze szkła, porcelany lub metalu zakończony z jednej strony łyżeczką;
pipety Pasteura – wąska rurka pobierania i przenoszenia niewielkiej ilości cieczy przy pomocy ssawki.
Odczynniki chemiczne:
;
10% ;
;
;
(folia aluminiowa);
;
.
Przebieg eksperymentu:
Lub w innej kolejności
Probówka 1 ( + )
Umieszczono w probówce za pomocą pipety Pasteura 3 10% roztworu kwasu bromowodorowego, a następnie dodano 1 g wodorotlenku glinu.
Probówka 2 ( + )
Umieszczono w probówce za pomocą pipety Pasteura 3 10% roztworu kwasu bromowodorowego, a następnie dodano 1 g folii aluminiowej (zwiniętej w kulkę).
Probówka 3 ( + )
Umieszczono w probówce za pomocą pipety Pasteura 3 10% roztworu kwasu bromowodorowego, a następnie dodano 1 g tlenku glinu.
Probówka 4 ( + )
Umieszczono w probówce za pomocą pipety jednorazowej 3 bromu, a następnie dodano 2 g folii aluminiowej.
Probówka 5 ( + )
Umieszczono w probówce za pomocą pipety jednorazowej 3 siarczanu(VI) glinu, a następnie dodano 3 bromku baru.
Obserwacje:
Lub w innej kolejności
Probówka 1 ( + ) – ciało stałe roztwarza się i powstaje klarowny, bezbarwny roztwór.
Probówka 2 ( + ) – folia aluminiowa roztwarza się i powstaje klarowny, bezbarwny roztwór. Wydzielają się pęcherzyki bezbarwnego gazu.
Probówka 3 ( + ) – ciało stałe roztwarza się i powstaje klarowny, bezbarwny roztwór.
Probówka 4 (+ ) – zawartość probówki zapala się. Po zakończeniu reakcji na dnie probówki widoczny jest biały osad.
Probówka 5 ( + ) – wytrąca się biały osad.
Wyniki:
Lub w innej kolejności
Probówka 1 ( + ) – w wyniku reakcji powstaje dobrze rozpuszczalna sól – bromek glinu.
Probówka 2 ( + ) - w wyniku reakcji powstaje dobrze rozpuszczalna sól – bromek glinu. Wydzielającym się gazem jest wodór.
Probówka 3 ( + ) – w wyniku reakcji powstaje dobrze rozpuszczalna sól – bromek glinu.
Probówka 4 (+ ) – reakcja jest silnie egzotermiczna (w jej wyniku wydziela się duża ilość energii). W jej wyniku powstaje sól – bromek glinu.
Probówka 5 ( + ) – w wyniku reakcji powstaje dobrze rozpuszczalna w wodzie sól – bromek glinu oraz trudno rozpuszczalna w wodzie sól – siarczan(VI) baru.
Wnioski: Bromek glinu można otrzymać, stosując pięć różnych metod. Hipoteza została potwierdzona.
Metody otrzymywania chlorku glinu w wirtualnym laboratorium chemicznym
Na podstawie wirtualnego laboratorium chemicznego można przeanalizować różne metody preparatyki chlorku glinu , które stanowią podstawowe zagadnienie chemii nieorganicznej. Wirtualne laboratorium przedstawia systematyczne podejście do syntezy soli przez demonstrację pięciu głównych metod otrzymywania chlorku glinu, każda z charakterystycznymi cechami mechanizmu reakcji, warunkami prowadzenia oraz produktami powstającymi w procesie.
1. Charakterystyka dostępnych odczynników i sprzętu laboratoryjnego
Wirtualne laboratorium zostało wyposażone w kompletny zestaw odczynników chemicznych oraz sprzęt laboratoryjny niezbędny do przeprowadzenia eksperymentów syntezy chlorku glinu. Dostępne są następujące substancje chemiczne:
glin metaliczny ,
miedź ,
wodorotlenek glinu ,
tlenek glinu ,
tlenek miedzi(II),
woda destylowana,
kwas chlorowodorowy ,
chlorek miedzi(II) ,
siarczan(VI) miedzi(II) ,
wodorotlenek sodu ,
gazowy chlor .
Sprzęt laboratoryjny obejmuje:
probówki,
zlewki,
kolby stożkowe,
pipety,
palnik gazowy.
Wybór odpowiednich odczynników w wirtualnym laboratorium uzależniony jest od konkretnej metody syntezy, przy czym każda z metod wymaga specyficznych warunków reakcji oraz oferuje różne możliwości obserwacji procesów chemicznych.
2. Metody otrzymania chlorku glinu
a. Metoda pierwsza: reakcja glinu metalicznego z kwasem chlorowodorowym
Pierwsza metoda syntezy chlorku glinu opiera się na reakcji wypierania, w której metaliczny glin reaguje z kwasem chlorowodorowym zgodnie z równaniem: . Jest to jedna z najczęściej stosowanych metod laboratoryjnych ze względu na łatwość przeprowadzenia oraz spektakularne efekty wizualne.
Reakcja przebiega w temperaturze pokojowej, choć początkowo może wydawać się, że nic się nie dzieje. Jest to spowodowane obecnością naturalnej warstwy tlenku glinu na powierzchni metalu, która działa jak bariera ochronna. Po przebicu tej warstwy przez kwas, reakcja gwałtownie przyspiesza i staje się wyraźnie egzotermiczną, co objawia się intensywnym wydzielaniem gazowych pęcherzyków wodoru oraz znacznym wzrostem temperatury.
Podczas procesu można zaobserwować charakterystyczne bąbelkowanie spowodowane uwalnianym wodorem oraz stopniowe rozpuszczanie się folii aluminiowej. Roztwór kwasu chlorowodorowego zmienia zabarwienie na szarawe w wyniku tworzenia się chlorku glinu, który w roztworze wodnym ulega częściowej hydrolizie, nadając mu charakterystyczne właściwości.
b. Metoda druga: reakcja tlenku glinu z kwasem chlorowodorowym
Druga metoda syntezy wykorzystuje reakcję kwas‑zasada między tlenkiem glinu a kwasem chlorowodorowym: .Tlenek glinu wykazuje właściwości amfoteryczne, co oznacza, że może reagować zarówno z kwasami jak i zasadami, czyniąc tę metodę szczególnie uniwersalną.
Proces wymaga łagodnego podgrzewania w celu przyspieszenia reakcji rozpuszczania tlenku glinu. Tlenek glinu w postaci białego proszku stopniowo rozpuszcza się w kwasie chlorowodorowym, tworząc przezroczysty roztwór chlorku glinu. W przeciwieństwie do pierwszej metody, w tej reakcji nie wydziela gazowy wodór, a jedynym produktem ubocznym jest woda, co czyni metodę szczególnie czystą i kontrolowaną.
c. Metoda trzecia: reakcja wodorotlenku glinu z kwasem chlorowodorowym
Trzecia metoda to klasyczna reakcja neutralizacji między wodorotlenkiem glinu a kwasem chlorowodorowym:. Wodorotlenek glinu również wykazuje właściwości amfoteryczne, co umożliwia jego reakcję z kwasami
Wodorotlenek glinu występuje naturalnie w postaci żelowatego, białego osadu, który w kontakcie z kwasem chlorowodorowym ulega całkowitemu rozpuszczeniu. Reakcja przebiega w temperaturze pokojowej i jest wyraźnie egzotermiczna, co można zaobserwować przez wzrost temperatury roztworu. Proces charakteryzuje się stopniowym znikaniem białego, galaretowatego osadu wodorotlenku glinu i tworzeniem przezroczystego roztworu. Mechanizm reakcji polega na bezpośredniej neutralizacji grup hydroksylowych w strukturze Al(OH)₃ przez protony z kwasu chlorowodorowego. Jest to najbardziej stechiometricznie efektywna metoda spośród wszystkich omawianych, ponieważ wymagana jest najmniejsza ilość kwasu do otrzymania jednego mola chlorku glinu.
d. Metoda czwarta: synteza bezpośrednia z glinu i chloru
Czwarta metoda to reakcja bezpośrednia między metalicznym glinem a gazowym chlorem: . Jest to metoda przemysłowa, stosowana na szeroką skalę w produkcji bezwodnego chlorku glinu.
Reakcja wymaga wysokich temperatur w zakresie C, co czyni ją trudną do przeprowadzenia w standardowych warunkach laboratoryjnych. Proces charakteryzuje się gwałtowną reakcją egzotermiczną, podczas której można zaobserwować jasny płomień oraz sublimację powstającego chlorku glinu. W wysokiej temperaturze reakcji AlCl₃ występuje w postaci gazowej i kondensuje się na chłodniejszych powierzchniach aparatury.
Metoda ta jest szczególnie ważna z przemysłowego punktu widzenia, ponieważ pozwala na otrzymanie bezwodnego chlorku glinu, który znajduje zastosowanie jako katalizator w reakcjach Friedela‑Craftsa oraz w innych procesach syntezy organicznej. Bezwodny chlorek glinu wykazuje silne właściwości higroskopijne i gwałtownie reaguje z wilgocią atmosferyczną.
e. Metoda piąta: reakcja wypierania z chlorkiem miedzi(II)
Piąta metoda wykorzystuje reakcję wypierania między glinem metalicznym a chlorkiem miedzi(II): . Jest to demonstracyjna reakcja redoks, która doskonale ilustruje szereg aktywności metali.
Proces wymaga podgrzewania roztworu chlorku miedzi(II) i dodawania glinu w postaci folii aluminiowej. Reakcja jest wysoce egzotermiczną i spektakularną pod względem wizualnym - można zaobserwować wytrącanie się metalicznej miedzi o charakterystycznej czerwonawej barwie oraz zmianę zabarwienia roztworu z niebieskiego na bezbarwny.
Mechanizm reakcji polega na redukcji jonów przez atomy glinu, przy jednoczesnej oksydacji glinu do jonów Indeks górny 3+3+. Reakcja ta jest termodynamicznie bardzo korzystna ze względu na dużą różnicę w potencjałach standardowych obu par redoks. Glin, będący znacznie wyżej w szeregu aktywności metali niż miedź, łatwo oddaje elektrony, redukując jony miedzi do metalicznej postaci.
2Al+ 6HBr strzałka w prawo 1. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3BaSO indeks dolny, 4, koniec indeksu dolnego, 2. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, O, 3. A l B r indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, O, 4. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, 5. 2AlBr indeks dolny, 3, koniec indeksu dolnego
A l indeks dolny, 2, koniec indeksu dolnego, O indeks dolny, 3, koniec indeksu dolnego, + 6HBr strzałka w prawo 1. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3BaSO indeks dolny, 4, koniec indeksu dolnego, 2. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, O, 3. A l B r indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, O, 4. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, 5. 2AlBr indeks dolny, 3, koniec indeksu dolnego
2Al+ 3Br indeks dolny, 2, koniec indeksu dolnego, strzałka w prawo 1. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3BaSO indeks dolny, 4, koniec indeksu dolnego, 2. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, O, 3. A l B r indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, O, 4. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, 5. 2AlBr indeks dolny, 3, koniec indeksu dolnego
A l indeks dolny, 2, koniec indeksu dolnego, (SO indeks dolny, 4, koniec indeksu dolnego, zamknięcie nawiasu indeks dolny, 3, koniec indeksu dolnego, + 3BaBr indeks dolny, 2, koniec indeksu dolnego, strzałka w prawo 1. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3BaSO indeks dolny, 4, koniec indeksu dolnego, 2. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, O, 3. A l B r indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, O, 4. 2AlBr indeks dolny, 3, koniec indeksu dolnego, + 3H indeks dolny, 2, koniec indeksu dolnego, 5. 2AlBr indeks dolny, 3, koniec indeksu dolnego
metal aktywny + 1. wodór, 2. kwas, 3. metal, 4. kwas2, 5. woda, 6. sól3(s), 7. kwas1, 8. metalu, 9. niemetalu, 10. niemetal, 11. sól, 12. sól2(aq), 13. wodorotlenek, 14. kwas, 15. sól4(aq) → 1. wodór, 2. kwas, 3. metal, 4. kwas2, 5. woda, 6. sól3(s), 7. kwas1, 8. metalu, 9. niemetalu, 10. niemetal, 11. sól, 12. sól2(aq), 13. wodorotlenek, 14. kwas, 15. sól4(aq) + 1. wodór, 2. kwas, 3. metal, 4. kwas2, 5. woda, 6. sól3(s), 7. kwas1, 8. metalu, 9. niemetalu, 10. niemetal, 11. sól, 12. sól2(aq), 13. wodorotlenek, 14. kwas, 15. sól4(aq)
tlenek 1. wodór, 2. kwas, 3. metal, 4. kwas2, 5. woda, 6. sól3(s), 7. kwas1, 8. metalu, 9. niemetalu, 10. niemetal, 11. sól, 12. sól2(aq), 13. wodorotlenek, 14. kwas, 15. sól4(aq) + 1. wodór, 2. kwas, 3. metal, 4. kwas2, 5. woda, 6. sól3(s), 7. kwas1, 8. metalu, 9. niemetalu, 10. niemetal, 11. sól, 12. sól2(aq), 13. wodorotlenek, 14. kwas, 15. sól4(aq) → sól + woda
1. wodór, 2. kwas, 3. metal, 4. kwas2, 5. woda, 6. sól3(s), 7. kwas1, 8. metalu, 9. niemetalu, 10. niemetal, 11. sól, 12. sól2(aq), 13. wodorotlenek, 14. kwas, 15. sól4(aq) + 1. wodór, 2. kwas, 3. metal, 4. kwas2, 5. woda, 6. sól3(s), 7. kwas1, 8. metalu, 9. niemetalu, 10. niemetal, 11. sól, 12. sól2(aq), 13. wodorotlenek, 14. kwas, 15. sól4(aq) → sól
sól1(aq) + 1. wodór, 2. kwas, 3. metal, 4. kwas2, 5. woda, 6. sól3(s), 7. kwas1, 8. metalu, 9. niemetalu, 10. niemetal, 11. sól, 12. sól2(aq), 13. wodorotlenek, 14. kwas, 15. sól4(aq) → 1. wodór, 2. kwas, 3. metal, 4. kwas2, 5. woda, 6. sól3(s), 7. kwas1, 8. metalu, 9. niemetalu, 10. niemetal, 11. sól, 12. sól2(aq), 13. wodorotlenek, 14. kwas, 15. sól4(aq) + 1. wodór, 2. kwas, 3. metal, 4. kwas2, 5. woda, 6. sól3(s), 7. kwas1, 8. metalu, 9. niemetalu, 10. niemetal, 11. sól, 12. sól2(aq), 13. wodorotlenek, 14. kwas, 15. sól4(aq)
Słownik
nazwa fragmentu cząsteczki kwasu, powstałego po oderwaniu się od kwasu w wyniku dysocjacji elektrolitycznej jednego lub więcej atomów wodoru
metal, który wypiera wodór z wody w warunkach normalnych
metal, który nie wypiera wodoru z wody w warunkach normalnych
Ćwiczenia
Poniżej przedstawiono schemat pewnego doświadczenia chemicznego.
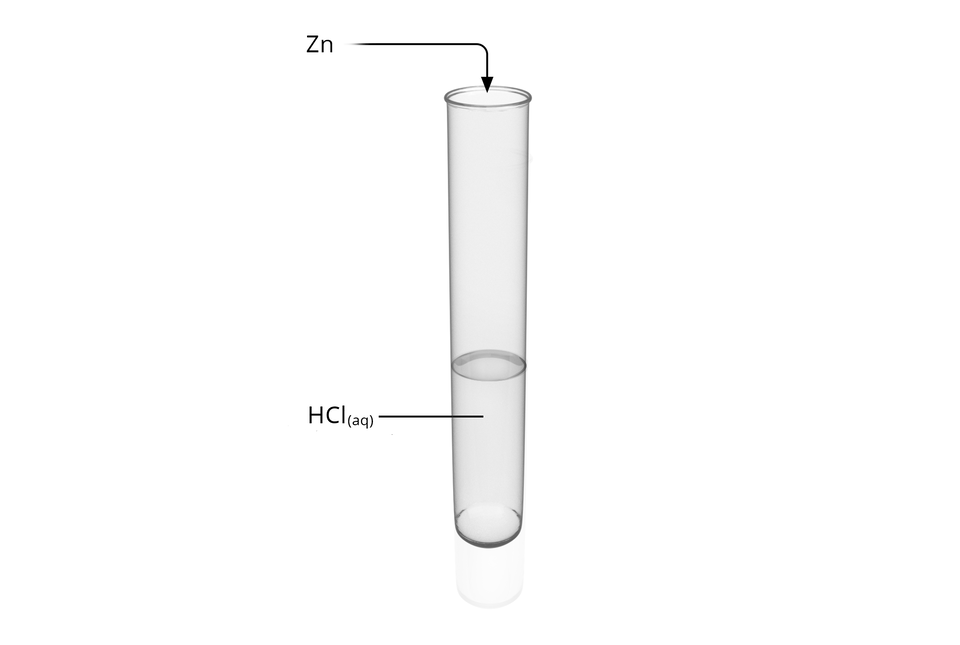
Przeprowadzono doświadczenie polegające na dodaniu cynku do kwasu solnego.
The equation of a certain chemical reaction is shown below.
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 2002, wyd. 5.
Kulawik J., Kulawik T., Litwin M., Podręcznik do chemii dla klasy siódmej szkoły podstawowej, Warszawa 2020.
Łasiński D., Sporny Ł., Strutyńska D., Wróblewski P., Podręcznik dla klasy siódmej szkoły podstawowej, Mac Edukacja 2020.