Układy pneumatyczne
MEC.03. Montaż i obsługa maszyn i urządzeń - Mechanik- Monter maszyn i urządzeń i Technik mechanik
Podstawy fizyczne pneumatyki
ATLAS INTERAKTYWNY
W pneumatyce wykorzystuje się tylko niektóre wielkości fizyczne, które są zawarte w międzynarodowym układzie jednostek miar, oznaczone krótko (z fr. Systeme International). Będą one potrzebne do lepszego zrozumienia praw rządzących zachowaniem się powietrza. Należą do nich:
Wielkości podstawowe,
Tabela 1. Wielkości podstawowe Wielkość
Oznaczenie
Jednostki
Długość
metr,
Masa
kilogram,
Czas
sekunda,
Temperatura
kelwin,
Wielkości pochodne.
Tabela 2. Wielkości pochodne Wielkość
Oznaczenie
Jednostki
Siła
newton,
Powierzchnia
metr kwadratowy,
Objętość
metr sześcienny,
Prędkość
metr na sekundę,
Natężenie przepływu
metr sześcienny na sekundę,
Ciśnienie
pascal,
Ciśnienie
Ciśnienie jest jednym z podstawowych parametrów opisujących stan powietrza. Zgodnie z prawem Pascala odpowiada ciśnieniu, które wywiera prostopadle działająca siła na powierzchnię .
Wartość mierzonego ciśnienia zależy od przyjętego poziomu odniesienia. Ciśnienie zmierzone względem próżni jest nazywane ciśnieniem absolutnym lub bezwzględnym. Ciśnienie wywierane przez słup powietrza atmosferycznego nosi nazwę ciśnienia barometrycznego (atmosferycznego) .
Ciśnienie manometryczne (ciśnienie względne) jest to różnica ciśnienia absolutnego i ciśnienia otoczenia, którym najczęściej jest ciśnienie atmosferyczne, wskazywane przez barometr. Ciśnienie manometryczne może przyjmować wartości większe od zera i wówczas mówi się o nadciśnieniu lub wartości mniejsze od zera i wówczas mówi się o podciśnieniu. Rodzaje ciśnień wyjaśnia poniższy rysunek.
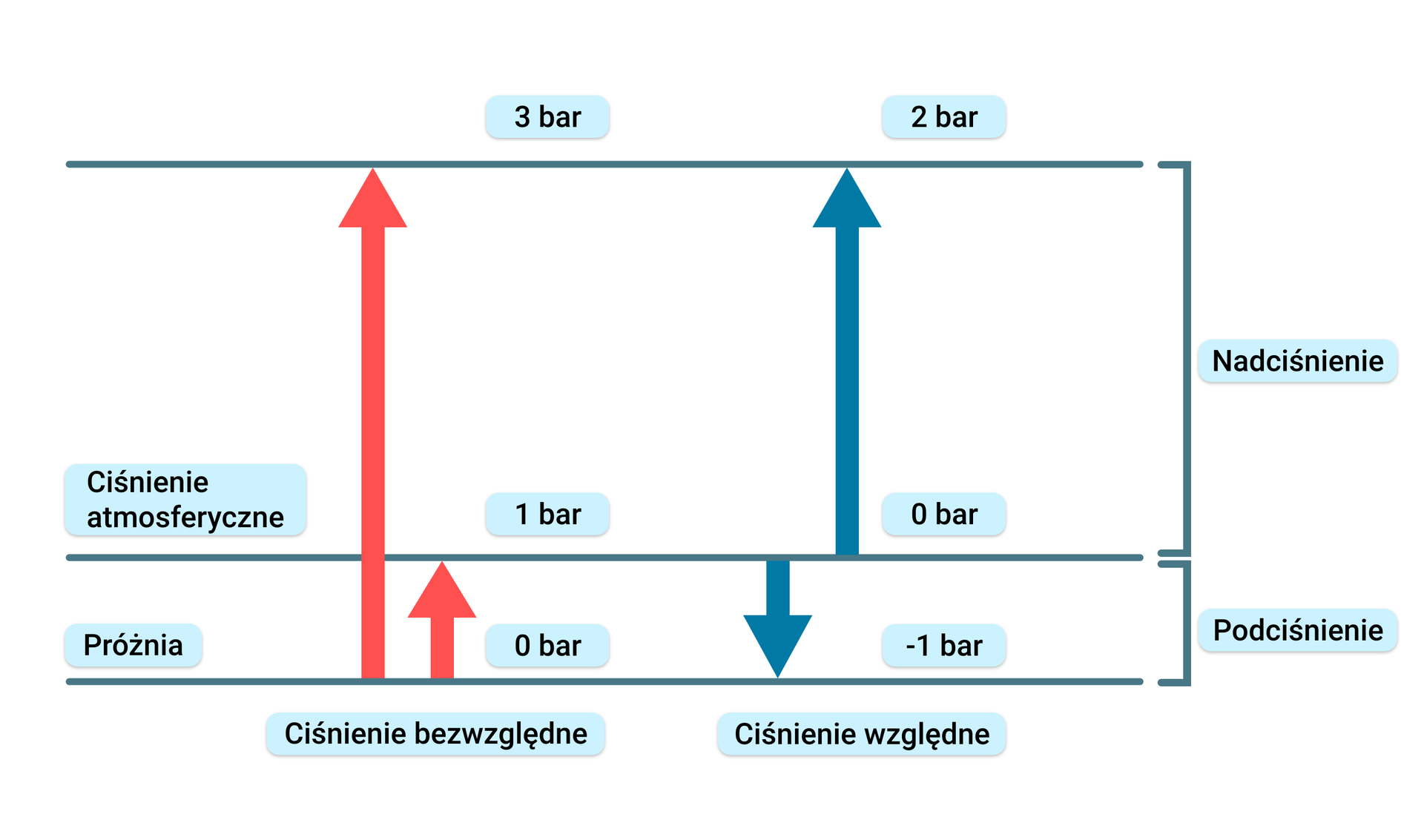
Przykład 1 |
|---|
Manometr wskazuje ciśnienie . Ile wynosi ciśnienie absolutne? Odpowiedź Ciśnienie absolutne jest sumą ciśnienia atmosferycznego i nadciśnienia , więc: |
Przykład 2 |
|---|
Wakuometr wskazuje ciśnienie . Ile wynosi ciśnienie absolutne? Odpowiedź Ciśnienie absolutne jest różnicą ciśnienia atmosferycznego i podciśnienia , więc: |
Przyrządy do pomiaru ciśnień
barometr – pomiar ciśnienia atmosferycznego,
manometr – pomiar nadciśnienia,
wakuometr – pomiar podciśnienia.
Jednostki ciśnienia
Jednostką obowiązującą ciśnienia zgodnie z układem jest Pascal i jego wielokrotności.
,
,
.
Ciśnienia podawane są także w innych jednostkach. Obowiązującą i szeroko stosowaną w pneumatyce są bary
.
Można jeszcze spotkać stare jednostki, od których już się odchodzi, m.in.:
atmosfera techniczna (ciśnienie wywierane przez słupa wody)
atmosfera fizyczna (ciśnienie wywierane przez słupa rtęci)
Dla praktyki warsztatowej całkowicie wystarczające jest następujące przybliżenie:
Przykład |
|---|
Zamień na . Odpowiedź Przedrostek mili to , przedrostek hekto to , a , zatem: |
Ogólne równanie stanu gazu
Stan fizyczny powietrza w zamkniętym zbiorniku (stała niezmienna ilość powietrza) określają trzy parametry:
– ciśnienie gazu,
– objętość gazu,
– temperatura gazu,
W wyniku badań i doświadczeń odkryto, sprawdzono i ujęto w matematyczną zależność związek między tymi trzema parametrami, który nosi nazwę równania stanu gazu (równanie Clapeyron’a):
Przy skończonej ilości gazu iloczyn ciśnienia i objętości podzielony przez temperaturę absolutną jest stały. Z tego ogólnego równania stanu gazu otrzymuje się przemiany stanu gazu, jeśli aktualnie jeden z trzech czynników , lub pozostaje stały. Jeżeli objętość jest stała, to mamy do czynienia z przemianą izochoryczną. Jeżeli ciśnienie jest stałe to jest to przemiana izobaryczna. Natomiast, gdy temperatura się nie zmienia to zachodzi przemiana izotermiczna.
Przemiana izochoryczna
Przemiana izochoryczna to proces, w którym objętość gazu jest niezmienna , a pozostałe parametry ulegają zmianie. Ogrzewając gaz w pojemniku, czyli zwiększając jego temperaturę, w wyniku takiego działania, nastąpi wzrost ciśnienia gazu. W momencie ochładzania gazu, ciśnienie będzie malało.
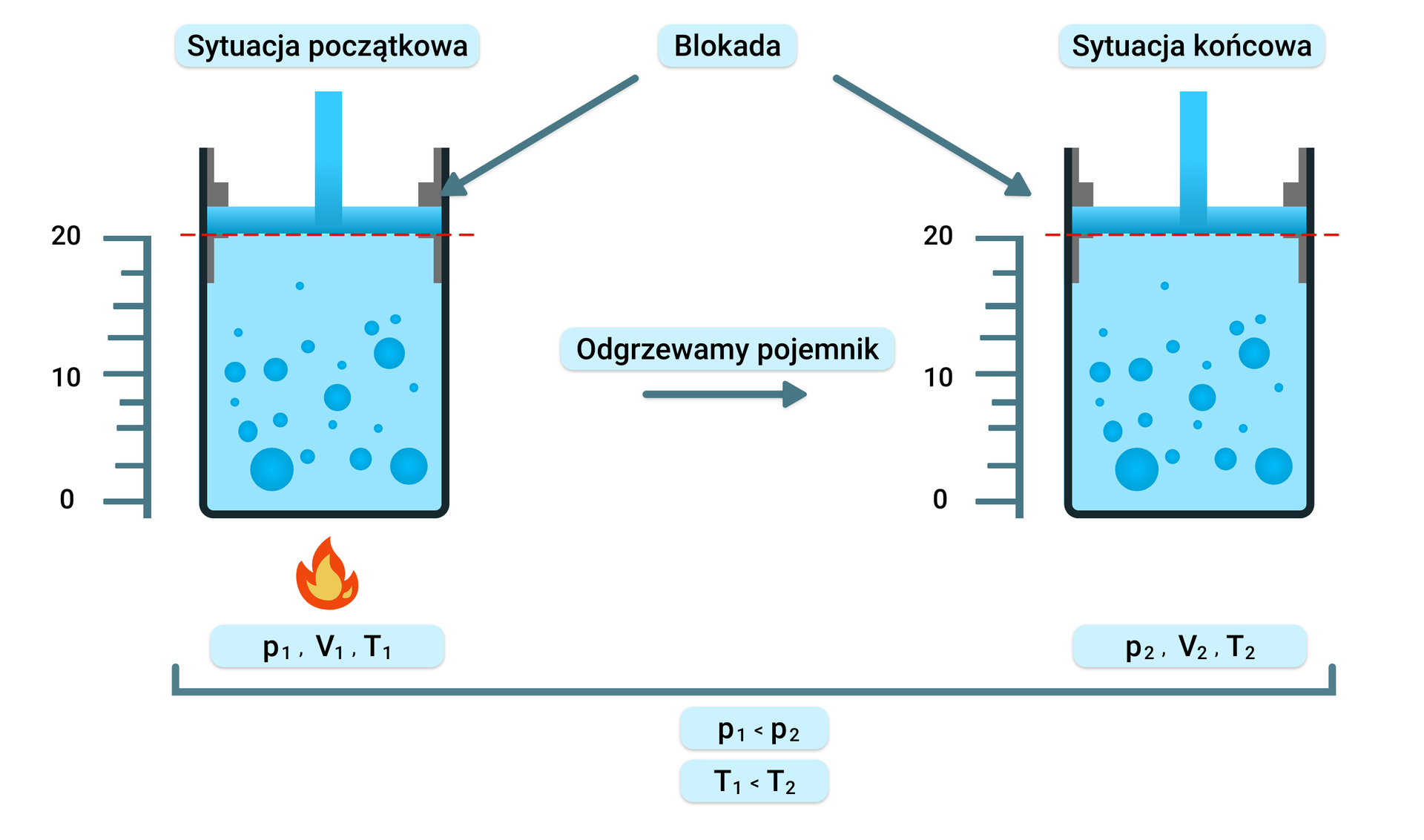
Równanie Clapeyrona w tym procesie przyjmuje następującą postać:
Dzieląc powyższe równanie przez , otrzymamy:
Przemianę izochoryczną opisuje prawo Charlesa: W izochorycznej przemianie stałej masy gazu ciśnienie panujące w gazie jest wprost proporcjonalne do jego temperatury.
Przemianę izochoryczną można zaobserwować, gdy pozostawione na nasłonecznionym obszarze opony samochodowe, zaczynają się nagrzewać, w skutek czego ciśnienie w nich rośnie. Podobnie jest z nadmuchanym w gorący dzień materacem. Po wrzuceniu do zimnej wody robi się miękki i wiotki w wyniku obniżenia w nim ciśnienia.
Przykład |
|---|
Ciśnienie powietrza w zamkniętym pojemniku o temperaturze jest pod ciśnieniem absolutnym . O ile wzrośnie ciśnienie gazu w pojemniku, jeżeli podgrzejemy go do temperatury ? Odpowiedź W celu wyliczenia ciśnienia powietrza w zamkniętym pojemniku korzystamy z zależności wynikającej z przemiany izochorycznej. Trzeba jednak zamienić temperaturę wyrażoną w na temperaturę bezwzględną wyrażoną w kelwinach : Obliczamy ciśnienie panujące w zbiorniku dla wyższej temperatury: Ciśnienie wzrośnie zatem o: |
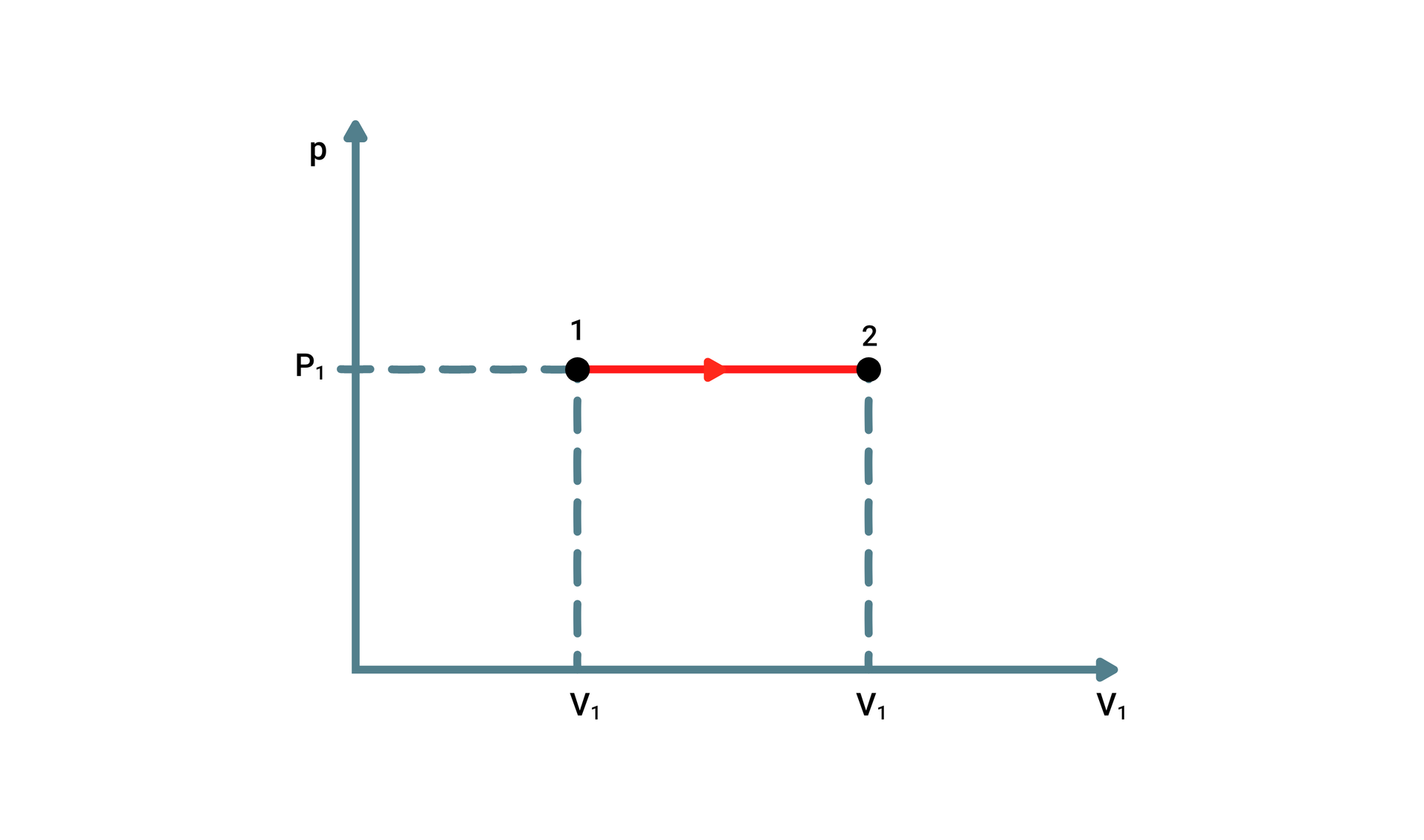
Przemiana izobaryczna
Przemiana izobaryczna zakłada, że ciśnienie gazu jest stałe , a pozostałe wielkości ulegają zmianie. Ogrzewając gaz zamknięty w pojemniku z tłokiem, który nie jest zablokowany i może się poruszać swobodnie góra‑dół (pomijając tarcie pomiędzy tłokiem, a ściankami pojemnika), można zauważyć, że wraz ze wzrostem temperatury następuje wzrost objętości gazu (tłok porusza się do góry). W chwili gdy następuje oziębienie pojemnika i temperatura obniża się – objętość gazu maleje, a tłok opada w dół.
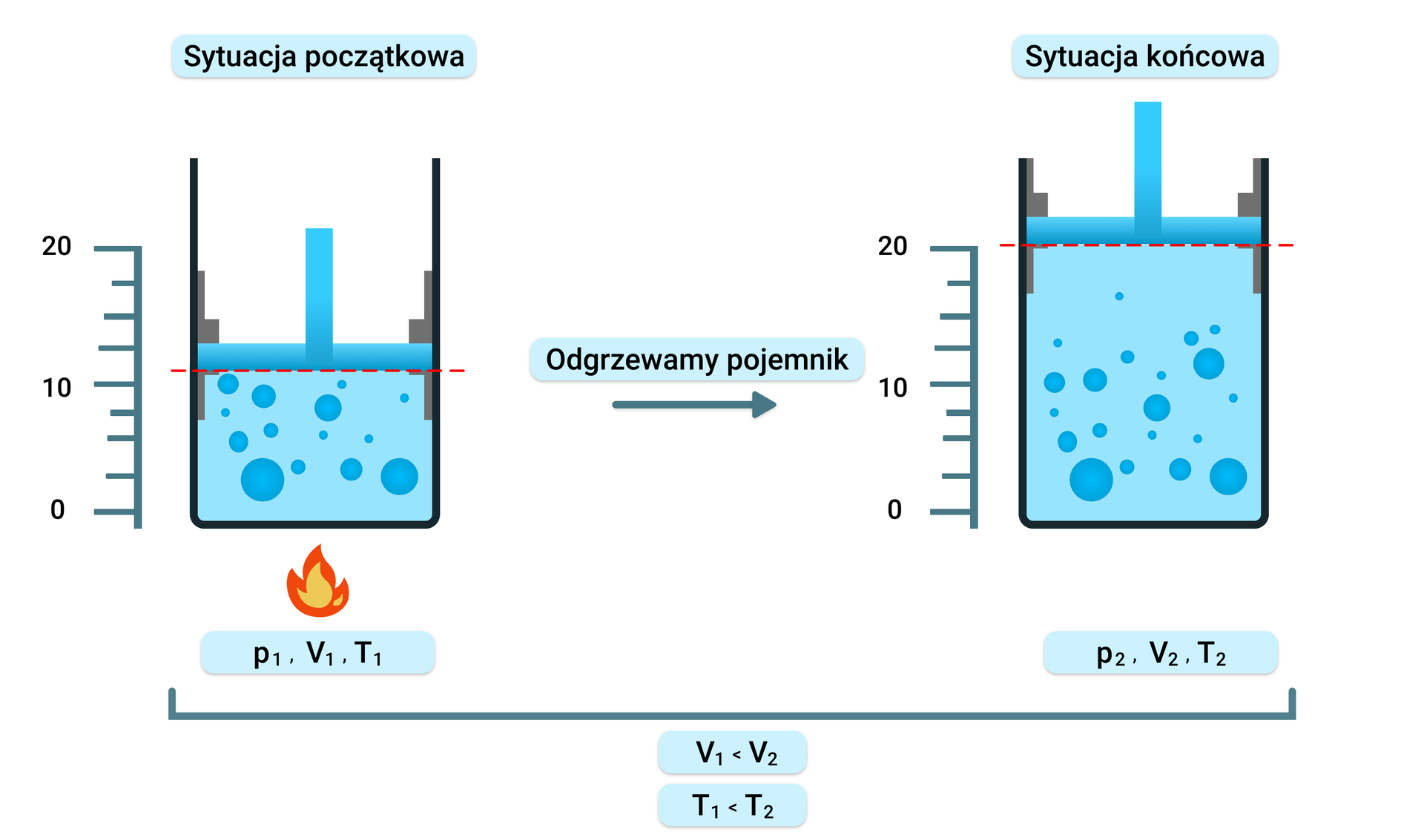
Równanie Clapeyrona w tym procesie przyjmuje następującą postać:
Dzieląc powyższe równanie przez , otrzymamy:
Przemianę izobaryczną opisuje prawo Gay‑Lussaca: W izobarycznej przemianie stałej masy gazu objętość zajmowana przez gaz jest wprost proporcjonalna do jego temperatury.
Przemiana izotermiczna
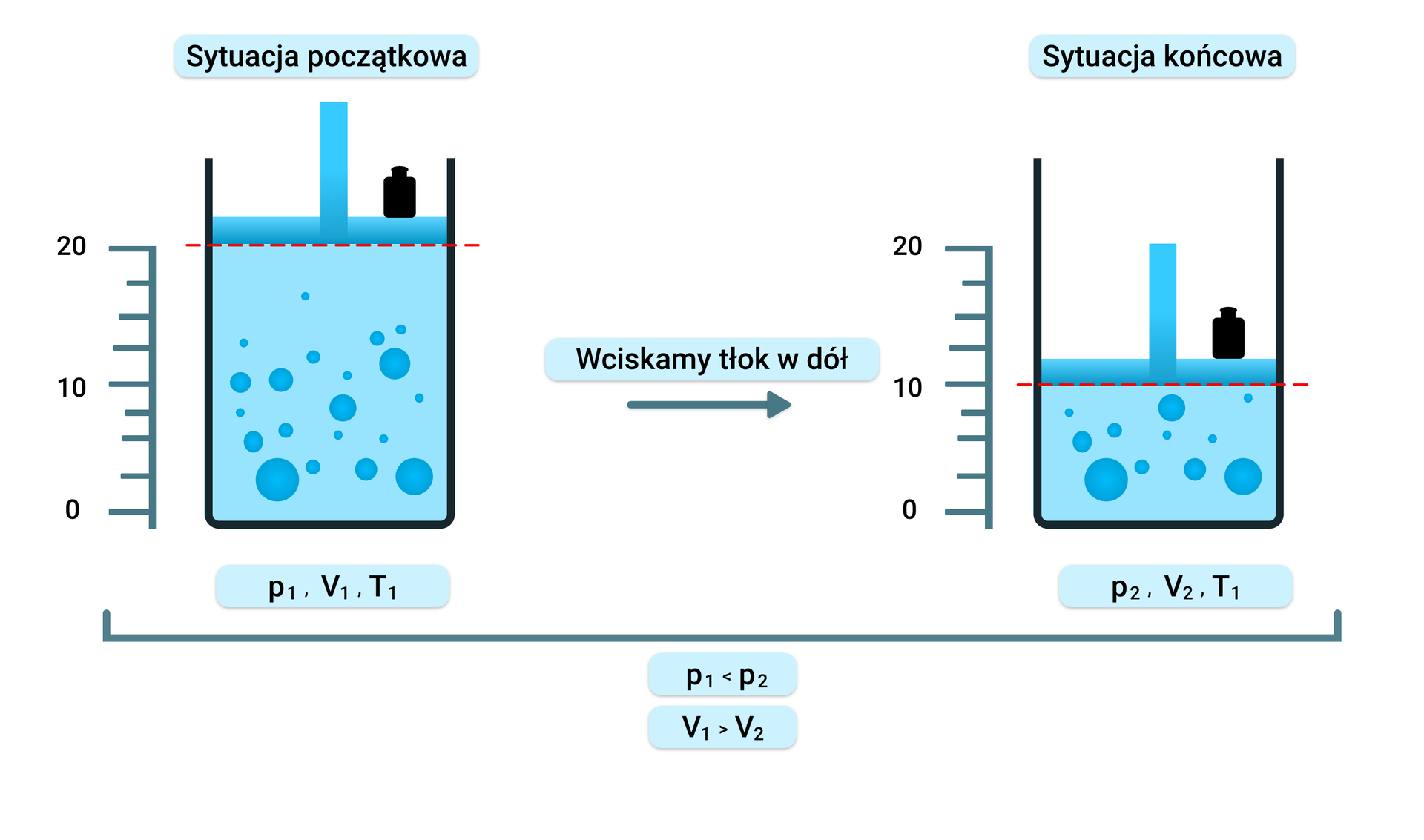
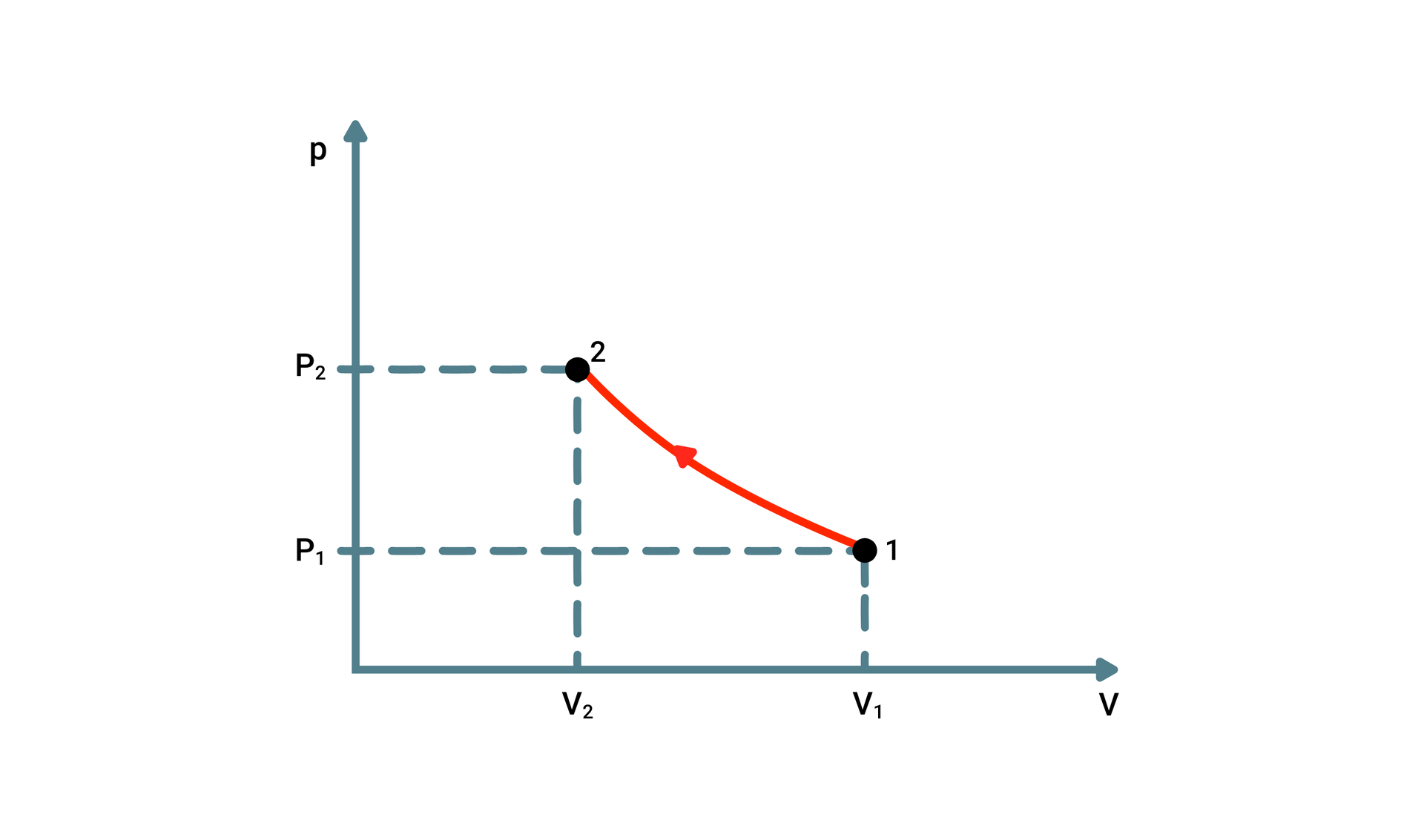
Przemiana izotermiczna charakteryzuje się tym, że temperatura gazu jest stała , a zmianie ulegają ciśnienie i objętość. Mając pojemnik z gazem, ustalamy kolejno parametry , , . Następnie wykonując pracę poprzez wciskanie tłoka w dół, objętość gazu się zmniejsza, a w skutek tego ciśnienie się zwiększa. Pamiętając oczywiście, że temperatura jest niezmienna (szybka wymiana ciepła z otoczeniem).
Równanie Clapeyrona w tym procesie przyjmuje następującą postać:
Mnożąc powyższe równanie przez , otrzymamy:
Przemianę izotermiczną opisuje prawo Boyle’a‑Mariotte’a: W izotermicznej przemianie stałej masy gazu ciśnienie, panujące w gazie, jest odwrotnie proporcjonalne do jego objętości.
Przykład |
|---|
W zamkniętym zbiorniku z ruchomym tłokiem o objętości znajduje się gaz pod ciśnieniem . Ile wyniesie ciśnienie gazu w zbiorniku, jeśli poprzez przesunięcie tłoka zmniejszymy objętość zbiornika o litrów? Zakładamy, że temperatura gazu nie uległa zmianie podczas sprężania. Odpowiedź Najpierw należy przeliczyć jednostki objętości na takie same, np. na litry. to , a to (litr). Zatem . Teraz należy określić objętość zbiornika po przemieszczeniu tłoka. Wyniesie ona . Teraz wystarczy wszystkie dane podstawić do wzoru na przemianę izotermiczną i wyliczyć ciśnienie . |
Przepływ gazu
Rozróżnia się dwa rodzaje przepływów płynu:
Przepływ laminarny (warstwowy) - przepływ, w którym płyn przepływa w równoległych warstwach, bez zakłóceń między warstwami (mieszania się). Przepływ tego typu występuje przy odpowiednio małych prędkościach przepływu.
R1DLSncj2SFvK 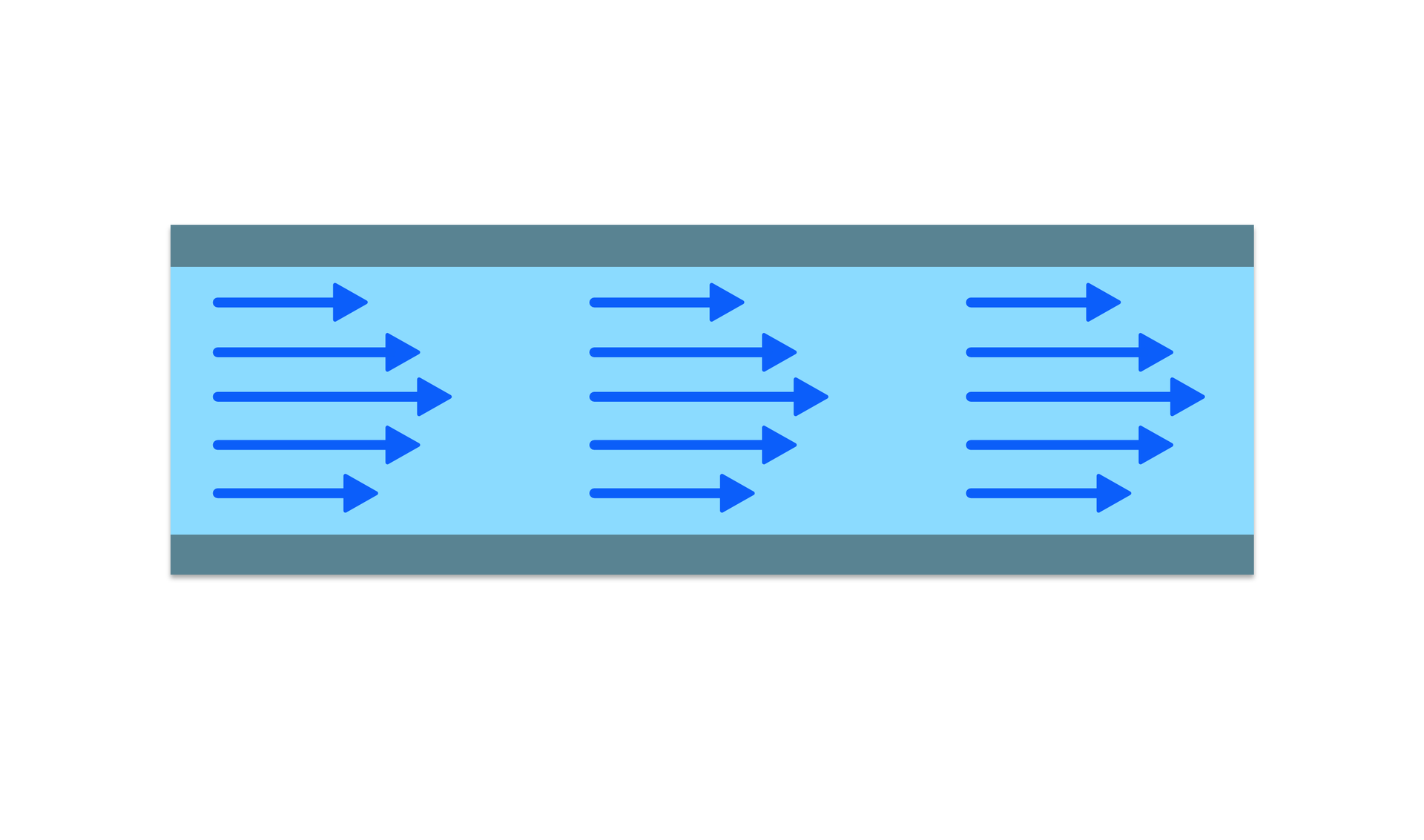 Równoległe linie prądu gazu podczas przepływu laminarnegoŹródło: Englishsquare.pl Sp. z o.o., licencja: CC BY-SA 3.0.
Równoległe linie prądu gazu podczas przepływu laminarnegoŹródło: Englishsquare.pl Sp. z o.o., licencja: CC BY-SA 3.0.Przepływ turbulentny (wirowy lub burzliwy) - tory cząstek stają się chaotyczne, nie mają ustalonych linii ani strug prądu. Ruch płynu odbywa się z silnymi zawirowaniami. Przy przepływie turbulentnym występuje mieszanie się poszczególnych warstw.
RPXjyWRmhYNYE 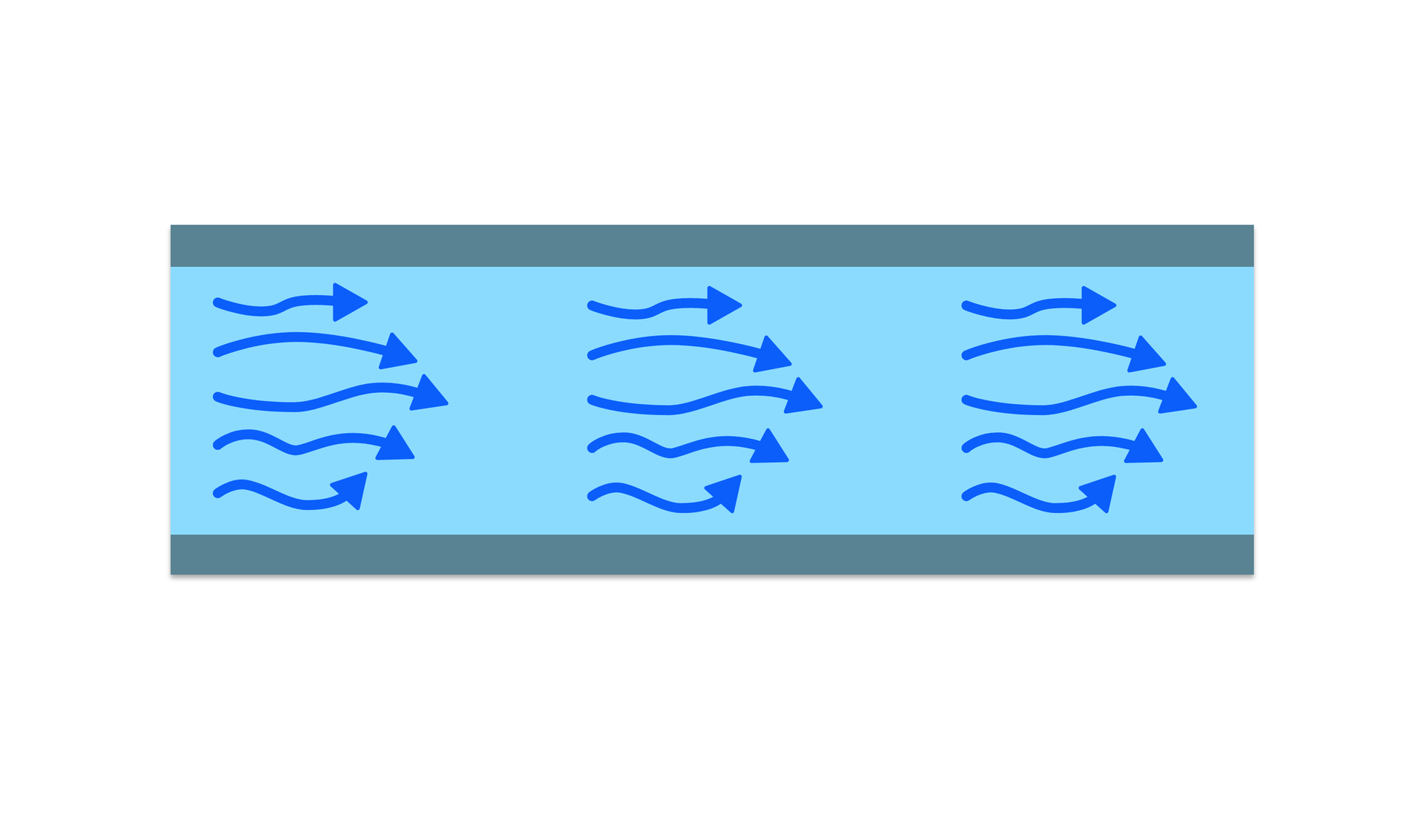 Chaotyczne linie prądu gazu w przepływie turbulentnymŹródło: Englishsquare.pl Sp. z o.o., licencja: CC BY-SA 3.0.
Chaotyczne linie prądu gazu w przepływie turbulentnymŹródło: Englishsquare.pl Sp. z o.o., licencja: CC BY-SA 3.0.
Parametrem określającym przepływ w przewodzie jest natężenie przepływu . Zwane jest również objętościowym strumieniem objętości. Wylicza się je jako stosunek objętości przepływającego gazu w przewodzie do czasu jego przepływu . Zatem jednostką objętościowego natężenia przepływu jest .
Jeżeli za objętość podstawimy iloczyn przekroju przewodu i długość przewodu zajmowanego przez gaz , to możemy powyższe równanie przekształcić do postaci:
gdzie:
– powierzchnia przekroju poprzecznego przewodu,
– prędkość gazu,
Prawo ciągłości strugi
Jeżeli założyć, że dla gazu nieściśliwego temperatura jest stała i jednakowa dla każdego przekroju przewodu i przepływ gazu jest laminarny, to objętość gazu wpływającego i odpływającego w ciągu jednej sekundy z dowolnego przekroju przewodu jest stała. Opisuje to następująca zależność:
Prawo ciągłości strugi przedstawiono graficznie na poniższym rysunku.
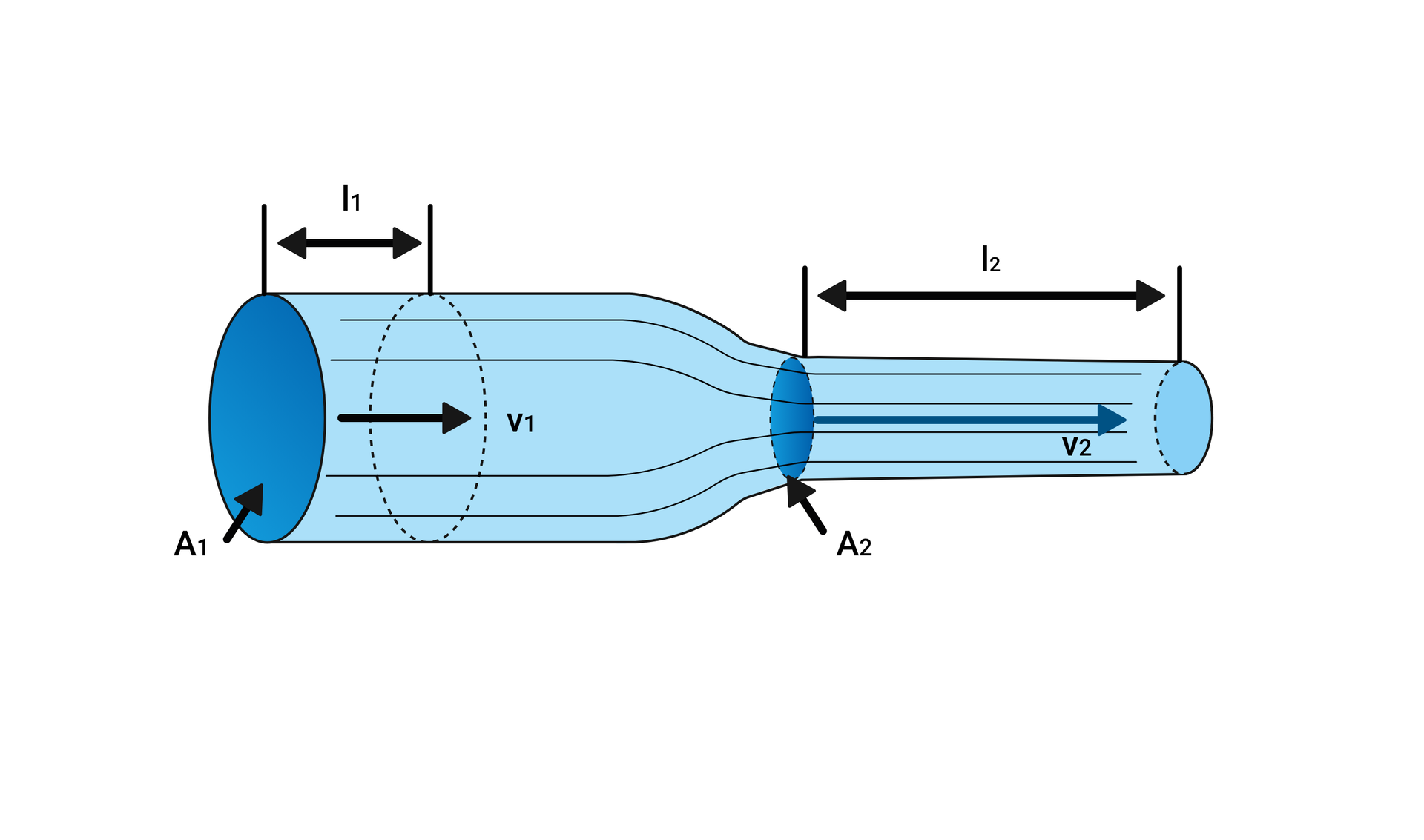
Z prawa ciągłości strugi wynika, że prędkość gazu jest odwrotnie proporcjonalna do przekroju poprzecznego przewodu. Jeśli przekrój przewodu zmniejszy się, np. trzykrotnie, to prędkość gazu w tym przewodzie zwiększy się trzykrotnie.
Przykład |
|---|
Określ, jak zmieni się prędkość gazu w przewodzie, jeśli jego średnica wzrośnie dwukrotnie. Odpowiedź Jeżeli założymy, że w przewodzie o średnicy , gaz porusza się z prędkością , natomiast w przewodzie o średnicy z prędkością , to można zapisać równanie ciągłości strugi: Oczywiście, we wzorze występują przekroje poprzeczne przewodów, ale wiemy, że pole przekroju kołowego wynosi: . Zatem podstawiając do wzoru otrzymujemy: Po przekształceniu wzoru i wyliczeniu otrzymamy: Jak widać prędkość w przewodzie o średnicy dwukrotnie większej zmaleje czterokrotnie. |
Powrót do spisu treściPowrót do spisu treści