Przeczytaj
W roku niemiecki chemik, Friedrich Kekulé, wysunął hipotezę głoszącą, że benzen jest cykloheksatrienem o sześcioczłonowym pierścieniu, w którym pomiędzy atomami węgla na przemian występują wiązania pojedyncze i podwójne.

Struktura Kekulégo nie tłumaczyła jednak, dlaczego benzen i inne związki aromatyczne nie posiadają właściwości charakterystycznych dla węglowodoru nienasyconego. Ponadto, w miarę gromadzenia się materiału eksperymentalnego, okazywało się, że wszystkie wiązania w pierścieniu benzenowym są równocenne. Na podstawie dalszych badań ustalono, że cząsteczka benzenu w istocie stanowi pierścień złożony z sześciu atomów węgla, połączonych równocennymi wiązaniami o długości pośredniej pomiędzy długością wiązania pojedynczego i podwójnego.

Katalityczne uwodornianie benzenu
UwodornianieUwodornianie – inaczej uwodornienie, hydrogenizacja, hydrogenacja, wodorowanie, hydrogenoliza – to reakcja redukcji, która polega na przyłączaniu wodoru do danego związku chemicznego. W chemii organicznej uwodornienieuwodornienie zachodzi zazwyczaj z częściowym rozerwaniem wiązania wielokrotnego węgiel‑węgiel lub węgiel‑heteroatom. Reakcja ta wymaga często stosowania wysokich ciśnień, podwyższonej temperatury oraz stosowania katalizatorów, takich jak nikiel Raneya, żelazo, pallad, chrom, miedź oraz ich mieszane tlenki.
W przypadku uwodornienia benzenu, reakcja przebiega następująco:

Stabilność cząsteczek związków aromatycznych jest większa niż węglowodorów nienasyconych. W reakcji uwodornienia należy zastosować bardziej drastyczne warunki.
Należy podkreślić, że jest to jeden z nielicznych przypadków kiedy benzen ulega reakcji addycji. Areny zazwyczaj ulegają reakcji substytucji elektrofilowej.
Obecnie przemysłowa technologia uwodornienia benzenu odbywa się dwuetapowo. W pierwszym etapie, w nadmiarze benzenu, następuje prawie całkowite przereagowanie wodoru, w drugim zaś etapie w nadmiarze wodoru zachodzi pełne uwodornienie benzenu do cykloheksanu. Reakcja uwodornienia przebiega w fazie gazowej, w obecności stałego katalizatora niklowego, w temperaturze około , pod ciśnieniem w pierwszym etapie i w drugim. Jako czynnik uwodorniający w procesie może być stosowany gaz syntezowy, zawierający około objętościowych i objętościowych .
Reakcje, jakim ulegają związki aromatyczne
Związki aromatyczne biorą udział w reakcjach, w których zostaje zachowany nienaruszony układ zdelokalizowanych elektronów . Do takich reakcji należy substytucja elektrofilowasubstytucja elektrofilowa, zachodząca zgodnie z następującym mechanizmem.
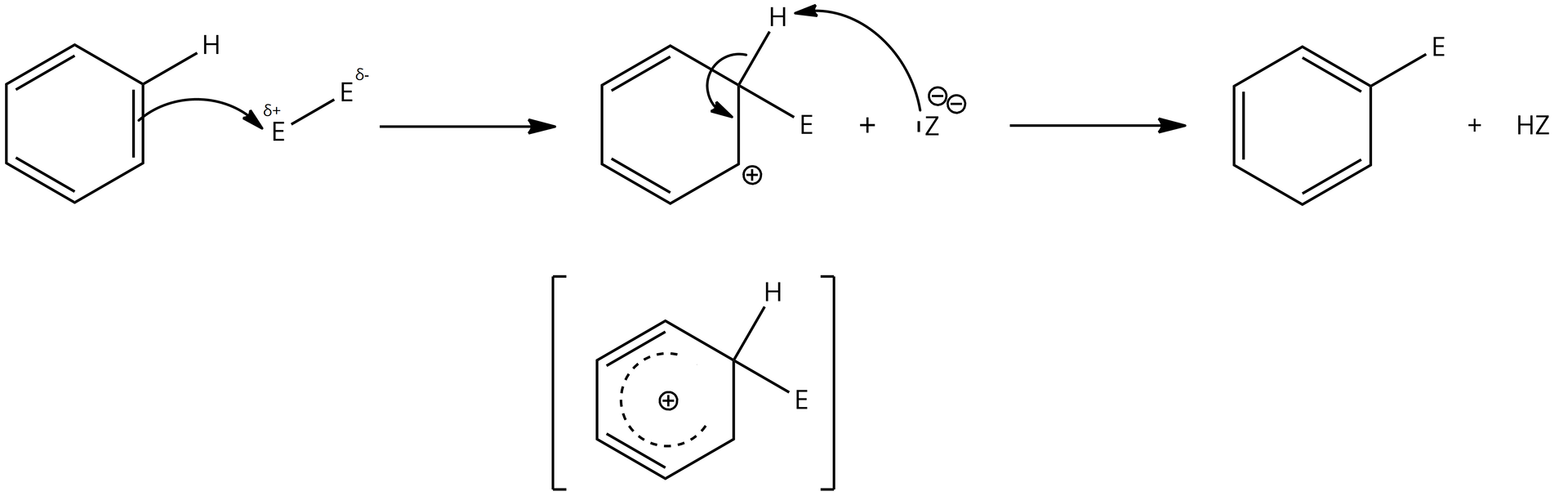
W pierwszym etapie reagent elektrofilowy E oddziałuje z chmurą zdelokalizowanych elektronów pierścienia benzenowego. Następnie przekształca się w kompleks, w którym chmura zdelokalizowanych elektronów oddaje jedną parę elektronów , tworząc wiązanie pomiędzy czynnikiem elektrofilowym a atomem węgla. Ostatni etap reakcji polega na oderwaniu protonu i utworzeniu ponownie uprzywilejowanego stabilnego układu aromatycznego.
Przykłady reakcji substytucji elektrofilowej
halogenowanie (podstawienie atomu halogenu : , , , )

nitrowanie (podstawienie grupy nitrowej: )

sulfonowanie (podstawienie grupy sulfonowej: )

alkilowanie Friedela-Craftsa (podstawienie grupy alkilowej: )

acylowanie Friedela-Craftsa (podstawienie grupy acylowej: )

Wiemy już, jak wygląda przebieg reakcji substytucji elektrofilowej, w której podstawiono za dowolny atom wodoru pierwszy podstawnik. Co jednak, gdy do już podstawionego benzenu będziemy chcieli dodawać kolejne podstawniki? Jeżeli do pierścienia benzenowego przyłączone są dwie grupy, to należy określić nie tylko ich rodzaj, ale również wzajemne położenie.

Gdy podstawniki zajmują położenie i przedrostek ;
Gdy podstawniki zajmują położenie i przedrostek ;
Gdy podstawniki zajmują położenie i przedrostek .
Podając nazwy dwupodstawionych pochodnych benzenu nie należy stosować przedrostków meta, orto czy para ani odpowiednich dla nich skrótów literowych, jedynie lokanty.
Przykład:

Jak wpływa podstawnik, który znajduje się w pierścieniu aromatycznym, na położenie nowego wprowadzanego podstawnika?
Otóż podstawniki związane z pierścieniem aromatycznym wywierają wpływ na aktywność związku, a także wskazują, w jakim położeniu znajdzie się następna podstawiona grupa. Podstawniki dzielimy zasadniczo na dwa rodzaje:
Podstawniki | Położenie podstawnika | Wpływ podstawnika na reaktywność związku aromatycznego | Przykłady podstawników |
|---|---|---|---|
I rodzajuI rodzaju | i | zwiększają reaktywność związku aromatycznego | (aminowe) Silnie aktywujące pierścień! |
zmniejszają reaktywność związku aromatycznego | Halogenki (fluorowce): | ||
II rodzajuII rodzaju | zmniejszają reaktywność związku aromatycznego | (nitrowe) |
Jak to zapamiętać?
Czy jest jakaś mnemotechnika, pozwolająca zapamiętać, który podstawnik jest jakiego rodzaju? Jest, chociaż oczywiście to tylko pewne uogólnienie. Pozwoli Ci ono jednak przynajmniej na początku sprawnie rozróżniać podstawniki. Sekret tkwi w tlenie. Zauważ, że prawie wszystkie podstawniki -rodzaju zawierają jeden lub więcej atomów tlenu (oprócz grupy – nitrylowej). Z kolei gdy przyjrzysz się podstawnikom -rodzaju, zobaczysz, że są to grupy pozbawione tlenu (oczywiście i tu jest wyjątek w postaci grupy hydroksylowej ). Być może ta prosta metoda ułatwi Ci prawidłową klasyfikację podstawników. Innym sposobem ułatwiającym zapamiętanie jest analiza budowy samego podstawnika, jeśli podstawnik w swojej budowie zawiera wiązanie wielokrotne to kieruje w pozycję meta, jeśli nie to w pozycje orto i para. Jest to jednak kolejne uogólnienie mające na celu pomóc Ci zapamiętać możliwie jak najwięcej.
Aby wytłumaczyć zasadę wpływu podstawnika na kierunek przyłączenia nowego podstawnika, można zastosować porównanie do stołu, przy którym zazwyczaj siadają goście, oraz do relacji gość‑gospodarz. Wyobraź sobie, że pierścień benzenu to sześciokątny stół z dokładnie sześcioma miejscami. Na początku do stołu podchodzi gospodarz, który zajmuje pozycje u szczytu stołu, czyli nr . Następnie zaprasza swoich gości. Jeśli jest gospodarzem pierwszego rodzaju, życzy sobie, aby zająć miejsce albo bezpośrednio koło niego (w pozycjipozycji ), albo naprzeciw niego (w pozycjipozycji ). Jeśli natomiast jest gospodarzem drugiego rodzaju, prosi, aby gość zajął pozycje w taki sposób, aby zostawić jeszcze jedno wolne miejsce między nimi (pozycjepozycje ). Najistotniejszym faktem jest to, że o zajmowanej pozycji nie decyduje gość (czyli nowy podstawnik), lecz gospodarz, który siedzi już przy stole (podstawnik w pierścieniu).
Aby jeszcze lepiej zrozumieć tę zasadę, posłużmy się przykładem.
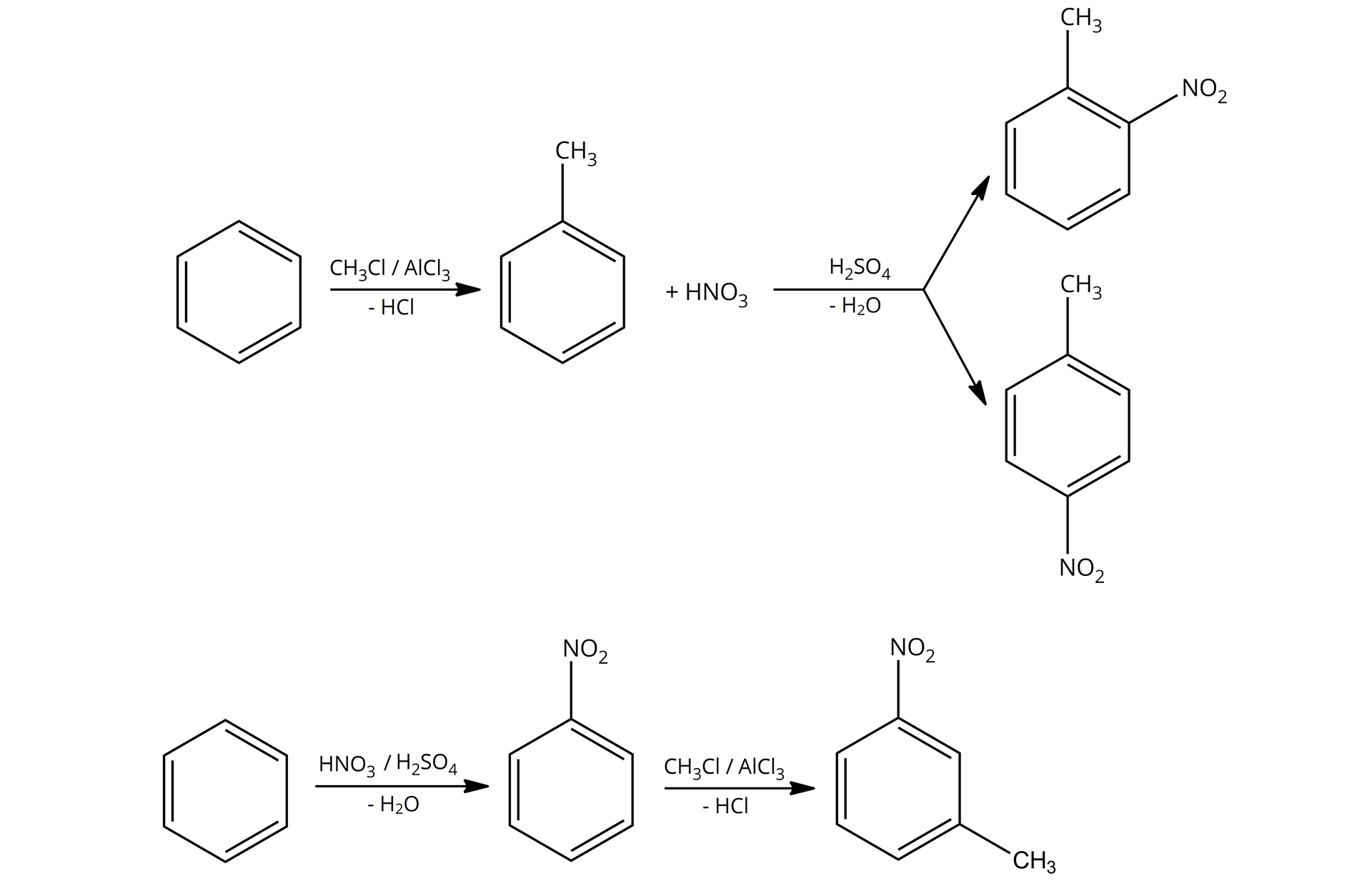
W pierwszej kolejności będziemy mieli do czynienia z podstawnikiem pierwszego rodzaju, czyli z grupą alkilową – konkretnie grupą metylową. W tym wypadku będziemy nitrować toluen. Tutaj, jako produkt główny, otrzymamy dwa izomery.

Tym razem użyjemy podstawnika drugiego rodzaju, w tym przypadku będzie to grupa nitrowa w nitrobenzenie, podstawnikiem chcącym przyłączyć się do pierścienia będzie kolejna grupa nitrowa. W tym przypadku jako produkt główny otrzymamy tylko jeden związek.

Zauważ zatem, że w zależności od kolejności wprowadzania podstawników, możemy otrzymać różne produkty. W zależności czy najpierw alkilujemy, a później nitrujemy, czy odwrotnie – zawsze uzyskujemy różne produkty. To bardzo ważne, jeśli chcemy projektować schematy reakcji, których produktem końcowym ma być konkretny izomer.
Słownik
inaczej uwodornienie, hydrogenizacja, hydrogenacja, wodorowanie, hydrogenoliza; reakcja redukcji, polegająca na przyłączaniu wodoru do danego nienasyconego związku chemicznego
dokładniej: aromatyczna substytucja elektrofilowa; reakcja substytucji, zachodząca dla związków aromatycznych, w której czynnikiem atakującym jest elektrofil; substytucja elektrofilowa jest oznaczana symbolem lub
wzajemne ułożenie podstawników w pierścieniu benzenowym w pozycji i
wzajemne ułożenie podstawników w pierścieniu benzenowym w pozycji i
wzajemne ułożenie podstawników w pierścieniu benzenowym w pozycji i
ułatwiają reakcję substytucji elektrofilowej i kierują następny podstawnik w pozycje i względem siebie; atomy chlorowców kierują następny podstawnik w pozycje i , ale utrudniają reakcje podstawienia w pierścieniu aromatycznym
utrudniają reakcję substytucji elektrofilowej i kierują następny podstawnik w pozycję względem siebie
Bibliografia
Encyklopedia PWN
McMurry J., Chemia organiczna, Warszawa 2000.
Morrison R. T., Boyd R. N., Chemia organiczna, Warszawa 2010, wyd 5.