Alkohole – właściwości
Za pomocą zmysłów – wzroku, węchu czy smaku – nie można odróżnić metanolu od etanolu. Ten fakt jest przyczyną wielu tragicznych pomyłek. Spożycie tego pierwszego grozi bowiem ciężkim zatruciem, bezpowrotną utratą wzroku, a nawet śmiercią. Jak w takim razie można odróżnić od siebie te i inne alkohole?
budowę cząsteczek nasyconych alkoholi monohydroksylowych;
sposób ustalania wzoru sumarycznego nasyconego monohydroksylowego alkoholu o podanej liczbie atomów węgla lub wodoru w cząsteczce;
sposoby rysowania wzorów strukturalnych i półstrukturalnych cząsteczek nasyconych alkoholi monohydroksylowych;
nazewnictwo nasyconych monohydroksylowych alkoholi zbudowanych z cząsteczek o prostych (nierozgałęzionych) łańcuchach węglowych;
właściwości substancji zaliczane do właściwości fizycznych oraz do właściwości chemicznych;
produkty reakcji spalania węglowodorów.
omawiać właściwości wybrane fizyczne i chemiczne nasyconych alkoholi monohydroksylowych;
analizować zmiany właściwości fizycznych nasyconych alkoholi monohydroksylowych w szeregu homologicznym;
projektować doświadczenia pozwalające metanol od etanolu na podstawie właściwości fizycznych;
zapisywać równania reakcji spalania alkoholi.
1. Właściwości fizyczne metanolu i etanolu
Metanol i etanol są bezbarwnymi cieczami. Obecny w handlu stężony roztwór etanolu nosi nazwę spirytusu rektyfikowanegospirytusu rektyfikowanego (łac. spiritus „tchnienie, duch”) i zawiera około objętościowego czystego etanolu (pozostałą część stanowi woda). W handlu dostępny jest również tak zwany denaturatdenaturat (łac. denaturatus „skażony”) – roztwór wodny etanolu, zawierający około objętościowych tego alkoholu oraz substancje mające uniemożliwić jego spożycie (stosuje się go między innymi jako rozpuszczalnik lub rozpałkę). Do denaturatu często dodaje się również substancje barwiące (zwykle barwnik fioletowy).
Na poniższej grafice znajdują się butelki z dostępnymi w handlu spirytusem rektyfikowanym i skażonym, a także butelka z metanolem.

Zwróć uwagę, że zawartość tych butelek jest identyczna i gdyby nie znajdujące się na nich etykiety, za pomocą zmysłu wzroku nie moglibyśmy ustalić, który ze związków chemicznych i w jakiej formie się w nich znajduje. Jak zatem możemy odróżnić od siebie metanol i etanol?
Mieszanie etanolu z wodą.
Sprawdzono, czy etanol rozpuszcza się w wodzie. W tym celu wykonano doświadczenie nr . Przygotowano niezbędne odczynniki i przyrządy laboratoryjne.
Problem badawczy:
Czy etanol rozpuszcza się w wodzie?
Hipoteza:
Etanol bardzo dobrze rozpuszcza się w wodzie, tworząc mieszaninę jednorodną.
Co było potrzebne:
dwa cylindry miarowe o pojemności ;
cylinder miarowy o pojemności ;
bagietka;
woda destylowana;
etanol (dla lepszego efektu możesz wykorzystać barwiony denaturat).
Przebieg doświadczenia:
W jednym z cylindrów miarowych o pojemności odmierzono wody destylowanej, a w drugim etanolu. Odmierzoną objętość wody destylowanej przelano do cylindra miarowego o pojemności . Do cylindra miarowego z wodą destylowaną przelano ostrożnie odmierzoną objętość etanolu. Zawartość cylindra miarowego wymieszano za pomocą bagietki.
Obserwacje:
Po ostrożnym wprowadzeniu etanolu do cylindra miarowego z wodą destylowaną zauważono dwie warstwy (warstwę wody na dole i warstwę alkoholu na górze). Granica pomiędzy obiema warstwami zanika po wymieszaniu zawartości cylindra miarowego – etanol miesza się z wodą. Objętość uzyskanego roztworu wynosi około .
Wnioski:
Postawiona hipoteza jest prawdziwa – etanol bardzo dobrze rozpuszcza się w wodzie. Po wymieszaniu tych dwóch substancji tworzy się mieszanina jednorodna (której składników nie możemy odróżnić za pomocą wzroku). Mieszanina ta ma mniejszą objętość niż użyte do jej sporządzenia składniki (woda destylowana i etanol).
mieszaniny., 2. Po zmieszaniu etanolu oraz otrzymano więcej niż
mieszaniny., 3. Po zmieszaniu etanolu oraz otrzymano dokładnie
mieszaniny.
Sprawdziliśmy doświadczalnie, że etanol bardzo dobrze rozpuszcza się w wodzie, a objętość uzyskanej mieszaniny jednorodnej jest mniejsza niż suma objętości jej składników (wody destylowanej i etanolu). Przyczyną ostatniej z obserwacji jest zjawisko fizyczne nazywane kontrakcją objętościkontrakcją objętości.
Kontrakcja objętości (łac. contractio „skurczenie, ściągnięcie”) to zjawisko fizyczne polegające na zmniejszaniu się objętości podczas mieszania dwóch rozpuszczających się wzajemnie cieczy – w naszym przypadku wody i etanolu. Cząsteczki wody i etanolu mają różne rozmiary (cząsteczki etanolu () są większe od cząsteczek wody ()). Podczas mieszania obydwu cieczy, cząsteczki wody zajmują wolne przestrzenie pomiędzy cząsteczkami etanolu, tak jak to zilustrowano na poniższym schemacie.

Przyczyną występowania zjawiska kontrakcji objętości są różne rozmiary cząsteczek mieszanych cieczy oraz zachodzące pomiędzy tymi cząsteczkami oddziaływania.
Spróbuj przedstawić model zjawiska kontrakcji objętości, wykorzystując w tym celu np. ziarenka maku (które będą reprezentowały cząsteczki wody) i ziarna grochu lub fasoli (reprezentujące cząsteczki etanolu). Wykonaj doświadczenie analogicznie do przeprowadzonego już doświadczenia nr . Wynikami doświadczenia (np. w postaci zdjęć) podziel się na forum klasy.
Istnienie zjawiska kontrakcji należy uwzględnić w przemyśle spirytusowym – zarówno podczas planowania i przeprowadzania procesów technologicznych, jak i przy obliczaniu wydajności produkcji. Choć zaobserwowana w doświadczeniu nr zmiana objętości mieszaniny wydaje się niewielka, to na skalę przemysłową ma już większe znaczenie. W wyniku zmieszania wody i etanolu (spirytusu) powstaje nie , lecz roztworu.
Dmitrij Iwanowicz Mendelejew w obronił rozprawę doktorską O połączeniu spirytusu z wodą. Rok później uratował kierownika jednej z wytwórni napojów alkoholowych w Rosji, którego oskarżono o kradzież alkoholu. Wyjaśnił przed sądem zjawisko kontrakcji, które polega na zmniejszeniu objętości po zmieszaniu alkoholu z wodą. Sąd uznał ekspertyzę uczonego i uwolnił oskarżonego od kary więzienia.
Metanol, podobnie jak etanol, bardzo dobrze rozpuszcza się w wodzie – ich rozpuszczalność w wodzie jest nieograniczona. Jedną z przyczyn tego jest budowa cząsteczek wymienionych alkoholi, zbliżona do budowy cząsteczki wody.

Atom tlenu ma większą wartość elektroujemności niż atom wodoru, dlatego też silniej przyciąga do siebie elektrony tworzące wiązanie (elektrony wiążące) pomiędzy atomami tych pierwiastków. To sprawia, że na atomie tlenu gromadzi się cząstkowy ładunek ujemny, a na atomie (atomach) wodoru cząstkowy ładunek dodatni. Taki układ ładunków sprawia, że woda jest dipolemdipolem – ma budowę polarną (jest rozpuszczalnikiem polarnym). Obecność polarnej grupy hydroksylowej w cząsteczkach metanolu i etanolu upodabnia je niejako do cząsteczki wody. Możemy zatem wnioskować, że cząsteczki analizowanych alkoholi również mają budowę polarną, a substancje polarne dobrze rozpuszczają się w polarnych rozpuszczalnikach.
Jak zatem odróżnić od siebie te dwa alkohole?
Aby zidentyfikować daną osobę najlepiej pobrać jej odcisk palca. Swego rodzaju „odciskiem palca”, a więc czymś charakterystycznym dla danego związku chemicznego, jest jego temperatura wrzenia. To taka wartość temperatury, w której substancja ciekła (w całej swojej objętości) przechodzi w stan gazowy. To właśnie tę wielkość fizyczną należy wyznaczyć, żeby odróżnić metanol od etanolu.
Temperaturę wrzenia można wyznaczyć, wykorzystując chociażby zestaw doświadczalny z poniższego schematu (podobny można wykorzystać w laboratorium chemicznym do rozdzielenia mieszanin ciekłych w procesie destylacjidestylacji). Przeanalizuj poszczególne elementy zestawu.
W celu wyznaczenia temperatury wrzenia za pomocą powyższego zestawu, dany alkohol należy powoli ogrzewać. Od momentu rozpoczęcia ogrzewania słupek cieczy w termometrze unosi się i zatrzymuje przy określonej temperaturze, można wtedy zobserwować pierwsze objawy wrzenia cieczy. Wartość temperatury, którą wskazuje termometr, należy odczytać i zanotować (jest to wartość temperatury wrzenia analizowanego alkoholu). W tym momencie cała zawartość kolby przechodzi w stan gazowy. Pary badanego alkoholu dostają się do chłodnicy, gdzie schłodzone ulegają skropleniu i przemieszczają się do odbieralnika.
W laboratorium chemicznym wyznaczano temperatury wrzenia metanolu i etanolu. Odnotowane w czasie trwania analizy temperatury wrzenia wynosiły kolejno: oraz . Zastanów się i odpowiedz na pytanie, którą z tych wartości temperatur należy przypisać do metanolu, a którą do etanolu. Odpowiedź uzasadnij.
Metanol moglibyśmy również odróżnić od etanolu, wyznaczając gęstostość tych alkoholi.
W szkolnym laboratorium chemicznym uczniowie mieli za zadanie wyznaczenie gęstości metanolu i etanolu w temperaturze pokojowej. W tym celu wykonali następujące czynności:
W jednym cylindrze miarowym odmierzyli metanolu, a w drugim cylindrze miarowym odmierzyli etanolu.
Odmierzone objętości badanych alkoholi zważyli na wadze laboratoryjnej uzyskując następujące wyniki:
masa odmierzonej próbki metanolu była równa ;
masa odmierzonej próbki etanolu była równa .
Wykonali obliczenia pozwalające na wyznaczenie szukanej gęstości alkoholi.
Wykorzystując powyższe informacje wykonaj odpowiednie obliczenia, pozwalające na wyznaczenie gęstości metanolu i etanolu. Wynik podaj w , z dokładnością do trzeciego miejsca po przecinku.
Właściwość fizyczna | Metanol | Etanol |
stan skupienia | ciecz | ciecz |
barwa | bezbarwna | bezbarwna |
rozpuszczalność w wodzie | bez ograniczeń | bez ograniczeń |
temperatura wrzenia | ||
gęstość |
2. Zmiany wybranych właściwości fizycznych nasyconych monohydroksylowych alkoholi w szeregu homologicznym
Metanol i etanol to nasycone monohydroksylowe alkohole, których cząsteczki zbudowane są z krótkich łańcuchów węglowych (cząsteczka metanolu zawiera jeden atom węgla, a cząsteczka etanolu dwa atomy węgla). Jak myślisz, czy ilość atomów węgla w cząsteczce alkoholu ma wpływ na jego właściwości fizyczne?
Po analizie temperatur wrzenia metanolu i etanolu, odpowiedź wydaje się oczywista – właściwości fizyczne alkoholi będą uzależnione od liczby atomów węgla w ich cząsteczkach.
Nie wszystkie alkohole mają ciekły stan skupienia. W szeregu homologicznym nasyconych monohydroksylowych alkoholi, których cząsteczki zbudowane są z prostych (nierozgałęzionych) łańcuchów węglowych, cieczami są te z nich, zawierające w cząsteczkach od do atomów węgla. Alkohol, którego cząsteczki zbudowane są z przynajmniej atomów węgla, połączonych w prosty (nierozgałęziony) łańcuch, to ciała stałe. Można zatem wnioskować, że skoro obserwujemy zmianę stanu skupienia, to zmianie będzie ulegała również gęstość alkoholi. Wraz ze wzrostem długości łańcucha węglowego w cząsteczkach nasyconych monohydroksylowych alkoholi, na ogół wzrasta ich gęstość.
Poniższy wykres przedstawia zależność temperatury wrzenia wybranych alkoholi (metanolu, etanolu, propan––olu, butan––olu, pentan––olu oraz heksan––olu) od liczby atomów węgla w łańcuchu węglowym. Przeanalizuj przedstawione na wykresie informacje. Następnie odpowiedz na pytanie, jaka jest zależność między temperaturą wrzenia nasyconych monohydroksylowych alkoholi, a liczbą atomów węgla, z których zbudowane są ich cząsteczki.

Na grafice przedstawiono wykres zależności temperatury wrzenia wybranych alkoholi od liczby węgla w łańcuchu węglowym. Kolejno zapisano liczbę atomów węgla w łańcuchu i temperaturę:
– ,
– około ,
– około ,
– ,
– około ,
– .
Długość łańcucha węglowego w cząsteczce (a więc liczba atomów węgla, z których jest on zbudowany) wpływa również na rozpuszczalność alkoholu w wodzie. Bez ograniczeń rozpuszczają się w niej tylko pierwsze trzy alkohole z szeregu homologicznego nasyconych alkoholi monohydroksylowych: metanol, etanol, propan––ol. Począwszy od alkoholu, którego cząsteczki zbudowane są z czterech atomów węgla (połączonych w nierozgałęziony łańcuch) rozpuszczalność w wodzie maleje, wraz ze wzrostem długości łańcucha węglowego, w cząsteczkach kolejnych alkoholi. Zmiana ta związana jest ze zwiększającym się fragmentem (łańcuchem) węglowodorowym w cząsteczce alkoholu. Fragment ten, w przeciwieństwie do fragmentu utworzonego z grupy hydroksylowej (), jest niepolarny. Dlatego im większy jest jego udział w cząsteczce alkoholu, tym mniejsza jest rozpuszczalność tego alkoholu w polarnej wodzie.
3. Wybrane właściwości chemiczne nasyconych alkoholi monohydroksylowych
Zarówno metanol, jak i etanol charakteryzują się ostrym, drażniącym zapachem. W związku z tym, zmysł węchu (podobnie jak zmysł wzroku) nie pozwala na odróżnienie tych alkoholi od siebie i może doprowadzić do tragicznej w skutkach pomyłki.
Etykiety umieszczone na naczyniach, w których w laboratorium chemicznym przechowywane są wspomniane alkohole, zawierają odpowiednie piktogramy ostrzegawcze.

Korzystając z dostępnych Ci źródeł informacji, odszukaj karty charakterystyk trzech innych niż metanol i etanol nasyconych alkoholi monohydroksylowych. Znajdź tam również informacje dotyczące zapachu wybranych alkoholi oraz niebezpieczeństw związanych z ich wykorzystaniem – np. w laboratorium chemicznym. Wynikami podziel się na forum klasy.
Odczyn wodnych roztworów alkoholi
Obecna w cząsteczkach alkoholi grupa hydroksylowa przypomina w budowie jon wodorotlenkowy, jaki znajduje się w strukturze wodorotlenków. Wodorotlenki rozpuszczalne w wodzie ulegają pod wpływem jej cząsteczek procesowi dysocjacji elektrolitycznejdysocjacji elektrolitycznej, a odczyn ich wodnych roztworów jest zasadowy. Czy alkohole również ulegają w wodzie dysocjacji elektrolitycznej? Czy odczyn wodnych roztworów alkoholi jest taki sam jak odczyn wodorotlenków?

Badanie odczynu wodnego roztworu alkoholu etylowego.
Problem badawczy:
Jaki odczyn ma wodny roztwór etanolu?
Hipoteza:
W cząsteczkach alkoholi znajduje się grupa , więc wodny roztwór etanolu będzie wykazywał odczyn zasadowy.
Co było potrzebne:
trzy probówki;
statyw na probówki;
wodny roztwór etanolu (spirytus przemysłowy lub wódka);
wywar z czerwonej kapusty;
alkoholowy roztwór fenoloftaleiny;
uniwersalny papierek wskaźnikowy.
Przebieg doświadczenia:
Do trzech probówek wlano po około alkoholu. Do jednej probówki wlano kilka kropli wywaru z czerwonej kapusty, a do drugiej kroplę alkoholowego roztworu fenoloftaleiny. W roztworze z trzeciej probówki zanurzono uniwersalny papierek wskaźnikowy.
Obserwacje:
Po wprowadzeniu wywaru z czerwonej kapusty do wodnego roztworu etanolu uzyskano fioletowy roztwór (wywar z czerwonej kapusty nie zmienił swojego zabarwienia). Po wprowadzeniu alkoholowego roztworu fenoloftaleiny do wodnego roztworu etanolu, roztwór pozostał bezbarwny. Papierek uniwersalny, zanurzony w wodnym roztworze etanolu, pozostał żółty.
Wnioski:
Postawiona hipoteza jest błędna. Wodny roztwór etanolu ma odczyn obojętny.
Wskaźniki kwasowo–zasadowe, dodane do wodnych roztworów etanolu, nie zmieniły zabarwienia. Świadczy to o obojętnym odczynie badanego roztworu. Za odczyn wodnych roztworów odpowiedzialne są obecne w nich kationy oksoniowe (, w uproszczeniu ) oraz aniony wodorotlenkowe (). W wyniku dysocjacji elektrolitycznej wodorotlenków, w ich wodnych roztworach pojawia się nadmiar jonów wodorotlenkowych w stosunku do kationów oksoniowych. To oznacza, że odczyn wodnych roztworów wodorotlenków jest zasadowy.
Ponieważ stwierdziliśmy doświadczalnie, że odczyn wodnego roztworu etanolu jest obojętny, możemy wnioskować, że pomimo obecności w cząsteczce tego alkoholu grupy , nie ulega on w wodzie procesowi dysocjacji elektrolitycznej.
Rozważania te możemy rozszerzyć dla całego szeregu homologicznego alkoholi. Alkohole nie ulegają procesowi dysocjacji elektrolitycznej pod wpływem wody, a odczyn wodnego roztworu dowolnego alkoholu jest obojętny.
Reakcje spalania alkoholi
Alkohole są substancjami łatwopalnymi. Substratem reakcji spalania alkoholu (oprócz danego alkoholu) jest tlen. Produktem zaś jest zawsze woda (w postaci pary wodnej) i, w zależności od dostępności tlenu, węgiel (sadza), tlenek węgla() (czad) lub tlenek węgla().
Zarówno metanol, jak i etanol palą się bladoniebieskim płomieniem.

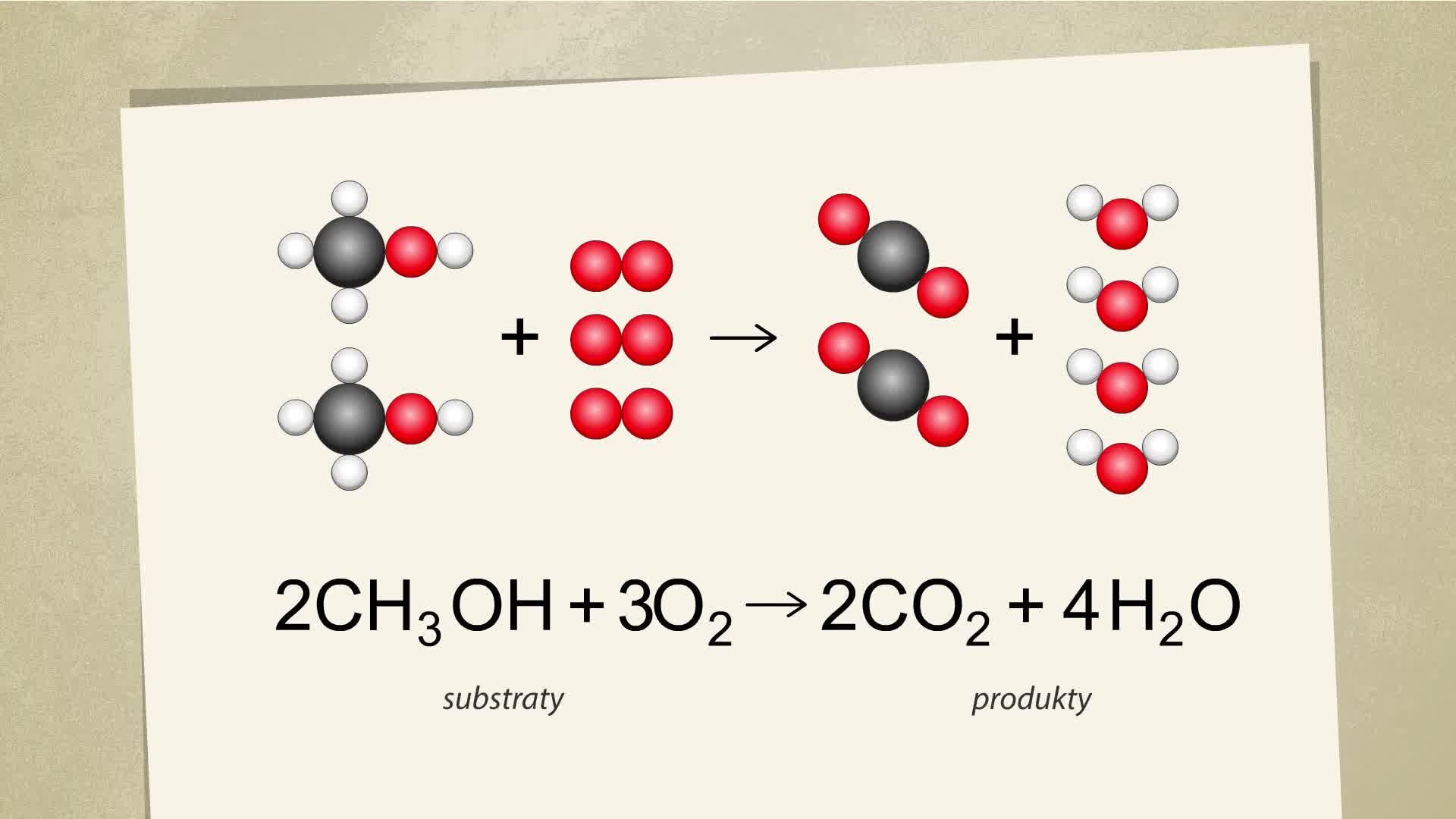
Na poniższych animacjach zobrazowano za pomocą modeli cząsteczek oraz równań reakcji chemicznych, w jaki sposób przebiegają reakcje całkowitego spalania metanolu i etanolu. Zapoznaj się z zawartymi tam informacjami, a następnie wykonaj polecenie znajdujące się poniżej.
Film dostępny pod adresem /preview/resource/RjVJGAgWDtOEV
Na filmie ukazano cząsteczkowy oraz sumaryczny zapis reakcji spalania metanolu. Oznaczono substraty oraz produkty.
Film dostępny pod adresem /preview/resource/RLSSRHwLhjWVR
Na filmie ukazano cząsteczkowy oraz sumaryczny zapis reakcji spalania etanolu. Oznaczono substraty oraz produkty.
Reakcje niecałkowitego spalania alkoholi przebiegają przy ograniczonym dostępie tlenu. Produktami reakcji spalania niecałkowitego mogą być tlenek węgla() oraz woda:
lub sadza (węgiel) i woda:
Wykorzystując uproszczony wzór alkoholu z uwzględnieniem odpowiedniej grupy funkcyjnej, napisz równania reakcji spalania nasyconego alkoholu monohydroksylowego, który zawiera w cząsteczce pięć atomów węgla, jakie mogą zachodzić przy ograniczonym dostępie tlenu.
Podsumowanie
Metanol i etanol mają wiele wspólnych właściwości fizycznych i chemicznych i dlatego trudno je rozróżnić.
Metanol jest trucizną. Spożycie nawet niewielkiej ilości tego alkoholu może prowadzić do nieodwracalnej utraty wzroku, a nawet śmierci.
Pierwsze trzy alkohole (z szeregu homologicznego nasyconych alkoholi monohydroksylowych) bardzo dobrze rozpuszczają się w wodzie (mieszają się z wodą bez ograniczeń). Począwszy od czwartego z kolei alkoholu, rozpuszczalność w wodzie maleje wraz ze wzrostem długości łańcucha węglowego w cząsteczkach alkoholi.
Odczyn wodnych roztworów alkoholi jest obojętny.
Temperatura wrzenia nasyconych alkoholi monohydroksylowych, których cząsteczki zbudowane są z prostych (nierozgałęzionych) łańcuchów węglowych, rośnie wraz ze wzrostem długości tych łańcuchów.
Alkohole to substancje palne. Ulegają reakcjom spalania całkowitego i spalania niecałkowitego.
Napisz równanie reakcji spalania butan‑1-olu, przy założeniu, że jednym z produktów tej reakcji jest gaz powodujący mętnienie wody wapiennej.
Odpowiedz na pytanie, jaką wartość pH ma wodny roztwór metanolu?
W dwóch naczyniach ogrzewano jednoczenie etanol i propan––ol. Który z alkoholi zaczął wrzeć jako pierwszy? Odpowiedź uzasadnij, odwołując się do budowy cząsteczek rozpatrywanych związków chemicznych.
Słownik
(łac. spiritus „tchnienie, duch”) wodny roztwór etanolu zawierający około objętościowego czystego alkoholu
(łac. denaturatus „skażony”) spirytus skażony; wodny roztwór etanolu zawierający około objętościowych czystego alkoholu, z dodatkiem substancji o przykrym zapachu i smaku, nie nadający się do spożycia; zabarwiony na fioletowo lub czerwono (w handlu dostępna jest również wersja bezbarwna); nie wolno spożywać denaturatu ani innego rodzaju skażonego alkoholu
(łac. contractio „skurczenie, ściągnięcie”) zjawisko fizyczne zjawisko fizyczne, które polega na zmniejszaniu objętości podczas mieszania dwóch rozpuszczających się wzajemnie cieczy; zjawisko kontrakcji jest wynikiem różnych rozmiarów cząsteczek cieczy i występujących pomiędzy nimi oddziaływań
układ dwóch różnoimiennych ładunków elektrycznych umieszczonych w pewnej odległości od siebie; w dipolu wyróżnia się dwa bieguny: biegun dodatni i biegun ujemny; dipolem jest np. cząsteczka wody, w której cząstkowy ładunek ujemny zgromadzony jest na silnie elektroujemnym atomie tlenu, a cząstekowy ładunek dodatni na atomach wodoru
(łac. destillatio, de- „od” i stillare „skraplanie”, od stilla „kropla”) metoda rozdziału mieszanin ciekłych, wykorzystująca różnice w temperaturach wrzenia ich składników; polega na odparowywaniu, a następnie skraplaniu poszczególnych składników mieszaniny
proces rozpadu drobin danej substancji na jony (kationy i aniony) pod wpływem działania cząsteczek rozpuszczalnika (w naszym przypadku wody)
w materiale: reakcja alkoholi z tlenem przebiegająca przy nieograniczonym dostępie tlenu; produktami tego procesu są tlenek węgla() i woda
w materiale: reakcja alkoholi z tlenem przebiegająca przy ograniczonym dostępie tlenu; produktami tego procesu są tlenek węgla() (czad) i woda lub sadza (węgiel) i woda
Ćwiczenia
Wskaż zapis przedstawiający wzór tlenku – jednego z produktów całkowitego spalania etanolu.
Wskaż produkty, które powstają podczas niecałkowitego spalania etanolu.
- tlenek węgla(II)
- węgiel
- tlenek węgla(IV)
- woda
- tlen
Grupa funkcyjna, która występuje w alkoholach, jest zapisywana jako 1. jeden, 2. żółty, 3. monohydroksylowych, 4. , 5. obojętny, 6. niebieski, 7. kwasowy, 8. dwa, 9. zasadowy, 10. polihydroksylowych, 11. .
Metanol i etanol należą do alkoholi 1. jeden, 2. żółty, 3. monohydroksylowych, 4. , 5. obojętny, 6. niebieski, 7. kwasowy, 8. dwa, 9. zasadowy, 10. polihydroksylowych, 11. .
Wodne roztwory alkoholi mają odczyn 1. jeden, 2. żółty, 3. monohydroksylowych, 4. , 5. obojętny, 6. niebieski, 7. kwasowy, 8. dwa, 9. zasadowy, 10. polihydroksylowych, 11. , dlatego uniwersalny papierek wskaźnikowy, po zanurzeniu go w wodnym roztworze alkoholu, pozostaje 1. jeden, 2. żółty, 3. monohydroksylowych, 4. , 5. obojętny, 6. niebieski, 7. kwasowy, 8. dwa, 9. zasadowy, 10. polihydroksylowych, 11. .
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
jednowodorotlenowych, kwasowy, obojętny, -OH, zasadowy, dwa, wielowodorotlenowych, jeden, OH
Alkohol etylowy jest pochodną węglowodoru nasyconego mającego ........................................ atom(y) węgla w cząsteczce.
Grupa funkcyjna występująca w alkoholach jest zapisywana jako .........................................
Metanol i etanol należą do alkoholi .........................................
Wodne roztwory alkoholi mają odczyn ........................................ i dlatego fenoloftaleina nie zmienia zabarwienia po dodaniu jej do roztworu alkoholu.
Analizując równanie reakcji całkowitego spalania pewnego alkoholu X, można stwierdzić, że w wyniku spalania jego dwóch cząsteczek powstaje cząsteczek tlenku węgla() i cząsteczek wody. Alkohol X można opisać za pomocą wzoru: Możliwe odpowiedzi: 1. ., 2. ., 3. ., 4. .
Suma współczynników stechiometrycznych w równaniu reakcji półspalania heptan——olu jest równa: Możliwe odpowiedzi: 1. ., 2. ., 3. ., 4. .
Bibliografia
Danikiewicz W., Chemia dla licealistów. Chemia organiczna, Warszawa 2002.
Encyklopedia PWN
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.