Budowa atomu wodoru. Stan podstawowy i stany wzbudzone
Pod koniec XIX wieku i na początku XX wiedza na temat najmniejszej – jak wtedy uważano – porcji materii, czyli atomu, była raczej skromna. Nie pozwalała na wyjaśnienie zjawiska widma promieniowania atomów (nawet tak prostego jak atom wodoru). Doświadczenie Rutherforda i model atomu stworzony przez Bohra były przełomem w rozwoju fizyki.

stwierdzić, że światło widzialne to promieniowanie elektromagnetyczne o długości fali w przedziale 380–780 nm;
opisać doświadczenia, w których promieniowanie elektromagnetyczne, a zwłaszcza światło widzialne, można traktować jako strumień porcji energii (kwantów, fotonów);
podać definicję fotonu i obliczyć jego energię;
opisać widmo liniowe wodoru – cztery linie widoczne w świetle widzialnym oraz ich kolory.
opisywać budowę atomu składającego się z bardzo małego jądra i elektronów krążących wokół niego;
podawać względne rozmiary jądra w stosunku do atomu;
opisywać oddziaływanie między jądrem a elektronami jako oddziaływanie elektrostatyczne zgodne z prawem Coulomba;
zapisywać dwa najważniejsze postulaty Bohra, wiążące wielkości opisujące elektron z możliwościami zmiany energii atomu;
korzystać z modelu Bohra, aby obliczać wartość energii elektronu w atomie wodoru znajdującym się na określonym (dozwolonym) poziomie energetycznym;
korzystać z modelu Bohra, aby obliczyć możliwe zmiany energii atomu i długości fal linii widmowych wysyłanych lub pochłanianych przez atom wodoru;
wyjaśniać, jakie konsekwencje dla budowy materii płyną z modelu atomu Bohra;
uzasadniać, dlaczego model atomu wodoru stworzony przez Bohra był przełomowy w rozwoju fizyki.
1. Modele budowy atomu
Joseph John ThomsonJoseph John Thomson w 1897 r. dokonał przełomowego odkrycia w fizyce i budowie materii. Kiedy badał przewodnictwo gazów, stwierdził, że naelektryzowanie przenoszone jest za pomocą cząsteczek mających pewien ładunek ujemny. Thomsonowi udało się również określić stosunek ich ładunku do masy. Cząsteczką, którą odkrył brytyjski fizyk, był elektronelektron. Thomson dowiódł, że źródłem pochodzenia elektronów są atomy, i tym samym obalił powszechną wówczas ideę o niepodzielności atomu.
Na podstawie późniejszych badań elektron okazał się cząstką niosącą elementarną, czyli podstawową, ilość ładunku elektrycznego.
1.1. Model budowy atomu według Thomsona
J.J. Thomson w 1904 r. zaproponował model budowy atomu, który składał się z różnych elementów, czyli był podzielny.

Model ten nazywano modelem „ciasta z rodzynkami” lub „puddingu z rodzynkami”. Dlaczego? Thomson twierdził, że dodatni ładunek atomu rozłożony jest równomiernie w całym atomie, w którym znajdują się elektrony o ujemnym ładunku (co przypomina rodzynki w cieście). Jednak bardzo szybko model ten został podważony przez Ernesta Rutherforda.
1.2. Model budowy atomu według Rutherforda
Ernest RutherfordErnest Rutherford i jego dwaj pomocnicy – Hans GeigerHans Geiger oraz Ernest MarsdenErnest Marsden przeprowadzili eksperyment bombardowania cienkiej złotej folii cząstkami alfacząstkami alfa, odkrytymi wcześniej przez Rutherforda. Cząstki te mają budowę identyczną jak jądra atomu helu, ale Ernest Rutherford podczas przeprowadzania doświadczenia jeszcze o tym nic nie wiedział. Sądził, że było to promieniowanie – strumień cząstek obdarzonych podwójnym ładunkiem dodatnim , którego źródłem była substancja promieniotwórcza.
Eksperyment Rutherforda był prosty w wykonaniu. Strumień cząstek padał na cienką złotą folię o grubości . Umieszczony wokół ekran rozbłyskiwał, gdy uderzyła w niego cząstka . Na podstawie obserwacji rozbłysków można było wyznaczyć zmianę kierunku poruszającej się cząstki. W późniejszych badaniach wykorzystywano również inne metale. Podczas badań Geiger i Marsden naliczyli ponad sto tysięcy rozbłysków spowodowanych przez cząstki .

Film dostępny na portalu epodreczniki.pl
Ilustracja przedstawia atom wodoru. Duże niebieskie koło po prawej stronie ilustracji. To atom wodoru. W środku koła małe żółte koło ze znakiem plus. Żółte poziome strzałki pokrywają całą ilustrację oraz lewą część atomu. Na ilustracji znajduje się piętnaście strzałek. Strzałki znajdują się w równych odległościach jedna nad drugą. Na prawym końcu każdej strzałki grot. Tylko dwie dolne i dwie górne strzałki są do siebie równoległe. Strzałki ulegają wygięciu. Im bliżej jądra atomu tym bardziej strzałki są odchylone w przeciwną stronę. Czwarta, piąta i szósta strzałka na dole jest skierowana w dół. Strzałki nad jądrem atomu również są wychylone. Strzałki nad jądrem wychylają się w górę. Trzy strzałki przed jądrem, po lewej stronie, są odchylone do tyłu, w lewo.
Opublikowane wyniki pomiarów były zdumiewające. Prawie wszystkie cząstki przechodziły przez folię bez zmiany kierunku ruchu, co było niemożliwe w modelu Thomsona. Z kolei znaczne odchylenia torów cząstek , które mogłyby wskazywać na występowanie dużej siły odpychającej cząstki obserwowano bardzo rzadko. Zdarzało się, że cząstka odbijała się od folii i biegła w przeciwną stronę. Rutherford miał nawet powiedzieć, że „…to było tak, jakbyś wystrzelił piętnastocalowy pocisk do kawałka bibułki, a ten pocisk odbił się od bibułki i uderzył w ciebie”.
Rutherford przez osiemnaście miesięcy zastanawiał się, co jest przyczyną, że niektóre cząstki promieniowania doznają tak silnego rozproszenia. Zastanawiało go, jaki jest znak ładunku jądra (Rutherford używał pojęcia „rdzeń”). W końcu fizyk doszedł do wniosku, że muszą one przechodzić w pobliżu pewnych ciał naładowanych dodatnio i mających niezwykle małe rozmiary.
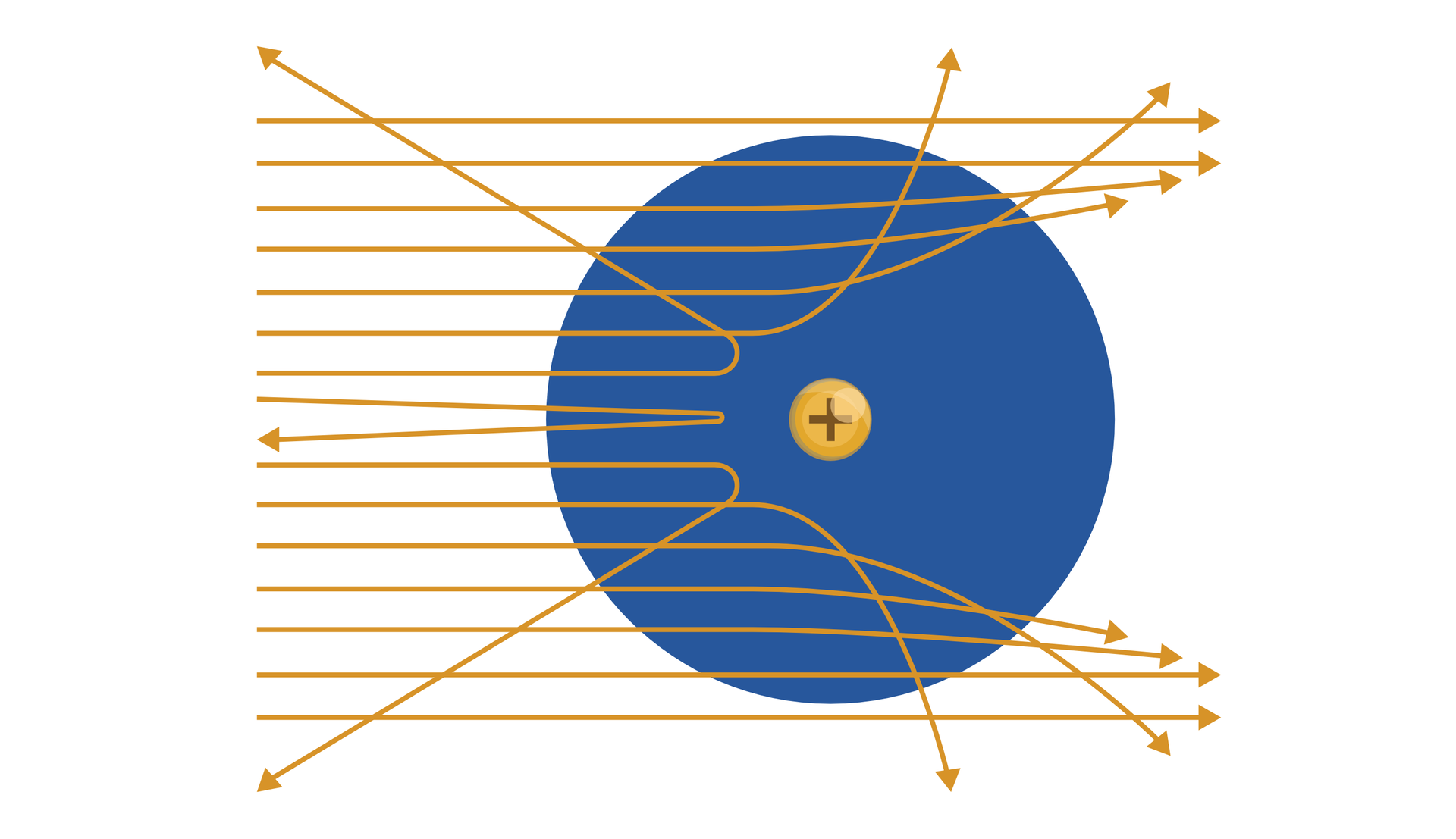
Rutherford przyjął, że w atomie dodatni ładunek jest skupiony w bardzo małej objętości atomu, co sugerowało istnienie jądra atomowego. Elektrony znajdujące się w atomie miały krążyć po zamkniętych orbitach wokół jądra, tak jak planety krążą wokół Słońca. Model ten nazwano planetarnym modelem budowy atomuplanetarnym modelem budowy atomu. Rutherford oszacował, że ciężkie jądro atomowe powinno mieć rozmiar , a oddziaływanie między jądrem a elektronami – charakter elektryczny (kulombowski). Uznał również, że ładunek elektryczny jądra i elektronów na powłokach są sobie równe co do wartości bezwzględnej, tak że atom jako całość pozostaje obojętny elektrycznie.
Model ten miał jednak wiele niedoskonałości. Stał w sprzeczności z fizyką klasyczną, ponieważ fale elektromognetyczne powinny być emitowane przez krążące elektrony w sposób ciągły, a zatem ich energia kinetyczna musiałaby się zmniejszać i ostatecznie elektrony powinny się zbliżać do jądra, czego nie zaobserwowano. Materia, którą znamy, jest stabilna, a elektrony nie spadają na jądra w atomach.
Jakie zjawisko obserwowane w doświadczeniu Rutherforda by nie zaszło, gdyby prawdziwy okazał się model budowy atomu Thomsona? Dlaczego?
Średnica atomu jest rzędu , a średnica jądra to . Oblicz średnicę atomu w modelu, w którym średnica jądra wynosi .
2. Model budowy atomu wodoru stworzony przez Bohra (1913 r.)
Duński fizyk Niels BohrNiels Bohr był uczniem Thomsona, ale bardziej cenił sobie współpracę z Ernestem Rutherfordem. Budowa atomu odkryta przez Rutherforda stała się podstawą do rozważań Bohra nad niezrozumiałymi faktami dotyczącymi tego modelu.
Co sprawia, że atom jest stabilny?
Co decyduje o rozmiarach atomu?
Co różni atomy różnych pierwiastków?
Gdy Bohr dowiedział się o wzorze Balmera, zrozumiał, że rozwiązanie tych problemów jest tylko kwestią czasu.
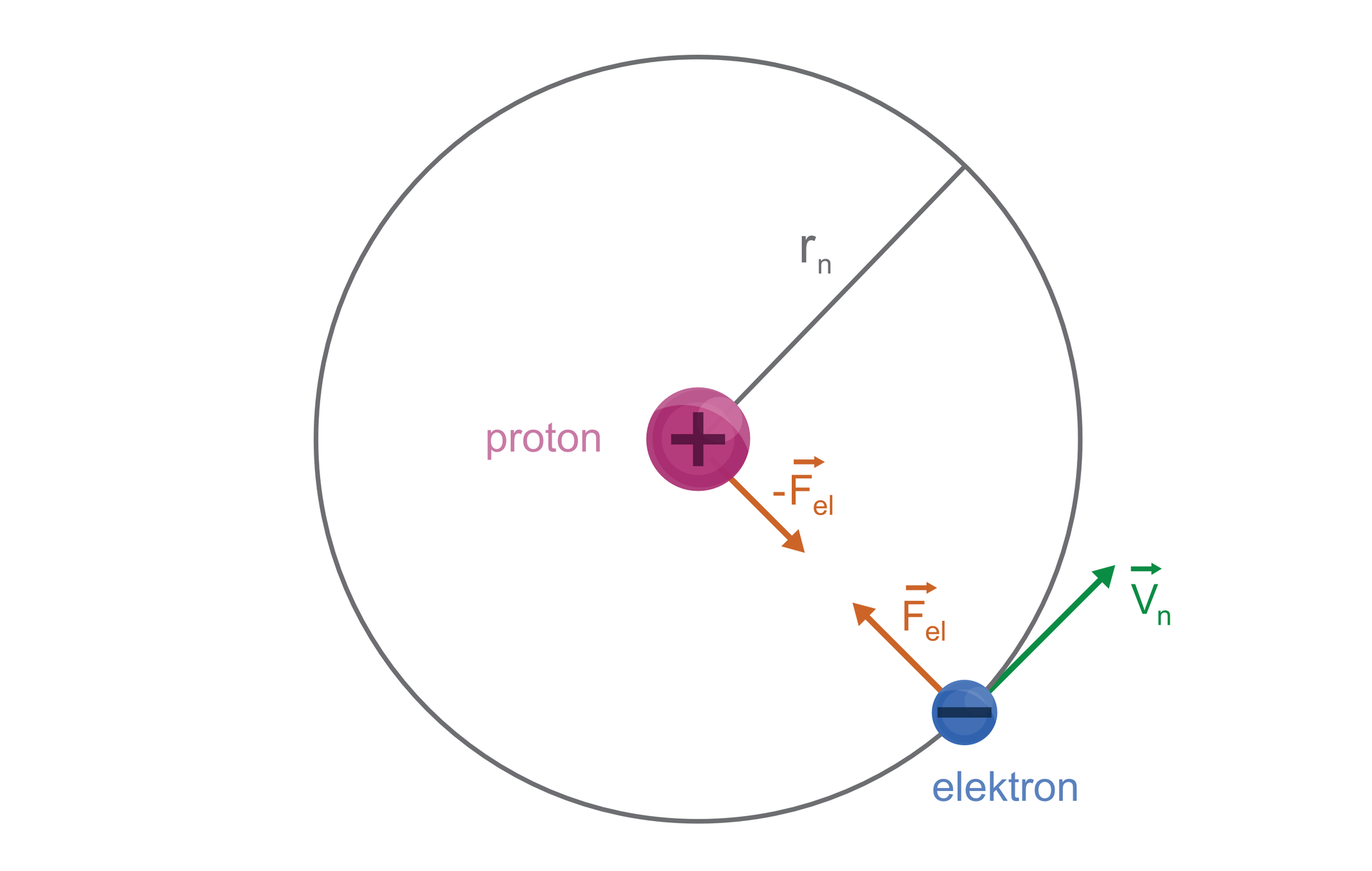
Bohr korzystał z modelu atomu Rutherforda i przyjął, że atom wodoru zbudowany jest z dodatnio naładowanego jądra – protonu, wokół którego krąży ujemnie naładowany elektron. Cząstki te przyciągają się wzajemnie siłami zgodnymi z prawem Coulomba. Fizyk rozpatrywał energię całkowitą atomu jako sumę energii kinetycznej elektronu i energii potencjalnej układu proton – elektron. Jednak aby wyjaśnić stabilność atomów oraz kwestię emisji i absorpcji energii przez atom, przyjął dwa postulaty:
1. Elektron krążący wokół jądra nie wysyła energii (jak wynikało to z fizyki klasycznej), jeżeli promień tej orbity i prędkość elektronu spełniają warunek:
gdzie:
promień orbity, po której krąży elektron;
masa elektronu;
wartość prędkości liniowej krążącego elektronu;
liczba całkowita określająca numer orbity elektronu;
stała Plancka .
Założenie to nazywane jest pierwszym postulatem Bohra, a takie orbity – orbitami stacjonarnymi.
2. Procesowi przejścia elektronu z jednej orbity na drugą towarzyszy albo wysłanie, albo zaabsorbowanie pewnej ściśle określonej porcji energii (kwantu energii, fotonu).
Bohr założył, że do zmian energii atomu może dojść tylko wtedy, gdy elektron przechodzi z orbity znajdującej się bliżej jądra na orbitę dalszą (lub odwrotnie). Zmiana energii równa jest porcji (kwantowi) energii, która zgodnie ze wzorem Plancka jest równa:
gdzie:
, – odpowiednie numery orbit elektronu;
stała Plancka;
częstotliwość promieniowania elektromagnetycznego;
długość fali promieniowania elektromagnetycznego;
prędkość światła w próżni.
Warunek ten, nazywany drugim postulatem Bohra, związany jest z przejściem elektronu z jednej orbity na drugą.
Rozważania i obliczenia uwzględniające siły, jakimi działają na siebie jądro wodoru i elektron, związek energii całkowitej atomu z energią kinetyczną elektronu i energią potencjalną układu proton–elektron w połączeniu z I postulatem Bohra doprowadziły do otrzymania zależności:
Promień orbity stacjonarnej można wyrazić wzorem:
Energię całkowitą atomu wodoru można przedstawić wzorem:
Jak widać, obie zależności zawierają wielkość oznaczoną literą , która nazywana jest główną liczbą kwantową.
Wartość promienia dla jest równa ; nazywana jest promieniem pierwszej orbity Bohra w atomie wodoru. Promień drugiej orbity jest 4 razy większy, trzeciej razy większy itd. Obecnie wartości tych promieni mają znaczenie jedynie historyczne – według nowych teorii opisujących atom elektron nie jest już naładowaną ujemnie kulką.
Energia całkowita atomu wodoru (po podstawieniu odpowiednich wartości liczbowych) może być wyrażona jako:
, gdzie:
Z tej zależności wynika, że energia atomu jest ujemna. Oznacza to, że atom wodoru nie może się samorzutnie rozpaść na jądro i elektron.
Najmniejszą energię ma atom wodoru w stanie, dla którego . Jest ona równa . Ten stan nazywamy stanem podstawowymstanem podstawowym. Wartości energii dla , przedstawione w poniższej tabeli, dotyczą atomów znajdujących się na jednym z wyższych poziomów energetycznych.
Bardzo często wykonujemy rysunek przedstawiający wartości energii atomu wodoru.

Widzimy zatem, że energia atomu nie może być dowolna. Stany, w których elektron znajduje się na wyższych poziomach energetycznych, czyli itd., nazywamy stanami wzbudzonymistanami wzbudzonymi, ponieważ atom wodoru musi wtedy zwiększyć swoją energię do odpowiedniej wartości. Aby to lepiej zrozumieć, można posłużyć się pewną dość prostą analogią do prostopadłościanu o krawędziach .

Prostopadłościan ten można położyć stabilnie tylko na jednej z trzech różnych ścian. Położenie , w którym prostopadłościan leży na ścianie , oznacza, że ma on najniższą energię potencjalną w stosunku do podłoża. Położenie , w którym prostopadłościan leży na ścianie , oznacza większą energię potencjalną, a położenie III, czyli na ścianie – największą (przedyskutujcie w klasie, dlaczego tak jest). Oczywiście, aby przenieść prostopadłościan ze stanu do albo ze stanu do , trzeba wykonać pracę o wartości różnicy energii potencjalnych.
Oblicz wartość energii, jaką musi pochłonąć atom znajdujący się na poziomie podstawowym, aby przejść na drugi poziom.
Energia na drugim poziomie jest równa (posłużymy się zależnościami ogólnymi):
a energia na pierwszym poziomie: . Z obliczeń wynika, że atom musi zwiększyć swoją energię o .
Oblicz wartość energii, jaką musi pochłonąć atom wodoru, aby przejść z drugiego poziomu () na trzeci poziom ().
Energia na trzecim poziomie wynosi: , a energia na drugim poziomie:
Po podstawieniu wartości otrzymamy
Z powyższych rozważań wynika, że pochłonięcie kwantu promieniowania przez atom może skutkować przeskokiem elektronu na wyższy poziom energetyczny (atom wodoru przechodzi w stan wzbudzony) tylko wówczas, gdy energia promieniowania jest równa dokładnie różnicy między wybranymi stanami energetycznymi. Natomiast gdy elektron powraca na niższy poziom energetyczny, musi wypromieniować energię w postaci promieniowania elektromagnetycznego o wartości równej dokładnie różnicy energii między poziomami energetycznymi. Możliwe są sytuacje, w których atom pochłania taką energię, że przechodzi np. z pierwszego poziomu od razu na czwarty. W stanie wzbudzonym atom „przebywa” krótko – przeciętnie (jedna stumilionowa część sekundy). Potem pozbywa się nadmiaru energii i przechodzi na jeden z poziomów o niższej energii – może przeskoczyć od razu na pierwszy poziom, ale często jest to przejście stopniowe (etapowe) najpierw na trzeci poziom, potem na drugi itd. Podczas każdego przejścia atom wysyła kwant energii, co oznacza emisję promieniowania o ściśle określonej długości fali (barwie).
Warto wspomnieć o tym, w jaki sposób możemy pobudzić atomy gazu do świecenia. Odbywa się to w ten sposób, że podczas zderzenia atomów (jak wiemy, poruszają się one tym szybciej, im wyższa jest temperatura) następuje pochłonięcie energii kinetycznej, w wyniku czego atom przechodzi z poziomu podstawowego na jeden z poziomów wzbudzonych. Właśnie wtedy mówimy o wzbudzeniu termicznym. Potem następują procesy przechodzenia na niższe poziomy energetyczne i wysyłanie jednego lub kilku kwantów promieniowania.
Model Bohra sprawdzał się dobrze w trakcie badań atomu wodoru. Zgodność obliczeń z wynikami pomiarów była w pełni satysfakcjonująca. Jednak uogólnienie tego modelu na atomy innych pierwiastków niosło wiele problemów. Wynikało to np. z tego, że w atomie wodoru rozpatrujemy oddziaływania jednego protonu z jednym elektronem. W atomie helu mamy już dwa ładunki elementarne w jądrze i dwa elektrony. Ponadto nie tylko jądro działa na każdy z elektronów, lecz także one oddziałują ze sobą. Jeżeli jednak będziemy analizować atom zjonizowanego helu, w którym wokół jądra krąży tylko jeden elektron, to opis okaże się znacznie prostszy, a jego widmo – bardzo podobne do widma wodoru. Oczywiście, długości emitowanych i absorbowanych fal są inne – zawsze wiadomo, z którym pierwiastkiem mamy do czynienia. Łatwo można opisać również atomy wodoropodobne, takie jak sód, w których na ostatniej orbicie krąży jeden elektron.
Oddziaływania w atomach wieloelektronowych są bardzo złożone i, jak się później okazało, nie tylko energia jest skwantowana – inne wielkości fizyczne także mogą przyjmować tylko ściśle określoną wartość. Należą do nich moment pędu, orbitalny moment magnetyczny i tzw. moment spinowy (będziecie mogli je poznać w dalszym toku nauki). Bohr wprowadził swoje postulaty, aby uzyskać zgodność z obserwacjami. W następnych latach zrozumiano, dlaczego prawdziwy jest pierwszy postulat Bohra, ale wtedy już nie traktowano elektronu jako kulki mającej ładunek elektryczny. Te dwie teorie (potwierdzone doświadczalnie) – model planetarny Rutherforda i model Bohra – stały się podstawą zrozumienia procesów w świecie atomów. Powstała mechanika kwantowa, pozwalająca wyjaśnić atomową budowę ciał stałych, co z kolei doprowadziło do poznania ich wielu niezwykłych właściwości. Odkrycie półprzewodników sprawiło, że wiele nowoczesnych urządzeń zostało zminiaturyzowanych; teraz urządzenia, które kiedyś zajmowałyby ogromne pomieszczenia, mieszczą się w kieszeni. Na płytce wielkości paznokcia możemy mieć bibliotekę tysięcy audiobooków lub e‑booków, zapisać film, nawet gdyby trwał on kilkadziesiąt godzin, lub przechować kilkaset godzin muzyki.
Pomiędzy np. piątym poziomem energetycznym a ostatnim, w którym energia atomu jest równa zero, jest nieskończenie wiele poziomów energetycznych. Uzasadnij, dlaczego nie oznacza to, że energia atomu wodoru może przyjmować dowolną wartość.
W drugim przykładzie obliczyłeś, że przejście atomu z poziomu drugiego na trzeci wymaga pochłonięcia energii o wartości około . Oblicz długość fali promieniowania, której kwant został pochłonięty. Jaka jest barwa światła o tej długości fali?
Podsumowanie
Model atomu wodoru stworzony przez Bohra powstał na podstawie faktów doświadczalnych, które doprowadziły do wprowadzenia pojęć nieznanych dotąd fizyce klasycznej:
Opis promieniowania ciała doskonale czarnego i fotoefekt:
pojęcie kwantu energii promieniowania;
pojęcie fotonu;
promieniowanie elektromagnetyczne jako strumień cząstek.
Liniowe widmo atomu wodoru:
widmo atomu wodoru w opisie fizyki klasycznej powinno mieć charakter ciągły;
seria widmowa Balmera.
Model atomu Thomsona:
atom ma strukturę, w skład której wchodzą elektrony.
Model atomu Rutherforda:
atom składa się z ciężkiego jądra i elektronów krążących wokół niego;
atom jest obojętny elektrycznie;
za oddziaływania między jądrem atomu, a jego powłoką odpowiada siła Coulomba;
znane są rozmiary atomu i jego jądra.
Teoria atomu wodoru stworzona przez Bohra opierała się na dwóch postulatach:
elektron znajdujący się na orbicie stacjonarnej (dozwolonej) nie emituje fali elektromagnetycznej;
elektron emituje lub absorbuje energię w postaci kwantu promieniowania () podczas przejścia między jedną a drugą orbitą stacjonarną.
Za pomocą modelu Bohra można wyjaśnić układ linii widmowych atomu wodoru.
Model atomu Bohra pozwala opisać precyzyjnie budowę jedynie atomu wodoru; zawodzi w odniesieniu do atomów mających bardziej złożone jądro atomowe, wokół którego krąży więcej elektronów.
Dzięki modelowi Bohra stworzono podstawy nowej gałęzi fizyki współczesnej – mechaniki kwantowej.
Na schemacie układu poziomów energetycznych atomu wodoru narysuj przejście z poziomu trzeciego na drugi, z czwartego na drugi i z piątego na drugi. Oblicz wartości energii emitowanej za każdym razem oraz długości fal otrzymanego promieniowania. Porównaj wyniki obliczeń z długościami linii widmowych wodoru.
Oblicz długości fali promieniowania wysyłanego przez atom wodoru podczas przejścia z drugiego poziomu na podstawowy i z czwartego poziomu na trzeci. W jakich obszarach promieniowania elektromagnetycznego (radiowe, podczerwień, widzialne, nadfiolet) znajduje się to promieniowanie?
Uwaga: poniższe zadania warto przedyskutować również podczas lekcji.
* W atmosferze gwiazdy, podobnie jak w każdym gazie, atomy poruszają się ruchem chaotycznym, zderzając się wzajemnie. W gazie o niskiej temperaturze większość atomów znajduje się zatem na poziomie podstawowym, ale w wyższych temperaturach energia zderzeń jest na tyle duża, że przeciętny atom znajduje się na drugim poziomie (jest tak w temperaturze rzędu 9 000–11 000 K). Atom wodoru znajdujący się w tym stanie pochłania (absorbuje) fotony biegnące z wnętrza gwiazdy i przechodzi na jeden z wyższych poziomów energetycznych. W jakim obszarze widma (podczerwień, światło widzialne, ultrafiolet) odbywa się ta absorpcja? Odpowiedź uzasadnij (skorzystaj z wyników obliczeń w poprzednim poleceniu).
* Każdy atom lub jon emituje lub pochłania promieniowanie o innych długościach fali. Ma też charakterystyczne widmo pierwiastka. Kiedy astronomowie badali widma dwóch gwiazd, stwierdzili, że w pierwszej gwieździe dominują linie pierwiastków w stanie neutralnym, a w drugiej – głównie pierwiastków zjonizowanych. Jaki wniosek mogą sformułować astronomowie na tej podstawie? Uzasadnij odpowiedź.
* Kiedy badano widmo Słońca, wykryto obecność pierwiastka nieznanego wtedy na Ziemi. Był to hel. Kilkadziesiąt lat później, podczas badań widma korony słonecznej (atmosfery Słońca, którą widać podczas jego całkowitych zaćmień), stwierdzono ponownie obecność linii nieznanych pierwiastków. Jeden z nich nazwano „koronium”. Po niedługim czasie okazało się, że są to linie pierwiastków znanych na Ziemi, ale wielokrotnie zjonizowanych (np. żelazo pozbawione kilkunastu elektronów). Świadczyło to o bardzo wysokiej temperaturze. Dlaczego?
Temperatura korony słonecznej wynosi od miliona do dwóch milionów kelwinów i jest znacznie wyższa od temperatury powierzchni Słońca.
Zadania podsumowujące moduł
Wybierz prawidłową ilość sposobów jakimi elektron może przejść z orbity 3, na poziom podstawowy.
dwa, cztery, jeden, trzy
Wzbudzony atom wodoru znajdujący się na trzecim poziomie energetycznym może przejść na poziom podstawowy na ............ sposób/sposoby.
Które informacje są prawdziwe, a które fałszywe?
| Prawda | Fałsz | |
| Zgodnie z fizyką klasyczną atom wodoru powinien emitować widmo liniowe. | □ | □ |
| Zgodnie z fizyką klasyczną w modelu Rutherforda elektron powinien spaść na jądro. | □ | □ |
| Atom znajdujący się w stanie wzbudzonym, wracając do stanu podstawowego, może wyemitować więcej niż jeden foton, jeżeli nie znajduje się na pierwszym poziomie wzbudzonym. | □ | □ |
Słowniczek
– jądro atomu helu.
– trwała cząstka elementarna o ujemnym ładunku elektrycznym wynoszącym .
– model atomu wodoru zaproponowany w 1913 r. przez Nielsa Bohra. Zgodnie z jego koncepcją wokół dodatnio naładowanego jądra krąży elektron, który porusza się po zamkniętej orbicie stacjonarnej. Atom w modelu Bohra może przyjmować jedynie pewne ściśle określone (dyskretne) wartości energii; również elektron może krążyć jedynie po orbitach o ustalonym promieniu. W celu zmiany stanu energetycznego atomu należy dostarczyć mu ściśle określoną porcję (kwant) energii. Przejściu atomu do stanu o niższej energii towarzyszy emisja kwantu promieniowania elektromagnetycznego o ściśle określonej długości fali.
– model budowy atomu zaproponowany przez Rutherforda. Według tej koncepcji elektrony krążą wokół małego jądra naładowanego dodatnio.
– stan energetyczny atomu o najniższej możliwej energii.
– stan energetyczny atomu wyższy niż podstawowy, tj. taki, w którym elektron przeszedł na wyższą orbitę i zyskał energię dzięki absorpcji promieniowania albo zderzenia z innym atomem.
Biogramy

Niels Bohr
Duński fizyk, współtwórca mechaniki kwantowej. Brał dział w budowie pierwszej bomby atomowej w ramach projektu „Manhattan”.

Johannes Geiger
Niemiecki fizyk, który wspólnie z Walterem Müllerem opracował licznik promieniowania, nazwany na ich cześć licznikiem Geigera‑Müllera.

Ernest Marsden
Jeden z czołowych nowozelandzkich fizyków. W czasie II wojny światowej prowadził prace nad radarem.

Ernest Rutherford
Nowozelandzki fizyk. Badał pierwiastki promieniotwórcze, odkrył, że źródłem promieniowania jest spontaniczny rozpad pierwiastków, za co otrzymał Nagrodę Nobla.
Joseph John Thomson
Angielski fizyk, który otrzymał Nagrodę Nobla za badanie przewodnictwa elektrycznego gazów, co doprowadziło do odkrycia elektronu.