Dysocjacja elektrolityczna soli
Czy sole podobnie jak kwasy i wodorotlenki, od których pochodzą, ulegają w wodzie tym samym procesom?
że sole są związkami jonowymi, a ich sieć krystaliczna jest zbudowana z kationów metali i anionów reszt kwasowych;
że wodorotlenki rozpuszczalne w wodzie ulegają dysocjacji elektrolitycznej (dysocjują) na kationy metalu i aniony wodorotlenkowe;
że kwasy dysocjują na kationy wodoru i aniony reszty kwasowej.
zapisywać równania procesu dysocjacji elektrolitycznej soli.
1. Czy wszystkie sole rozpuszczają się w wodzie?
Czy wszystkie sole rozpuszczają się w wodzie w jednakowym stopniu?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Wszystkie sole rozpuszczają w wodzie.
Są sole, które dobrze rozpuszczają się w wodzie, i takie, które są trudno rozpuszczalne.
Sole są nierozpuszczalne w wodzie.
zlewki,
bagietki szklane,
łyżeczki,
woda,
chlorek wapnia,
chlorek sodu,
siarczan(VI) magnezu,
węglan magnezu,
węglan wapnia,
fosforan(V) wapnia,
węglan sodu.
Do siedmiu jednakowych zlewek wlej identyczną objętość wody (50 cmIndeks górny 33).
Do każdej z nich wsyp 3–5 g substancji:
do zlewki 1. – chlorku wapnia,
do zlewki 2. – chlorku sodu,
do zlewki 3. – siarczanu(VI) magnezu,
do zlewki 4. – węglanu magnezu,
do zlewki 5. – węglanu wapnia,
do zlewki 6. – fosforanu(V) wapnia,
do zlewki 7. – węglanu sodu.
Zawartość wszystkich zlewek dokładnie wymieszaj za pomocą bagietki.
Obserwuj, czy wszystkie substancje stałe rozpuszczają się w wodzie.
Po pewnym czasie sole takie jak: chlorek wapnia, chlorek sodu, siarczan(VI) magnezu, węglan sodu uległy rozpuszczeniu. W zlewkach z pozostałymi solami pozostały nierozpuszczone osady. Badane substancje rozpuściły się w wodzie w różnym stopniu.
Sole nie rozpuszczają się w wodzie w jednakowym stopniu. Wśród nich można znaleźć sole bardzo dobrze rozpuszczalne w wodzie, jak na przykład azotan(V) potasu, oraz takie, które nie rozpuszczają się w niej prawie wcale – np. siarczan(VI) baru. Ten sam metal może tworzyć sole zarówno dobrze, jak i słabo rozpuszczalne w wodzie, np. chlorek wapnia i węglan wapnia. Podobnie, sole zawierające ten sam anion reszty kwasowej mogą różnić się rozpuszczalnością, np. węglan wapnia i węglan sodu.
2. Gdzie zdobyć informacje o tym, które sole rozpuszczają się w wodzie?
Informacje o tym, czy dana sól będzie rozpuszczać się w wodzie, możemy znaleźć w tablicy rozpuszczalności. Zawarte w niej informacje pozwolą nam ocenić, czy dana sól jest dobrze, trudno czy praktycznie zupełnie nierozpuszczalna w wodzie. Aby określić tę właściwość dla wybranej soli, należy odczytać zapis umieszczony na przecięciu kolumny kationu z wierszem anionu (jonów tworzących interesującą nas sól).


Wszystkie znane sole sodu, potasu, amonu oraz wszystkie znane azotany(V) są bardzo dobrze rozpuszczalne w wodzie.
3. Czy wodne roztwory soli przewodzą prąd elektryczny?
Czy wodne roztwory soli przewodzą prąd elektryczny?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Wodne roztwory soli przewodzą prąd elektryczny.
Wodne roztwory soli nie przewodzą prądu elektrycznego.
zlewki,
bagietki szklane,
łyżeczki,
woda,
urządzenie z żarówką do badania przewodnictwa elektrycznego roztworów,
chlorek wapnia,
chlorek sodu (sól kamienna),
siarczan(VI) magnezu,
węglan sodu,
azotan(V) potasu.
Przygotuj w zlewkach pięć roztworów rozpuszczalnych w wodzie dowolnych soli, np.:
chlorku wapnia,
chlorku sodu,
siarczanu(VI) magnezu,
węglanu sodu,
azotanu(V) potasu.
Przygotuj zlewkę z wodą destylowaną.
Zbadaj za pomocą przyrządu do badania przewodnictwa elektrycznego, czy przygotowane roztwory przewodzą prąd elektryczny.

Sole w stanie stałym nie przewodzą prądu elektrycznego. Dopiero pod wpływem wody ulegają procesom, które umożliwiają im przenoszenie ładunków elektrycznych.
4. Co dzieje się z solami podczas rozpuszczania w wodzie?
Rozpuszczalne w wodzie sole są elektrolitami, ich wodne roztwory przewodzą prąd elektryczny. Pod wpływem wody rozpadają się na jony, z których są zbudowane, czyli na kationy metali i aniony reszty kwasowej. Proces ten, jak pamiętamy, nazywa się dysocjacją elektrolityczną.
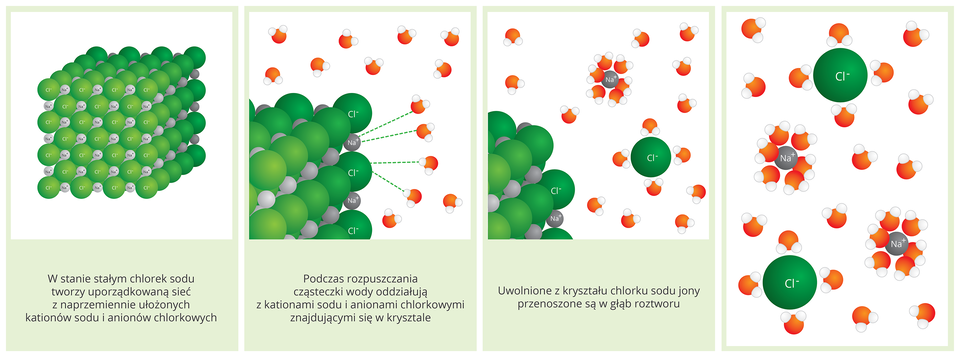
Film dostępny na portalu epodreczniki.pl
Rozpuszczanie chlodku sodu
Nazwa soli | Wzór sumaryczny soli | Dysocjacja soli |
chlorek sodu | ||
azotan(V) potasu | ||
siarczan(VI) miedzi(II) | ||
fosforan(V) potasu | ||
azotan(V) ołowiu(II) | ||
siarczan(VI) żelaza(III) |
Podsumowanie
Istnieją sole, które rozpuszczają się w wodzie, i sole trudno lub praktycznie nierozpuszczalne w wodzie.
Wodne roztwory soli przewodzą prąd elektryczny – sole są elektrolitami.
Sole w wodzie ulegają dysocjacji elektrolitycznej, czyli rozpadają się (dysocjują) na kationy metali i aniony reszty kwasowej.
Na podstawie informacji zawartych w tablicy rozpuszczalności, ustal, które z kationów tworzą najmniej rozpuszczalnych w wodzie soli. W podobny sposób oceń aniony reszt kwasowych.
Zadania
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Sole w stanie stałym przewodzą prąd elektryczny. | □ | □ |
| Sole należą do elektrolitów. | □ | □ |
| Wszystkie sole są rozpuszczalne w wodzie. | □ | □ |
| W procesie dysocjacji soli powstają kationy metali i aniony wodorotlenkowe. | □ | □ |
Na podstawie informacji zawartych w tablicy rozpuszczalności podziel sole na rozpuszczalne i trudno rozpuszczalne w wodzie.
<span aria-label="K indeks dolny, 2, S" role="math"><math><mrow><msub><mtext>K</mtext><mtext>2</mtext></msub><mtext>S</mtext></mrow></math></span>, <span aria-label="PbS" role="math"><math><mrow><mtext>PbS</mtext></mrow></math></span>, <span aria-label="Fe indeks dolny, 2, S indeks dolny, 3" role="math"><math><mrow><msub><mtext>Fe</mtext><mtext>2</mtext></msub><msub><mtext>S</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="Ag indeks dolny, 2, CO indeks dolny, 3" role="math"><math><mrow><msub><mtext>Ag</mtext><mtext>2</mtext></msub><msub><mtext>CO</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="AgNO indeks dolny, 3" role="math"><math><mrow><msub><mtext>AgNO</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="ZnS" role="math"><math><mrow><mtext>ZnS</mtext></mrow></math></span>, <span aria-label="BaCO indeks dolny, 3" role="math"><math><mrow><msub><mtext>BaCO</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="Na indeks dolny, 2, CO indeks dolny, 3" role="math"><math><mrow><msub><mtext>Na</mtext><mtext>2</mtext></msub><msub><mtext>CO</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="KNO indeks dolny, 3" role="math"><math><mrow><msub><mtext>KNO</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="Al indeks dolny, 2, nawias SO indeks dolny, 4, zamknięcie nawiasu indeks dolny, 3" role="math"><math><mrow><msub><mrow><msub><mtext>Al</mtext><mtext>2</mtext></msub><mtext>(</mtext><msub><mtext>SO</mtext><mtext>4</mtext></msub><mtext>)</mtext></mrow><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="MgCO indeks dolny, 3" role="math"><math><mrow><msub><mtext>MgCO</mtext><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="Fe indeks dolny, 2, nawias SO indeks dolny, 4, zamknięcie nawiasu indeks dolny, 3" role="math"><math><mrow><msub><mrow><msub><mtext>Fe</mtext><mtext>2</mtext></msub><mtext>(</mtext><msub><mtext>SO</mtext><mtext>4</mtext></msub><mtext>)</mtext></mrow><mtext>3</mtext></msub></mrow></math></span>, <span aria-label="CaCl indeks dolny, 2" role="math"><math><mrow><msub><mtext>CaCl</mtext><mtext>2</mtext></msub></mrow></math></span>, <span aria-label="Al( NO indeks dolny, 3, zamknięcie nawiasu indeks dolny, 3" role="math"><math><mrow><msub><mrow><mtext>Al(</mtext><msub><mtext>NO</mtext><mtext>3</mtext></msub><mtext>)</mtext></mrow><mtext>3</mtext></msub></mrow></math></span>
| sole rozpuszczalne w wodzie | |
|---|---|
| sole praktycznie nierozpuszczalne w wodzie |
Wskaż zapis, który prawidłowo przedstawia proces dysocjacji azotanu(V) żelaza(III).
Wskaż równanie, które prawidłowo przedstawia proces dysocjacji fosforanu(V) sodu.
Która grupa podanych substancji zawiera związki będące elektrolitami w roztworze wodnym?
Uporządkuj roztwory soli według wzrastającej liczby powstającej liczby jonów powstających podczas dysocjacji najmniejszego zbioru powtarzających się jonów w kryształach tych soli.
- roztwór fosforanu(V) potasu
- roztwór siarczku sodu
- roztwór siarczanu(VI) żelaza(III)
- roztwór siarczku baru