Gra edukacyjna
Produkujemy polipeptydy
Zagraj w quiz sprawdzający Twoją wiedzę na temat produkcji polipeptydów. Gra składa się z trzech następujących po sobie etapów. Żeby przejść do kolejnego, konieczne jest ukończenie poprzedniego z pozytywnym wynikiem. W odpowiedzi na pytania może okazać się przydatna tabela aminokwasów zamieszczona poniżej. Powodzenia!
Produkujemy polipeptydy
Wiązanie peptydowe to:
- CONH
- COOH
- COO
- COH
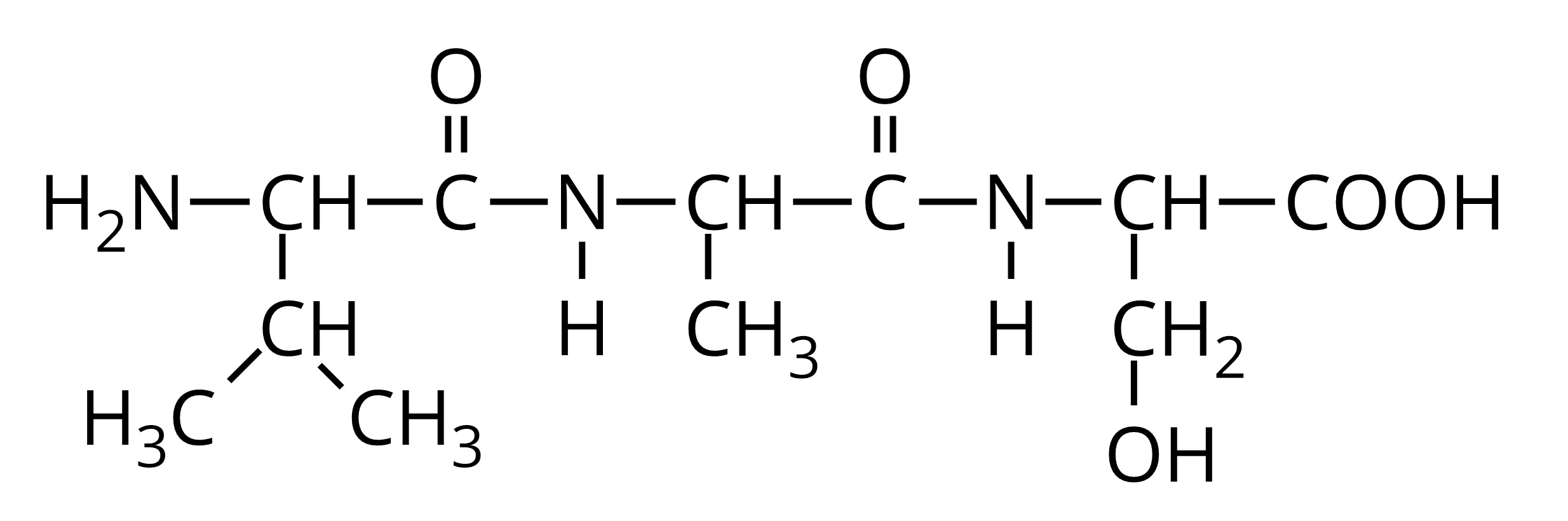
Poniższy wzór przedstawia dipeptyd:
- His-Leu
- Pro-Gln
- Phe-Thr
- Tyr-Ser

Poniżej przedstawiono wzory czterech tripeptydów, powstałych w reakcji kondensacji tyrozyny, leucyny i treoniny. Zaznacz tripeptyd Tyr-Leu-Thr.
- 1
- 2
- 3
- 4

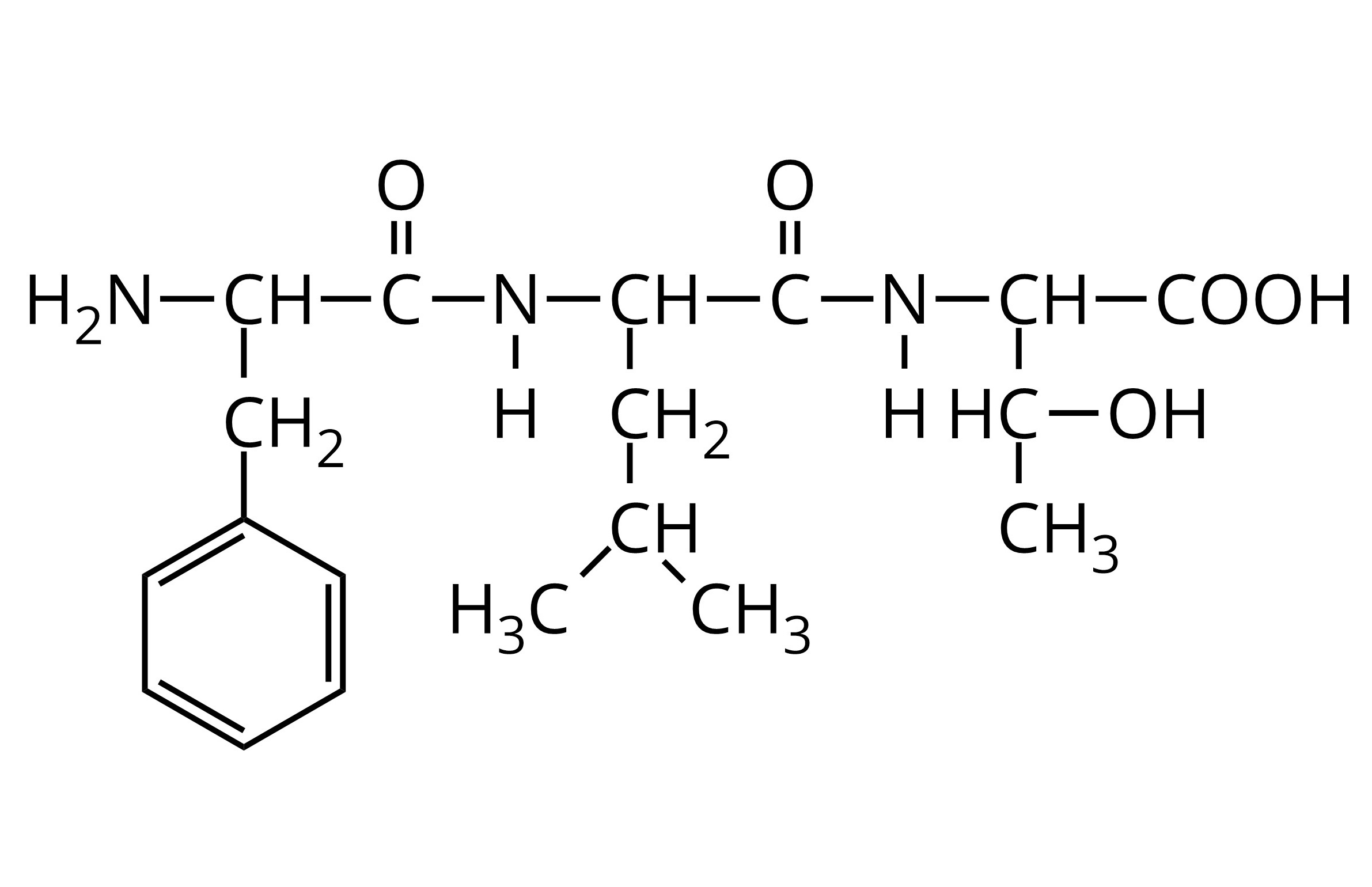
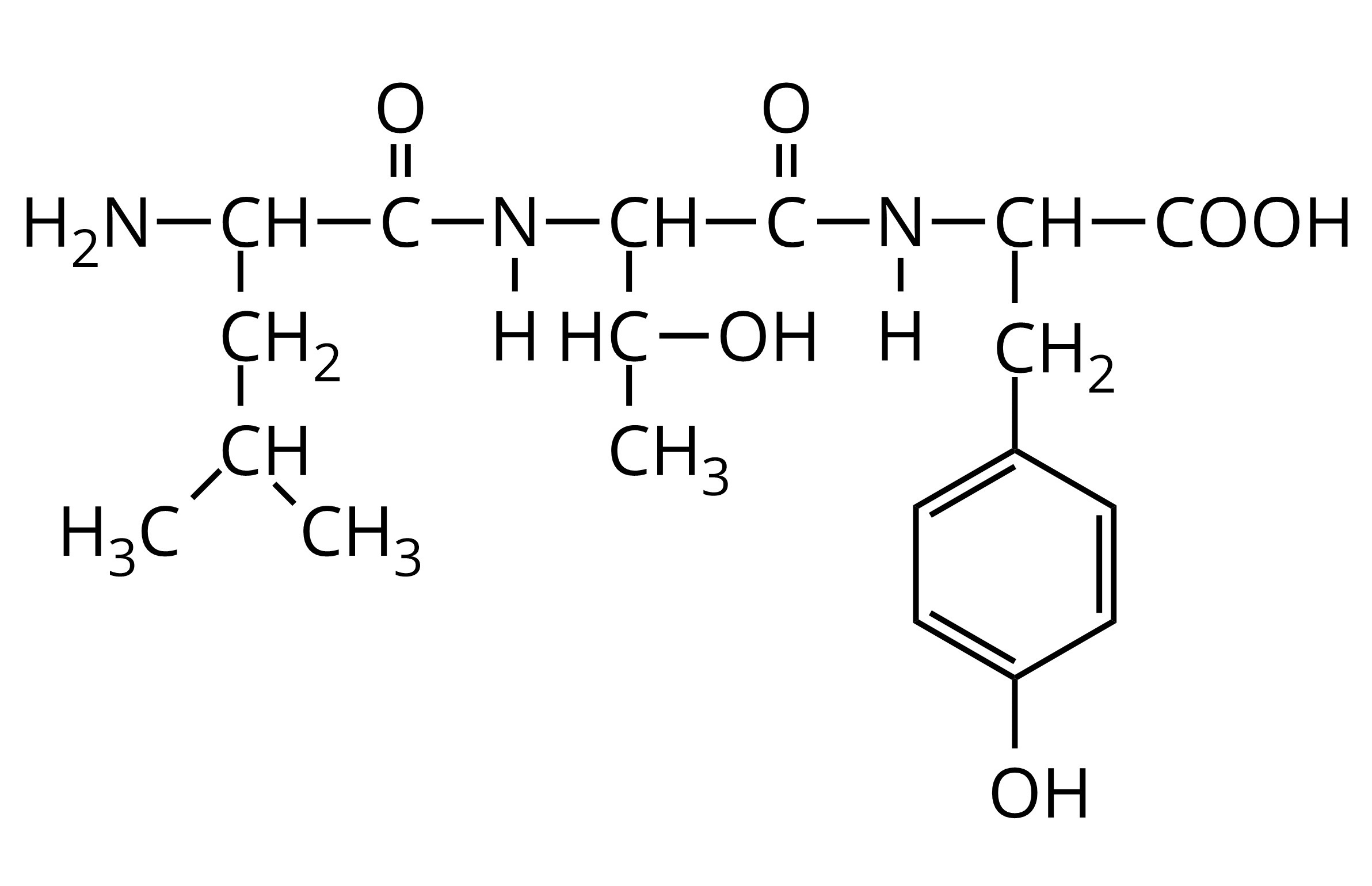
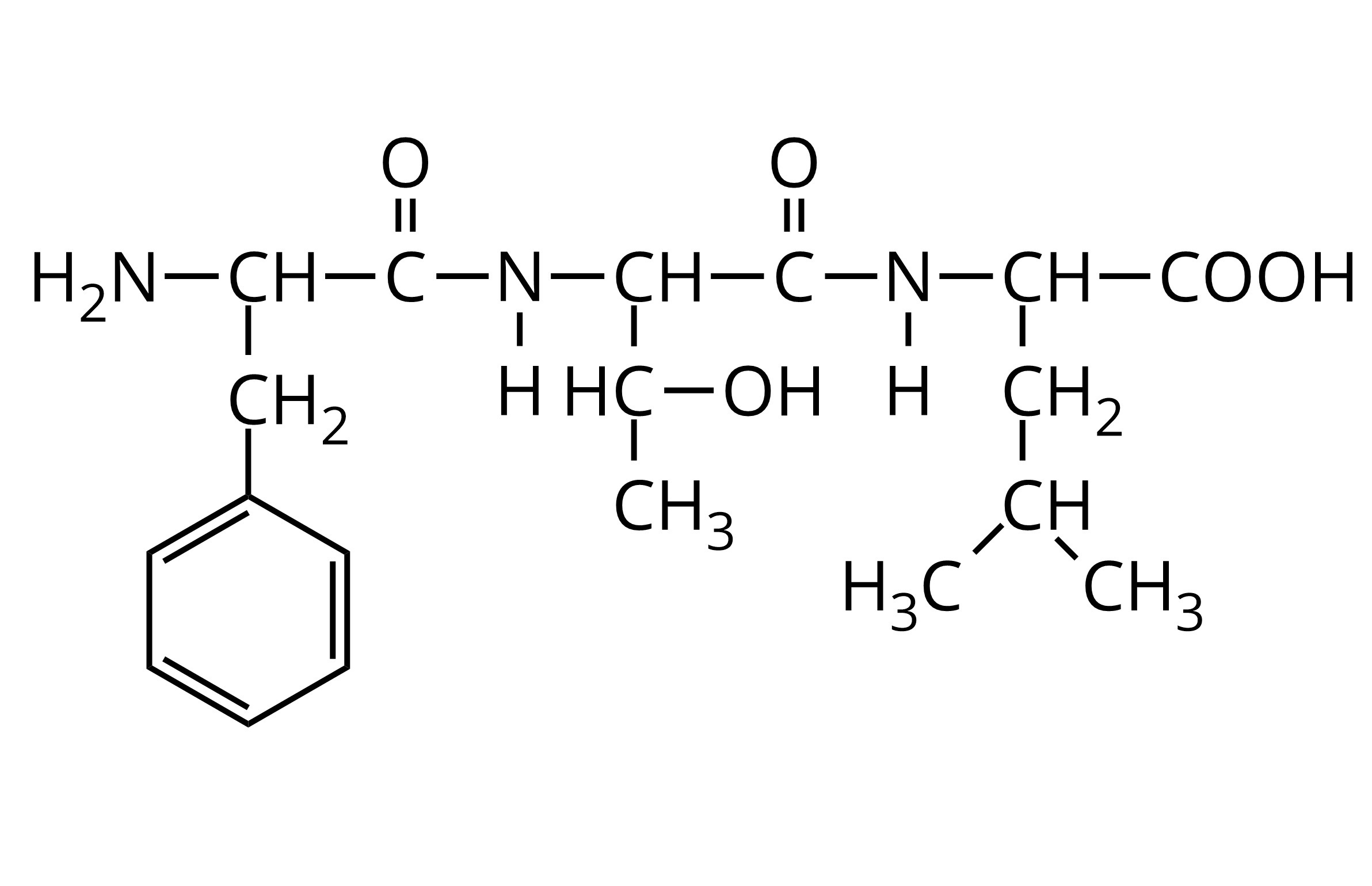
W wyniku kondensacji treoniny otrzymano peptyd, któremu można przypisać wzór przedstawiony poniżej. Określ liczbę wiązań peptydowych w cząsteczce tego peptydu.
- 4
- 5
- 6
- 7
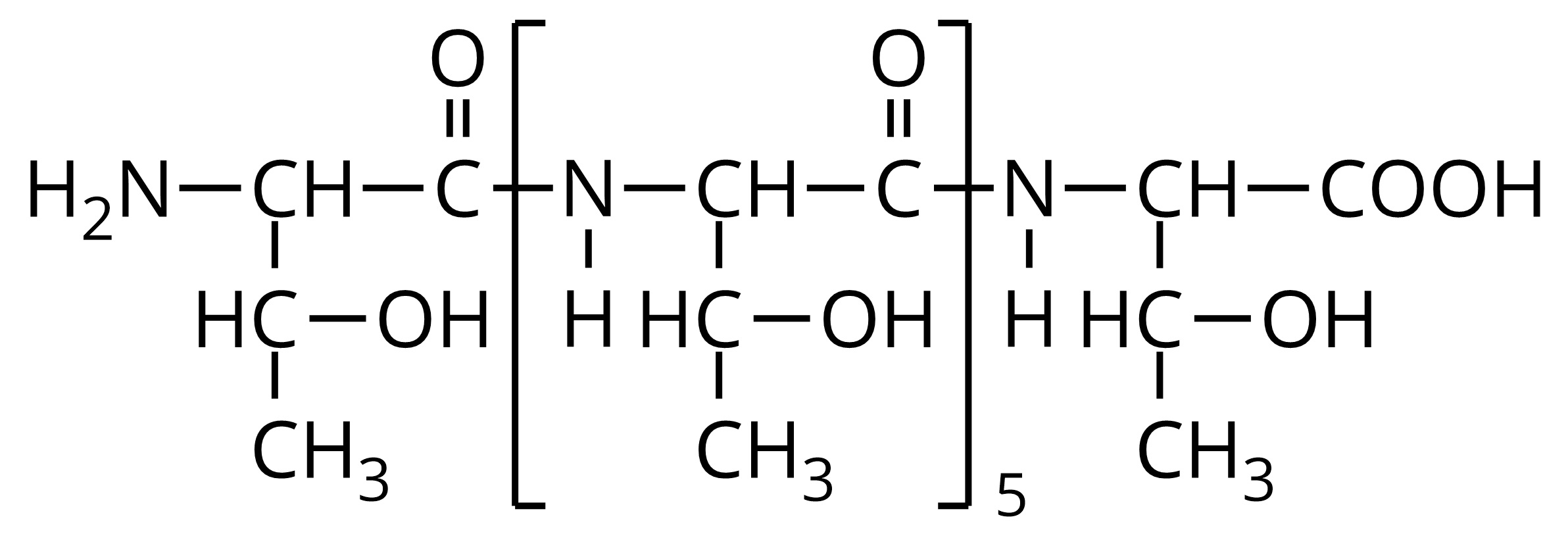
Na podstawie poniższego wzoru tripeptydu, wybierz odpowiednią sekwencję aminokwasów, wyrażoną w odpowiedniej kolejności za pomocą trzyliterowych skrótów nazw aminokwasów.
- Tyr-Ala-His
- His-Tyr-Ala
- Ala-His-Tyr
- His-Ala-Tyr

Na podstawie wzoru tripepytydu utworzonego z waliny, alaniny i seryny o sekwencji Val-Ala-Ser, wskaż liczbę izomerycznych łańcuchowych tripeptydów, utworzonych z reszt tych trzech aminokwasów.
- 4
- 6
- 8
- 9
Proces biosyntezy białek na matrycy mRNA w organizmach żywych to:
- kondensacja.
- elongacja.
- inicjacja.
- translacja.
Polipeptydy to cząsteczki zawierające:
- od dwóch do czerech reszt aminokwasowych.
- do 10 reszt aminokwasowych.
- do 100 reszt aminokwasowych.
- powyżej 100 reszt aminokwasowych.
Do badanej próbki, która zawierała aminokwasy o sekwencji Phe-Leu-Tyr-Ala-Val, dodano jedną kroplę kwasu azotowego(V) i zaobserwowano żółte zabarwienie, co świadczyło o:
- występowaniu więcej niż dwóch wiązaniach peptydowych.
- powstawaniu ninhydryny i wydzielaniu amoniaku.
- występowaniu wiązań disulfidowych.
- występowaniu aminokwasów aromatycznych.
W czasie hydrolizy łańcucha polipeptydowego, prowadzącej do powstania aminokwasów, następuje zniszczenie:
- struktury pierwszorzędowej tego polipeptydu.
- struktury drugorzędowej tego polipeptydu.
- struktury trzeciorzędowej tego polipeptydu.
- wszystkich wyżej wymienionych struktur tego polipeptydu.
Do badanej próbki polipeptydu dodano świeżo strąconego wodorotlenku miedzi(II) i zaobserwowano fioletowe zabarwienie. W badanym doświadczeniu przeprowadzono próbę:
- biuretową.
- ksantoproteinową.
- Trommera.
- Tollensa.
Test Kaisera jest testem stosowanym m.in. w syntezie peptydów w fazie stałej (SPPS). Test ten składa się z trzech roztworów odczynników:
- cyjanku potasu w wodnym roztworze pirydyny, kwasu azotowego(V), fenolu w n-butanolu lub etanolu.
- cyjanku potasu w wodnym roztworze pirydyny, ninhydryny w n-butanolu lub etanolu, fenolu w n-butanolu lub etanolu.
- cyjanku potasu w wodnym roztworze pirydyny, ninhydryny w n-butanolu lub etanolu, kwasu azotowego(V).
- wodorotlenku miedzi(II), ninhydryny w n-butanolu lub etanolu, fenolu w n-butanolu lub etanolu.
Produktem ubocznym w reakcji kondensacji aminokwasów jest:
- amoniak.
- tlenek węgla(IV).
- woda.
- amina.
Za pomocą trzyliterowych symboli aminokwasów przedstawiono wzór pewnego pentapeptydu: Pro-Phe-Ser-Tyr-Leu. Z prawej strony umieszcza się skrót aminokwasu, którego reszta zawiera wolną grupę karboksylową. Wolna grupa aminowa, która znajduje się w cząsteczce pentapeptydu i nie wzięła udziału w tworzeniu wiązań peptydowych w tym związku, pochodzi od cząsteczki:
- proliny.
- fenyloalaniny.
- seryny.
- tyrozyny.
Planarność to cecha wiązania peptydowego. Polega ona na tym, że:
- grupa karbonylowa i atom azotu leżą w jednej płaszczyźnie.
- grupa karbonylowa i atom wodoru leżą w jednej płaszczyźnie.
- atom azotu i atom wodoru leżą w jednej płaszczyźnie.
- wszystkie atomy, które wchodzą w skład ugrupowania peptydowego (grupa karbonylowa, atom azotu i atom wodoru), leżą w jednej płaszczyźnie.
Indeks dolny Autor: Krzysztof Błaszczak Indeks dolny koniecAutor: Krzysztof Błaszczak
Wzór półstrukturalny | Nazwa zwyczajowa | Trzyliterowy kod |
|---|---|---|
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą metylenową. Ta po lewej stronie łączy się z grupą aminową pierwszorzędową.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | glicyna | Gly |
Na ilustracji jest wzór półstrukturalny: od prawej strony - grupa COOH łączy się z grupą CH. Ta w dół łączy się z grupą metylową, a po lewej stronie z grupą aminową pierwszorzędową.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | alanina | Ala |
Na ilustracji jest wzór półstrukturalny: od prawej strony - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół łączy się z grupą CH. Grupa CH łączy się na dole z dwiema grupami metylowymi.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | walina | Val |
Na ilustracji jest wzór półstrukturalny: od prawej strony - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół łączy się z grupą metylenową. Grupa metylenowa łączy się na dole z sześcioczłonowym pierścieniem z trzema wiązaniami podwójnymi. 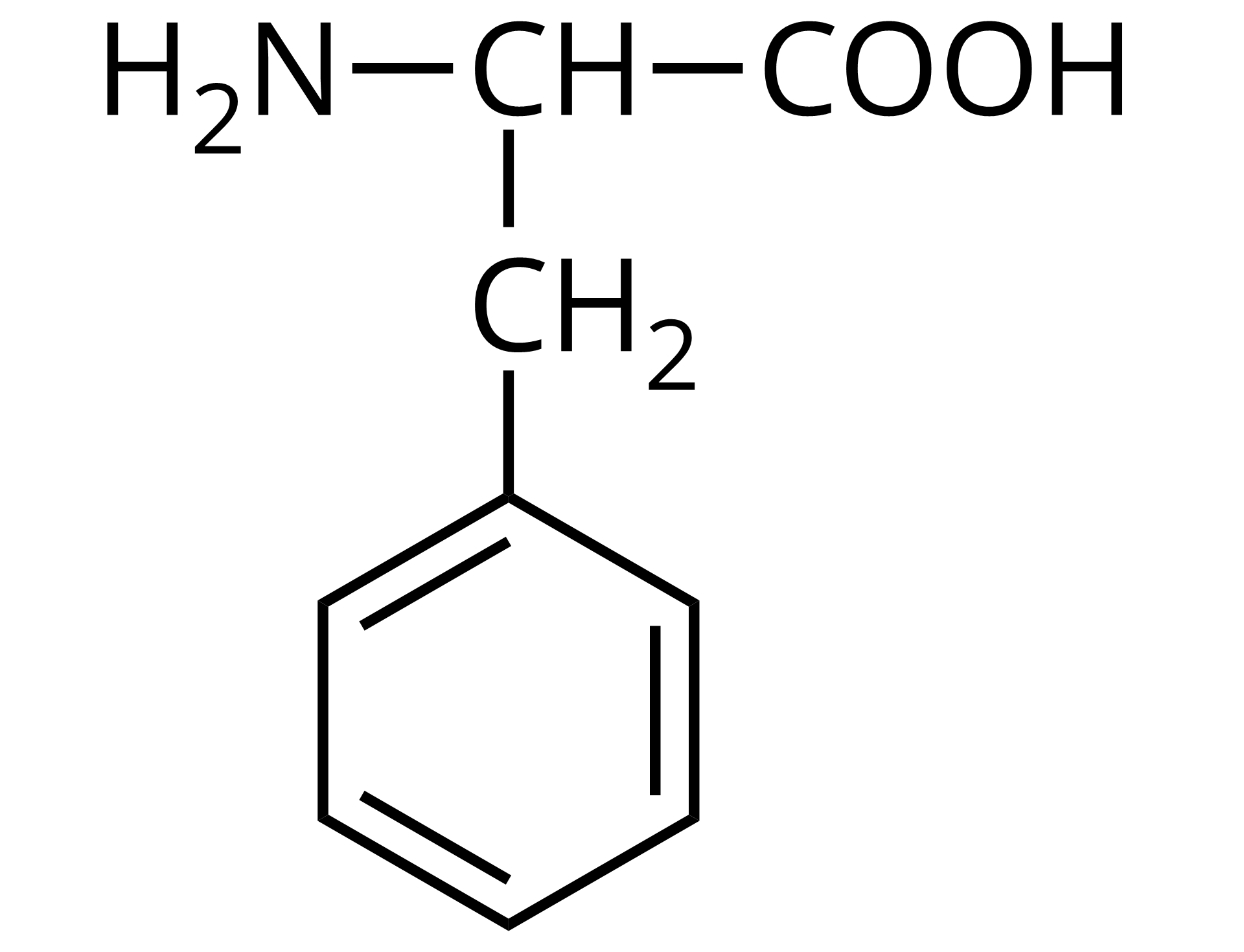 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | fenyloalanina | Phe |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół łączy się z grupą metylenową. Grupa metylenowa łączy się na dole z SH.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | cysteina | Cys |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół łączy się z grupą metylenową. Grupa metylenowa łączy się na dole z kolejną grupą metylenową połączoną w dół z grupą COOH.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kwas glutaminowy | Glu |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół łączy się kolejno z szeregiem czterech grup metylenowych. Ostatnia z nich na dole łączy się z grupą aminową.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | lizyna | Lys |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą metylenową połączoną na dole z grupą COOH.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kwas asparaginowy | Asp |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą metylenową połączoną na dole z pięcioczłonowym pierścieniem z dwoma wiązaniami podwójnymi. W pierścieniu jest między innymi atom azotu oraz grupa NH.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | histydyna | His |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą CH połączoną po prawej stronie z grupą metylową, a na dole z grupą metylenową. Grupa metylenowa łączy się w dół z grupą metylową.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | izoleucyna | Ile |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą metylenową. Grupa metylenowa łączy się na dole z grupą CH połączoną po lewej i prawej stronie z grupą metylową. 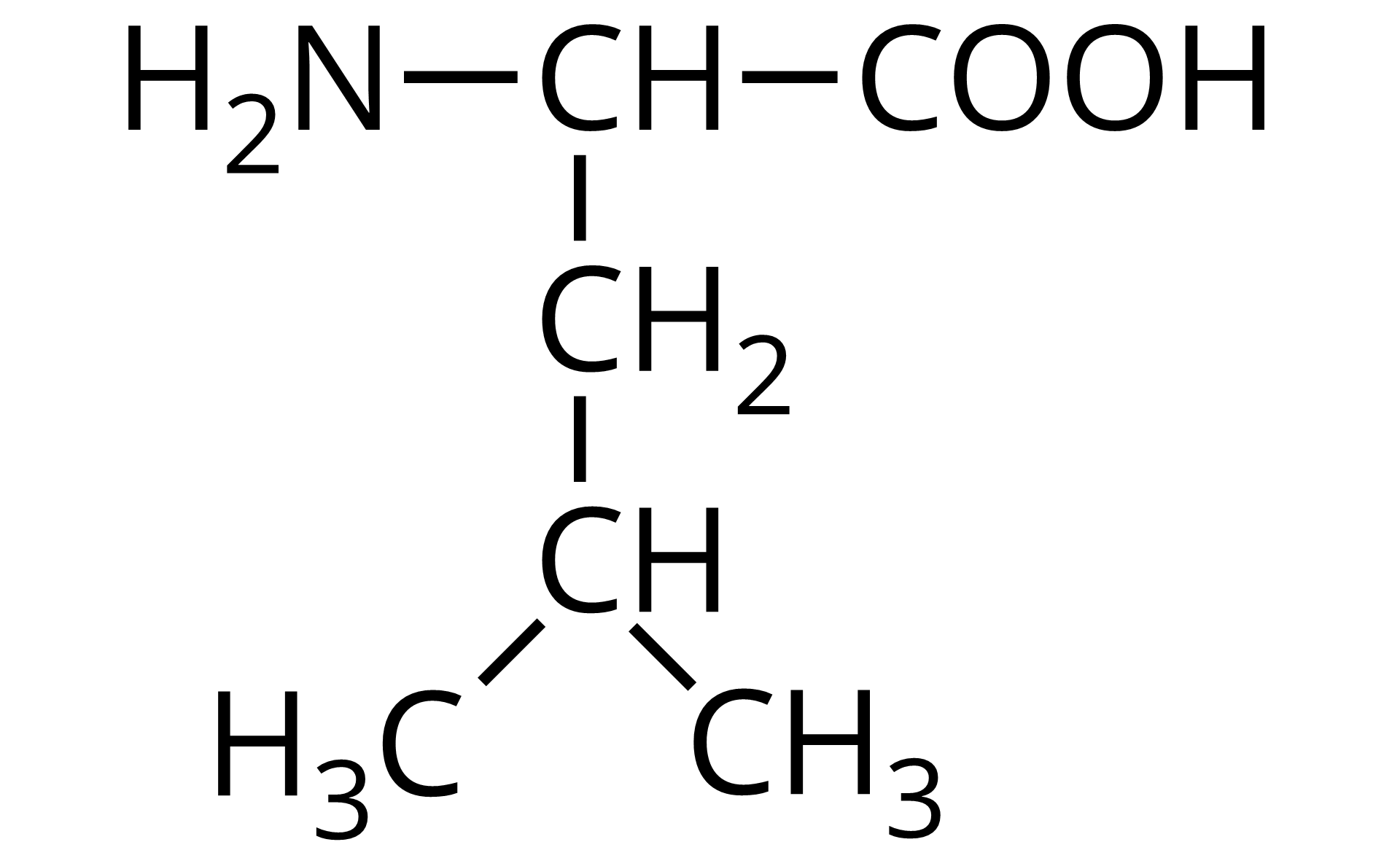 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | leucyna | Leu |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą metylenową. Grupa metylenowa łączy się na dole z grupą metylenową połączoną po prawej stronie z atomem siarki, który łączy się z grupą metylową. 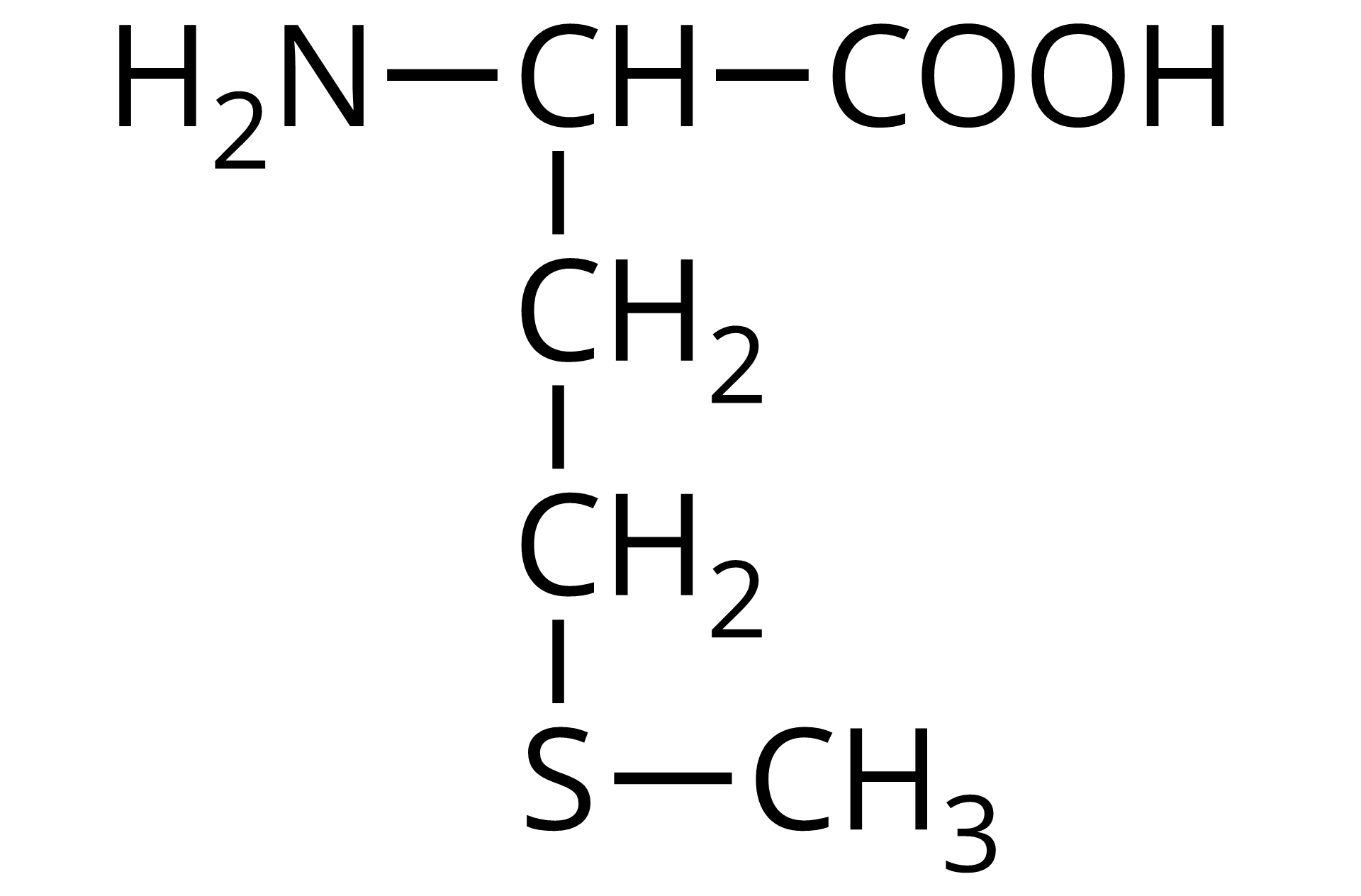 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | metionina | Met |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą metylenową. Grupa metylenowa łączy się na dole z atomem węgla. Atom węgla po lewej stronie łączy się z grupą aminową pierwszorzędową, a po prawej wiązaniem podwójnym z atomem tlenu. 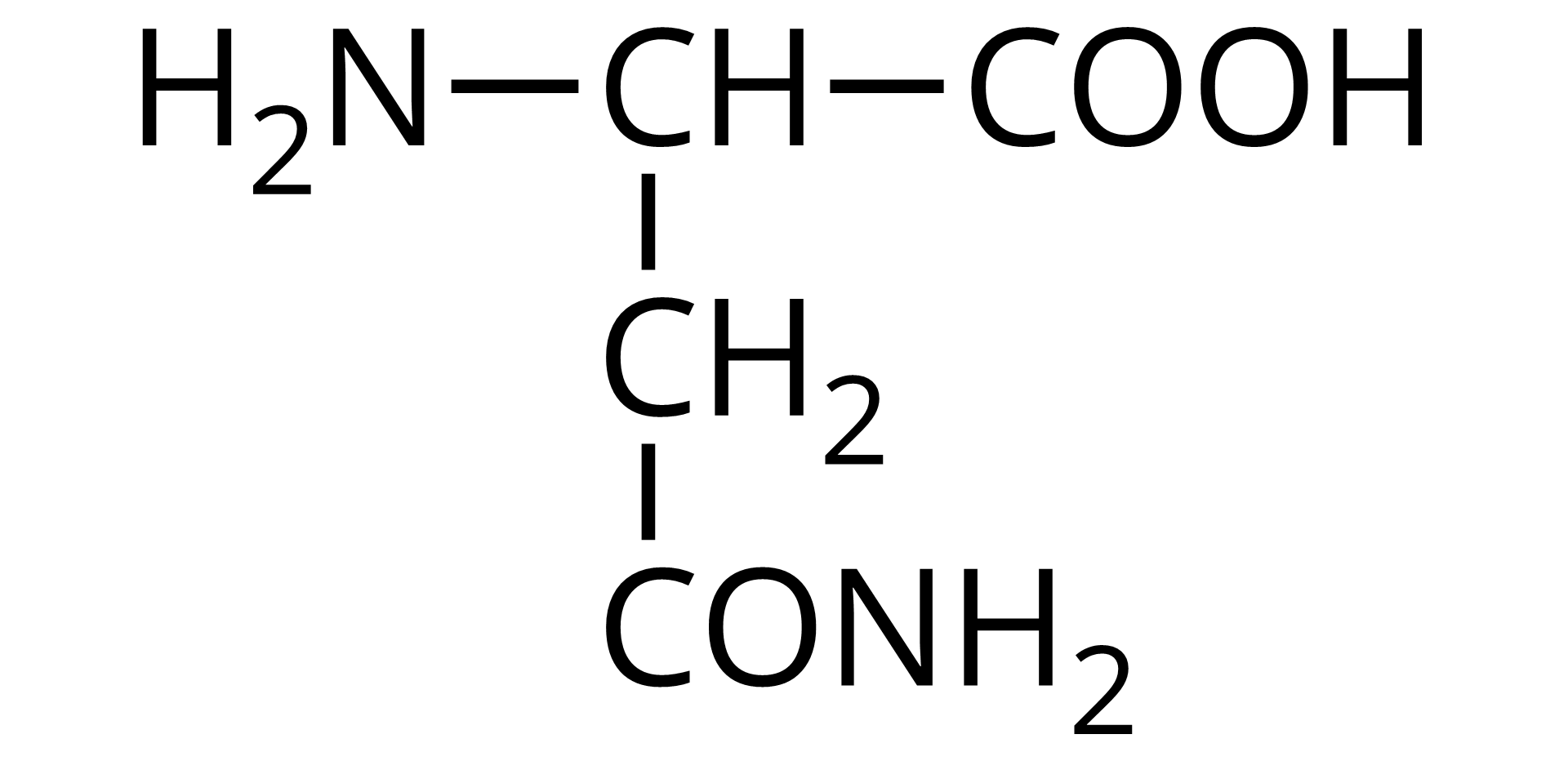 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | asparagina | Asn |
Na ilustracji jest wzór półstrukturalny: to pięcioczłonowy pierścień. U góry po prawej stronie łączy się z COOH. Pierścień zawiera w swojej budowie grupę NH.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | prolina | Pro |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą metylenową. Grupa metylenowa łączy się na dole z kolejną grupą metylenową. Ta łączy się z atomem węgla. Atom węgla łączy się po lewej stronie z grupą aminową pierwszorzędową, a po prawej wiązaniem podwójnym z atomem tlenu. 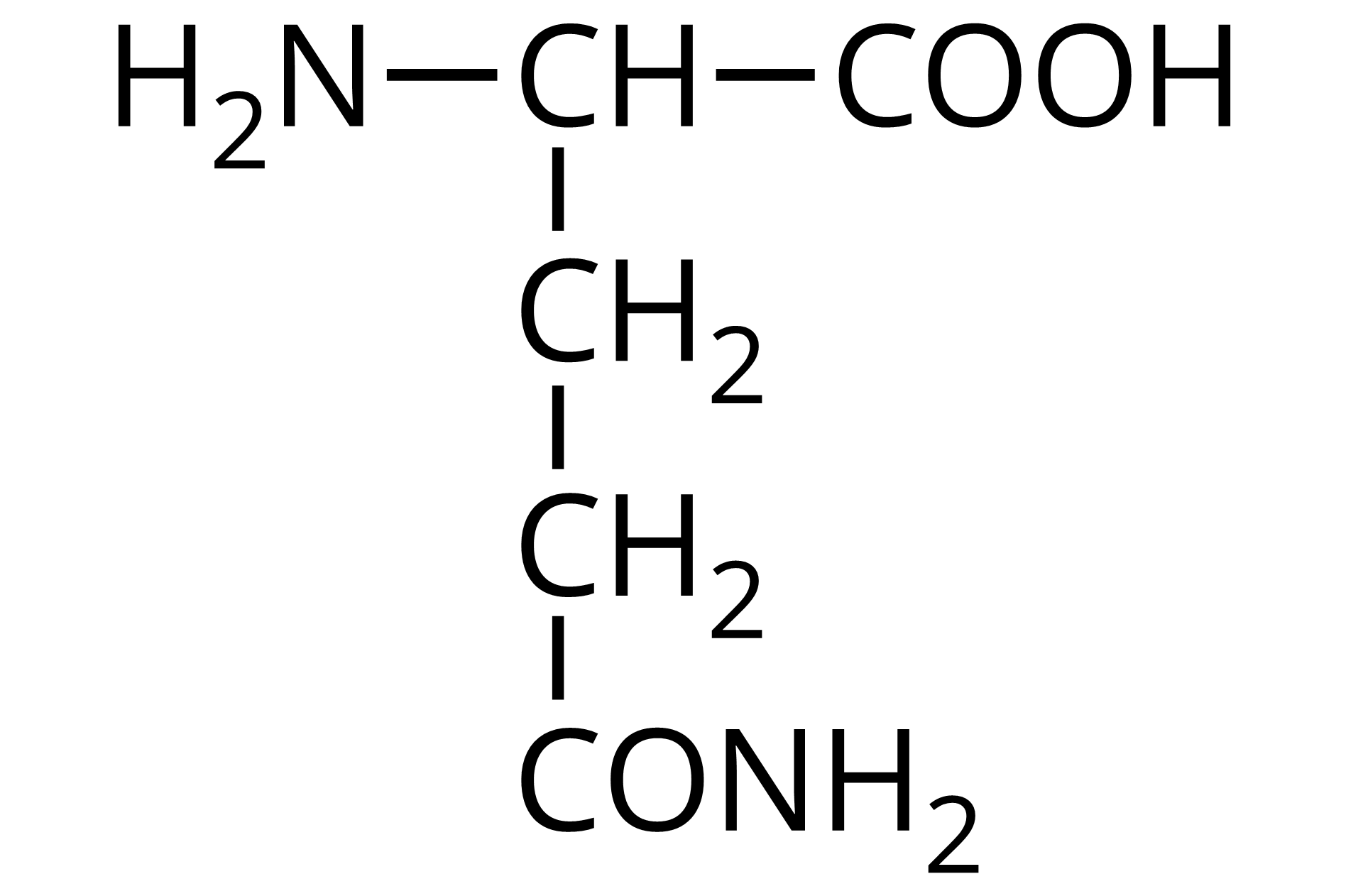 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | glutamina | Gln |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą metylenową. Grupa metylenowa łączy się na dole z kolejną grupą metylenową. Ta łączy się z następną grupą metylenową. Grupa metylenowa w prawo łączy się z NH, które z kolei łączy się z atomem węgla. Atom węgla łączy się u góry wiązaniem podwójnym z NH, a po prawej stronie z grupą aminową pierwszorzędową. 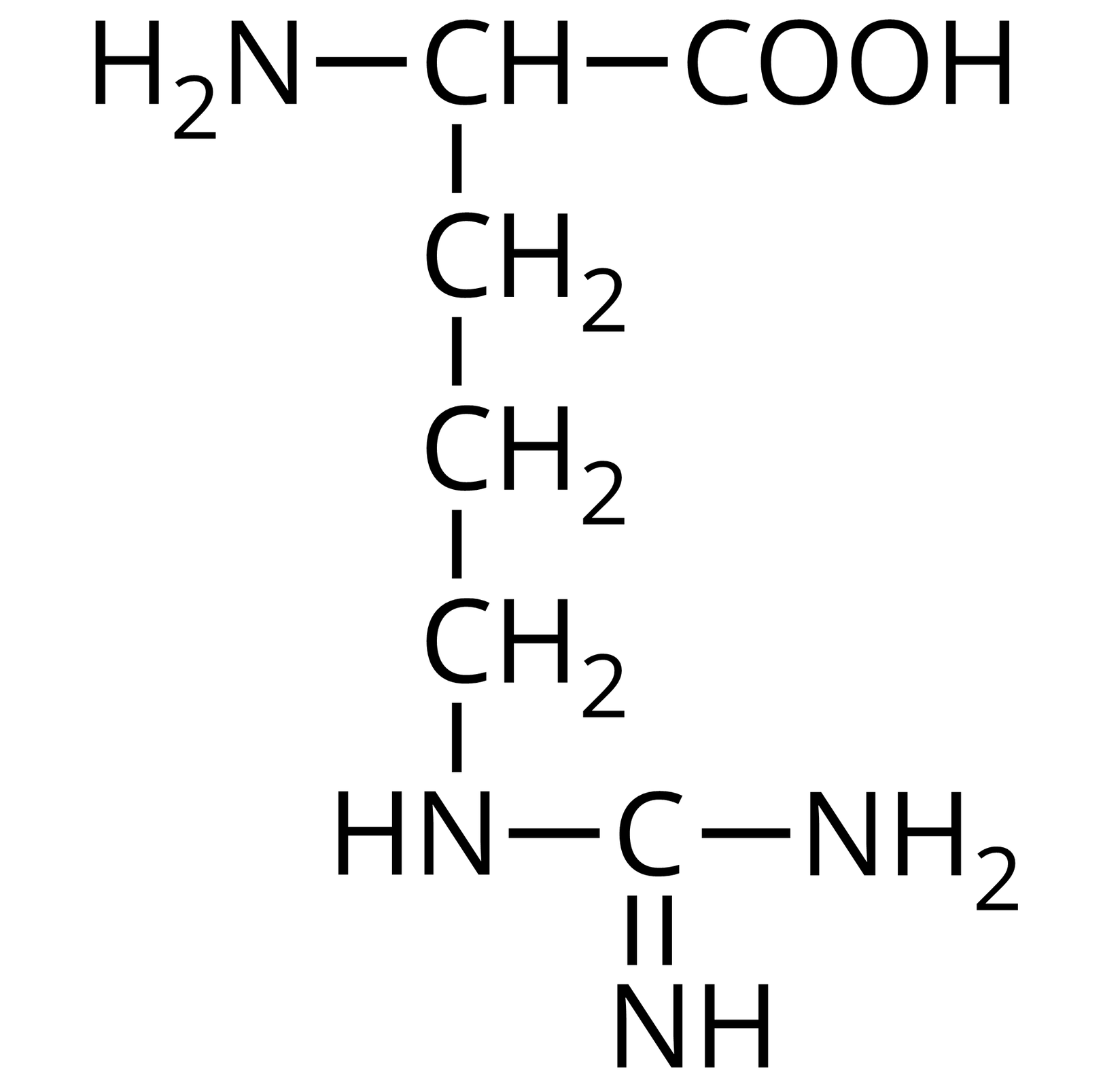 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | arginina | Arg |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą metylenową. Grupa metylenowa łączy się po prawej stronie z grupą OH.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | seryna | Ser |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą CH. Grupa CH łączy się po prawej stronie z grupą OH, a w dół z grupą metylową. 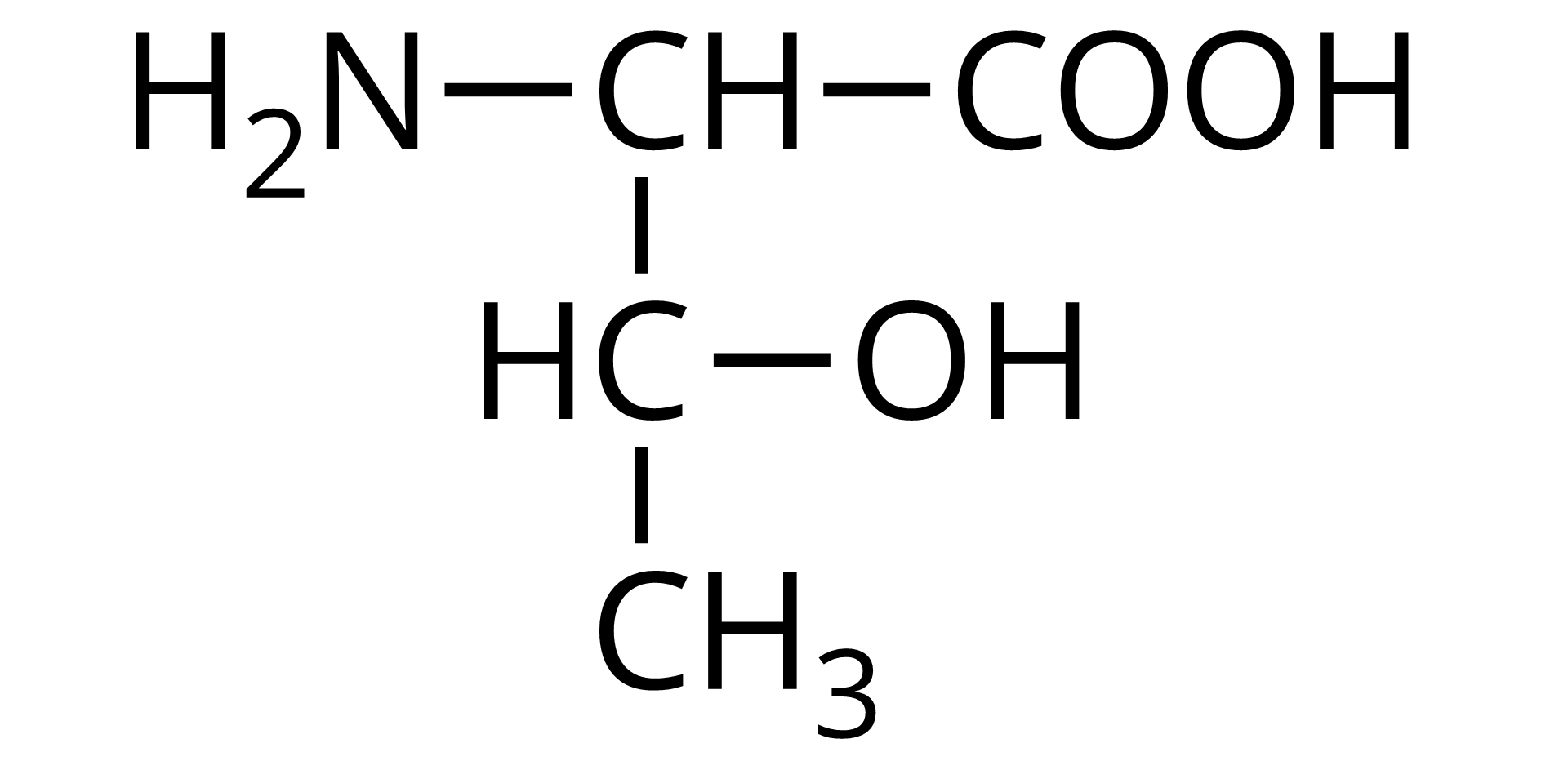 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | treonina | Thr |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą metylenową. Grupa metylenowa łączy się po prawej stronie z pięcioczłonowym pierścieniem z jednym wiązaniem podwójnym, pierścień zawiera grupę NH. Pierścień ten przylega po prawej stronie do sześcioczłonowego pierścienia z trzema wiązaniami podwójnymi. 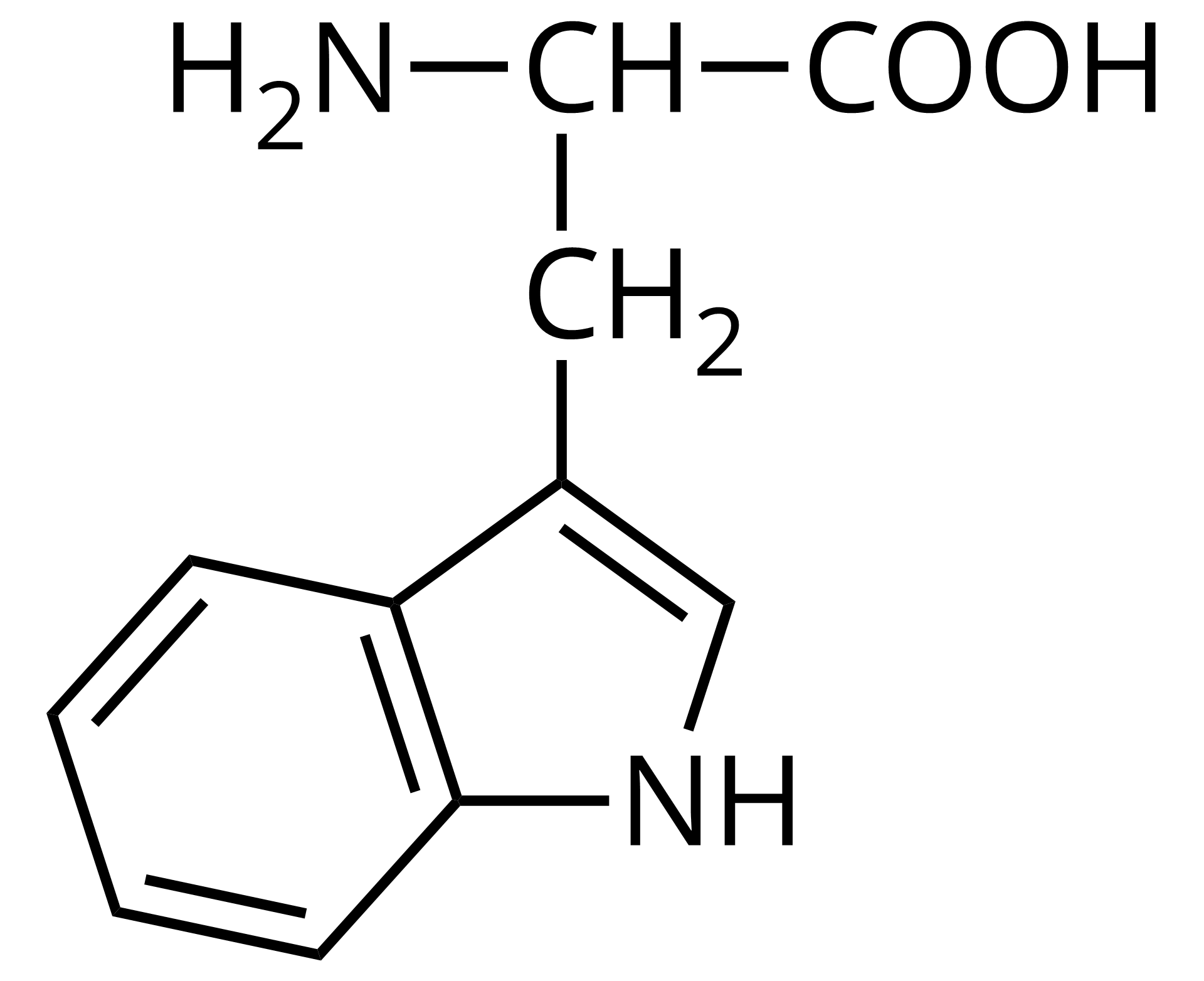 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | tryptofan | Trp |
Na ilustracji jest wzór półstrukturalny: od prawej strony do lewej - grupa COOH łączy się z grupą CH. Ta w lewo łączy się z grupą aminową pierwszorzędową, a w dół z grupą metylenową. Grupa metylenowa łączy się po prawej stronie z sześcioczłonowym pierścieniem z trzema wiązaniami podwójnymi. Pierścień łączy się po prawej stronie z grupą OH.  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | tyrozyna | Tyr |
Produkujemy polipeptydy
Produkujemy polipeptydy
Wiązanie peptydowe to:
- CONH
- COOH
- COO
- COH
Proces biosyntezy białek na matrycy mRNA w organizmach żywych to:
- kondensacja.
- elongacja.
- inicjacja.
- translacja.
Polipeptydy to cząsteczki zawierające:
- od dwóch do czerech reszt aminokwasowych.
- do 10 reszt aminokwasowych.
- do 100 reszt aminokwasowych.
- powyżej 100 reszt aminokwasowych.
Do badanej próbki, która zawierała aminokwasy o sekwencji Phe-Leu-Tyr-Ala-Val, dodano jedną kroplę kwasu azotowego(V) i zaobserwowano żółte zabarwienie, co świadczyło o:
- występowaniu więcej niż dwóch wiązaniach peptydowych.
- powstawaniu ninhydryny i wydzielaniu amoniaku.
- występowaniu wiązań disulfidowych.
- występowaniu aminokwasów aromatycznych.
W czasie hydrolizy łańcucha polipeptydowego, prowadzącej do powstania aminokwasów, następuje zniszczenie:
- struktury pierwszorzędowej tego polipeptydu.
- struktury drugorzędowej tego polipeptydu.
- struktury trzeciorzędowej tego polipeptydu.
- wszystkich wyżej wymienionych struktur tego polipeptydu.
Do badanej próbki polipeptydu dodano świeżo strąconego wodorotlenku miedzi(II) i zaobserwowano fioletowe zabarwienie. W badanym doświadczeniu przeprowadzono próbę:
- biuretową.
- ksantoproteinową.
- Trommera.
- Tollensa.
Test Kaisera jest testem stosowanym m.in. w syntezie peptydów w fazie stałej (SPPS). Test ten składa się z trzech roztworów odczynników:
- cyjanku potasu w wodnym roztworze pirydyny, kwasu azotowego(V), fenolu w n-butanolu lub etanolu.
- cyjanku potasu w wodnym roztworze pirydyny, ninhydryny w n-butanolu lub etanolu, fenolu w n-butanolu lub etanolu.
- cyjanku potasu w wodnym roztworze pirydyny, ninhydryny w n-butanolu lub etanolu, kwasu azotowego(V).
- wodorotlenku miedzi(II), ninhydryny w n-butanolu lub etanolu, fenolu w n-butanolu lub etanolu.
Produktem ubocznym w reakcji kondensacji aminokwasów jest:
- amoniak.
- tlenek węgla(IV).
- woda.
- amina.
Za pomocą trzyliterowych symboli aminokwasów przedstawiono wzór pewnego pentapeptydu: Pro-Phe-Ser-Tyr-Leu. Z prawej strony umieszcza się skrót aminokwasu, którego reszta zawiera wolną grupę karboksylową. Wolna grupa aminowa, która znajduje się w cząsteczce pentapeptydu i nie wzięła udziału w tworzeniu wiązań peptydowych w tym związku, pochodzi od cząsteczki:
- proliny.
- fenyloalaniny.
- seryny.
- tyrozyny.
Planarność to cecha wiązania peptydowego. Polega ona na tym, że:
- grupa karbonylowa i atom azotu leżą w jednej płaszczyźnie.
- grupa karbonylowa i atom wodoru leżą w jednej płaszczyźnie.
- atom azotu i atom wodoru leżą w jednej płaszczyźnie.
- wszystkie atomy, które wchodzą w skład ugrupowania peptydowego (grupa karbonylowa, atom azotu i atom wodoru), leżą w jednej płaszczyźnie.
Zapisz równanie reakcji kondensacji, prowadzące do powstania dipeptydu Phe‑Thr.
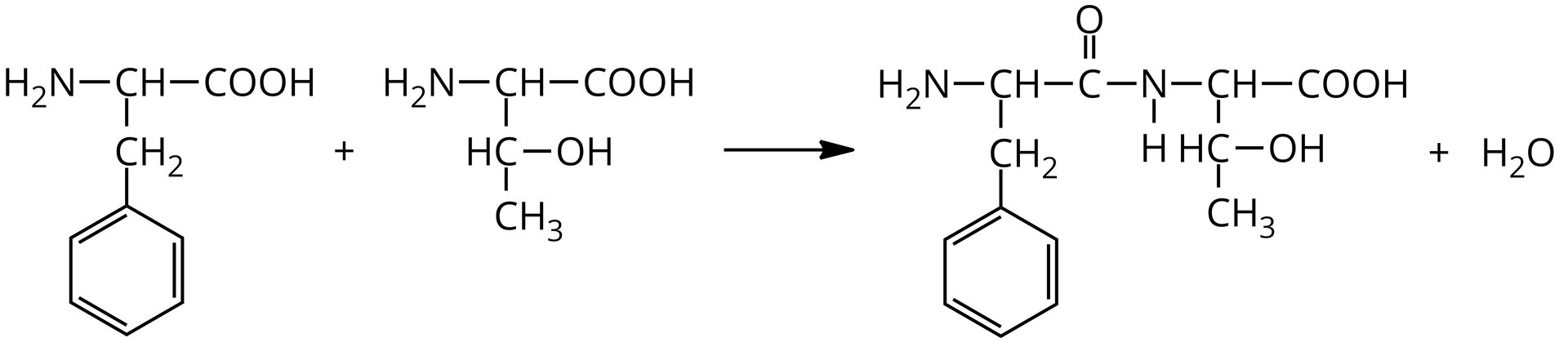
Opisz równanie reakcji kondensacji glicyny i podaj nazwę produktu.
glicyloglicyna