Przeczytaj
Klasyfikacja peptydów
Najczęściej podziału peptydów dokonuje się ze względu na liczbę budujących je aminokwasówaminokwasów. Cząsteczki peptydów, które są zbudowane z dwóch aminokwasów, nazywamy dipeptydami, a z trzech — tripeptydami itd.
Peptydy, o cząsteczkach zawierających mniej niż reszt aminokwasowych, są określane jako oligopeptydy, a zawierające do ok. reszt — jako polipeptydy. Związki, których cząsteczki są zbudowane z ponad reszt, są określane jako białkabiałka.
Najczęściej występujące peptydy to heteropeptydy. Są zbudowane z reszt różnych aminokwasów. Peptydy, które zawierają ciąg tych samych reszt aminokwasowych, nazywamy homopeptydami.
Innego podziału dokonuje się ze względu na kształt cząsteczki (peptydy liniowe oraz cykliczne).
Synteza polipeptydów
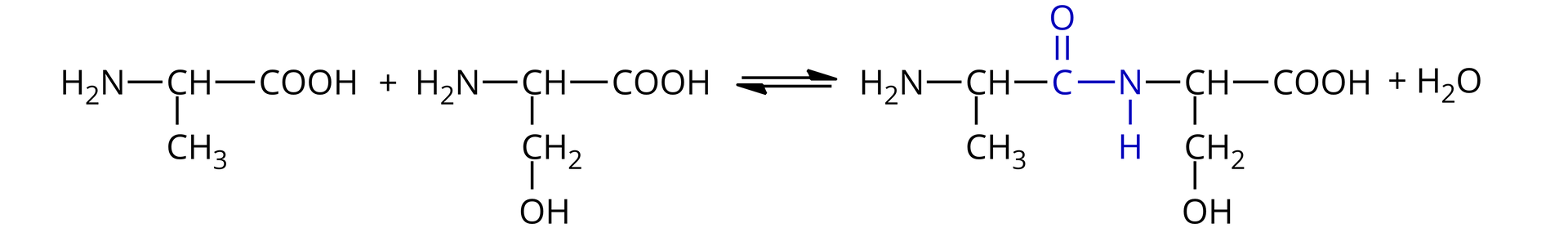
Peptydy powstają w wyniku reakcji kondensacji, podczas której między grupą karboksylową () i grupą aminową () tworzy się wiązanie peptydowe. Produktem ubocznym tej reakcji jest cząsteczka wody. Ogólny schemat reakcji kondensacji przedstawiono poniżej.

Przykład kondensacji aminokwasów do dipeptydu:
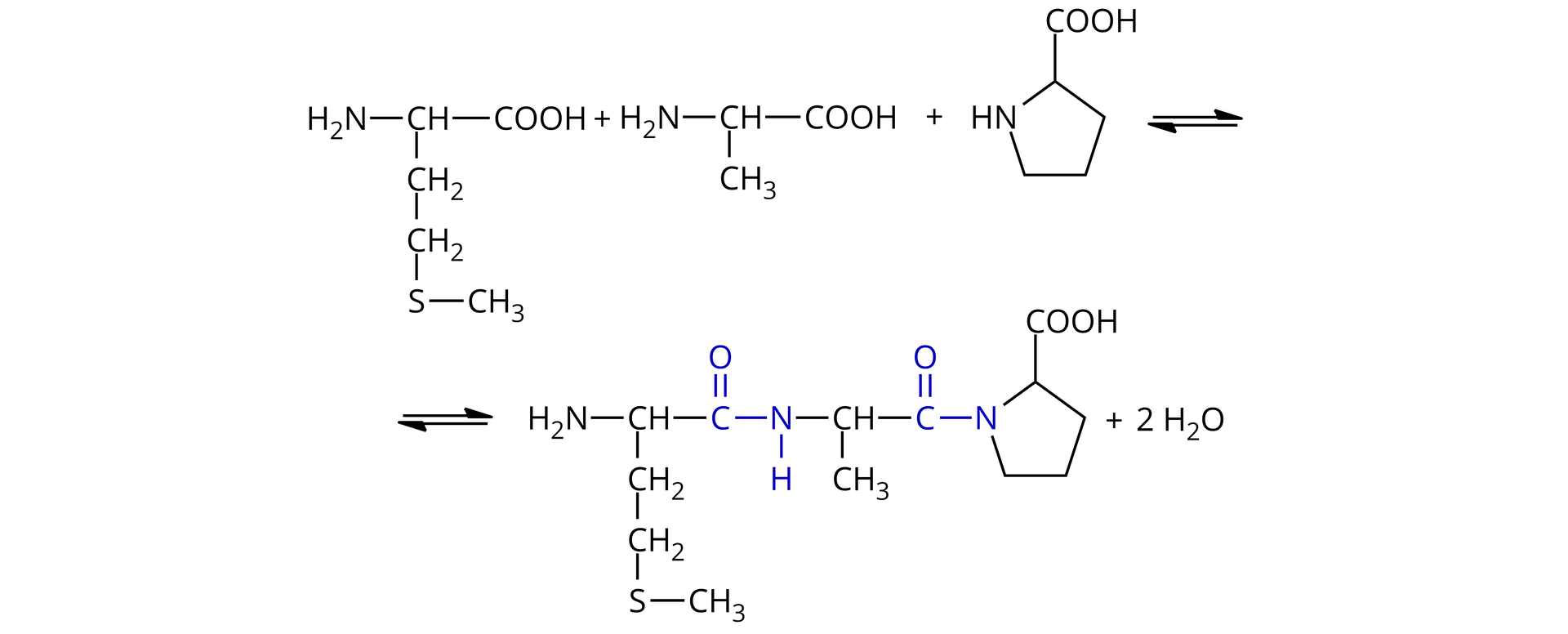
Przykład kondensacji aminokwasów do tripeptydu:
Pierwsza synteza peptydu
Glicyloglicyna jest dipeptydem, zbudowanym z reszt aminokwasowych dwóch glicyn. To najprostszy peptyd.
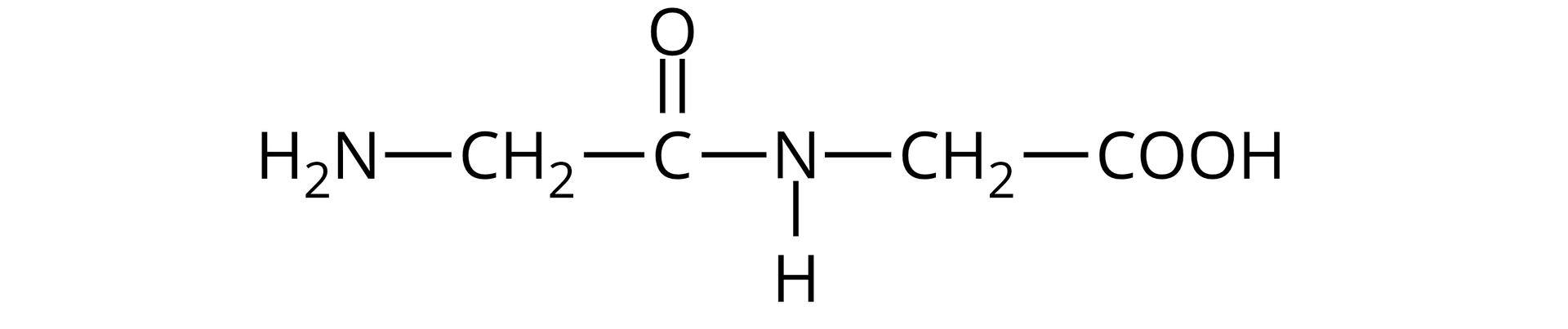
Po raz pierwszy został zsyntezowany przez Emila Fischera i Ernesta Forneau w roku badacze otrzymali ów peptyd, gotując ,-diketopiperynazę (bezwodnik glicyny) z kwasem solnym.
Jak organizmy produkują peptydy?
Biosynteza białek to ogół procesów enzymatycznych, które zachodzą w żywych organizmach, co prowadzi do łączenia się aminokwasów w łańcuchy polipeptydowe o specyficznej sekwencji aminokwasów. Procesy te są uwarunkowane genetycznie. Za syntezę polipeptydów odpowiada proces translacji. Jest to drugi etap biosyntezy białek, podczas którego na podstawie informacji zapisanej w nici mRNA, syntezowany jest polipeptyd. Proces ten jest katalizowany przez rybosom obejmujący podjednostkami przesuwającą się nić mRNA.
W laboratoriach synteza peptydów opiera się głównie na syntezie na nośniku stałym. Ma ona charakter wieloetapowy, przez co wymagana jest konieczność kontrolowania poszczególnych procesów.
Nośnikiem w tej metodzie mogą być żywice, do których przyłączone zostały grupy aminowe (). Następnie do naczynia wprowadza się odpowiedni rozpuszczalnik, aminokwasy z zablokowaną grupą aminową oraz zablokowanymi grupami bocznymi. Najczęściej jako grupy chroniące (blokujące) N-koniec stosuje się Boc (tert-butoksykarbonyl) oraz Fmoc (-fluorenylometoksykarbonyl).
Potem wymywa się aminokwasy, które nie uległy przyłączeniu. Aby sprawdzić, czy zaszła reakcja między wolną (reaktywną) grupą aminową a C‑końcem wprowadzonego aminokwasu, należy wykonać test Kaisera. Kolejnym krokiem jest dodanie nowego rozpuszczalnika i usunięcie grupy blokującej N-koniec. Etapy te powtarza się aż do uzyskania oczekiwanej długości peptydu.
Powyższy sposób został zaproponowana w roku przez R.B. Merrifield’a, późniejszego laureata Nagrody Nobla.
Słownik
związki wielkocząsteczkowe zbudowane z reszt aminokwasowych (aminokwasy), połączonych wiązaniem peptydowym; występują we wszystkich żywych organizmach
związki organiczne powszechnie występujące w organizmach żywych, które zawierają w cząsteczce co najmniej jedną grupę karboksylową () i co najmniej jedną grupę aminową (); występują powszechnie w organizmach zwierzęcych, w roślinach i drobnoustrojach
Bibliografia
Berg J. M., Stryer L., Tymoczko J. L., Gatto G. J., Biochemia, Warszawa 2018.