Grafika interaktywna
Czy zastanawiasz się czasami, jak kiedyś artyści pozyskiwali kolory do malowania swoich dzieł? Jakie reakcje były stosowane do otrzymania niektórych farb/związków chemicznych użytych przez artystę? Jakie metale wchodziły w skład tych związków chemicznych? Z pewnością znasz obraz Vincenta van Gogha „Widok na Arles z irysami na pierwszym planie”. Przeanalizuj poniższą grafikę interaktywną na temat substancji nierozpuszczalnych użytych przez artystę do wytworzenia farb o różnych kolorach, które otrzymał poprzez utworzenie mieszaniny pigmentu w odpowiednim medium (wodzie, oleju), zależnym od typu farby. Zwróć szczególną uwagę na nazwy oraz wzory sumaryczne związków chemicznych. Po przeanalizowaniu grafiki, rozwiąż ćwiczenia sprawdzające.
Także i jego stosuje się już od starożytności, a więc nie datuje dzieł sztuki. Największą popularnością cieszył się w średniowiecznym malarstwie książkowym, tablicowym i ściennym. Z czasem minia zaczęła być stopniowo wypierana z użycia ze względu na toksyczne właściwości. Nazwa pigmentu pochodzi od nazwy rzeki Miño płynącej poprzez półwysep Iberyjski, gdzie tlenek ten został po raz pierwszy wydobyty. Można go otrzymać poprzez termiczny rozkład bieli ołowiowej , gdzie pośrednim produktem przemiany jest masykot – tlenek ołowiu(II), o barwie żółtej. Minia zastosowana w dziełach sztuki jest nietrwała i pod wpływem działania światła/wilgoci ciemnieje. Ciekawostką jest fakt, że wielkim fanem tego pigmentu był Vincent Van Gogh. Minia bywała też stosowana jak czynnik zabezpieczający – np. ołtarz Wita Stwosza w Bazylice Mariackiej w Krakowie został od tyłu pokryty warstwą minii. Ilustracja przedstawia usypaną z pomarańczowo-czerwonego proszku górkę, na białym tle. 6. Eozyna To czerwony barwnik organiczny, o podanym poniżej wzorze chemicznym: Wzór przedstawia układ trzech pierścieni aromatycznych w dolnym narożu środkowego znajduje się tlen a w górnym wiązanie z kolejnym pierścieniem aromatycznym z grupą , dwa pozostałe pierścienie są u dołu wiązane z bromem obok z tlenem (pierścień po prawej wiązaniem podwójnym, pierścień po lewej wiązaniem pojedynczym a tlen ma ładunek ujemny), obok kolejne wiązania z bromem. 7. Koszenila Kwas karminowy (koszenila, karmina) to ciemnoczerwony barwnik organiczny o podanym poniżej wzorze chemicznym: Układ 4 pierścieni, (od lewej) pierścień cykloheksanu i trzy połączone benzeny. Pierwszy cykloheksen to cukier z tlenem w strukturze zamiast jednego węgla, od niego odchodzą grupy hydroksylowe i , ten pierścień jest połączony wiązaniem pojedynczym z benzenem, w pierścieniu aromatycznym grupy -OH są rozlokowane tak, że jedna jest po prawej stronie od wiązania z cukrem, a po lewej dwie w kolejnych pozycjach. Następny benzen jest połączony wiązaniem podwójnym z dwoma tlenami u góry i dołu struktury, kolejny benzen u dołu ma wiązanie z grupą metylową, obok grupę karboksylową i w kolejnej pozycji grupę -OH. Występuje naturalnie u owadów (np. czerwców polskich). Z 1 kg suszonych owadów koszenilowych uzyskuje się ok. 50 g karminu. 8. Viridian Viridian to niebiesko-zielony pigment, uwodniony tlenek chromu(III). Jest bardziej zielony niż niebieski. Ilustracja przedstawia broń leżącą na szarej powierzchni z widocznym włączonym zielonym laserem do namierzania. Tlenek chromu(III) można otrzymać w reakcji uwodnionego siarczanu(VI) chromu(III) z wodnym roztworem amoniaku 9. Błękit pruski. Charakteryzuje się formułą: , jest to niebieski pigment, otrzymywany sztucznie, a po raz pierwszy przez alchemika i farbiarza Deisbacha w 1704 r. w Berlinie. Jako datę początku jego stosowania przez artystów uznaje się rok 1724. Błękit pruski jest średnio odporny na działania światła i ma niezbyt dobre właściwości kryjące, chociaż odznacza się dużą intensywnością barwienia. Przykład dzieła, w którym można zobaczyć ów pigment to María de los Dolores Collado y Echagüe, duquesa de Bailén Vincenta Palmaroliego. Na ilustracji widnieje szkiełko zegarkowe z nasypanym intensywnie niebieskim proszkiem, na białym tle. Może być otrzymany w reakcji soli żelaza(III) z heksacyjanożelazianem(II) potasu: 10. Ultramaryna. To pigment naturalny, otrzymywany z minerału lapis lazuli. Jest to złożony związek glinokrzemianu sodowego i siarkowego o zmiennym składzie. Przybliżony wzór można zapisać w formie: . Najstarsze doniesienia o stosowaniu ultramaryny jako pigmentu wiążą się z malarstwem ściennym. Birsztein zidentyfikował ją w malowidłach ściennych w Kara-Tape, datowanych na II-IV w. n.e. Również pojedyncze ziarna ultramaryny wykryto w malowidłach egipskich na płótnie datowanych na IV w. n.e. Ultramaryna naturalna była pigmentem bardzo drogim, którego wartość zbliżona była do wartości złota. Z tego powodu bardzo intensywnie poszukiwano metody jej syntetycznego otrzymywania na przełomie XVIII i XIX w. Poszukiwania te wspierały nawet różne instytucje, które gwarantowały nagrody finansowe dla odkrywców metody syntezy tego pigmentu. Przełom nastąpił około 1830 r., kiedy metody produkcji przedstawili niezależnie od siebie: Jean Baptiste Guimet oraz Christian Gottlob Gmelin. Od tego czasu ultramaryna syntetyczna praktycznie wyparła tę naturalną z użycia. Pigment ten posiada jasnobłękitne kryształy, ale – oprócz ziaren tego koloru – w ultramarynie naturalnego pochodzenia występują zazwyczaj również ziarna kalcytu oraz pirytu. Ilustracja przedstawia usypany w górkę intensywnie niebieski proszek na białym tle. Ultramaryna jest otrzymywana w kilku etapach. Surowce używane do jej produkcji to: biały kaolin ; bezwodny siarczan(VI) sodu ; bezwodny węglan sodu ; sproszkowana siarka; sproszkowany węgiel drzewny lub węgiel względnie bezpopiołowy. 11. Błękit kobaltowy Jest to glinian kobaltu(II) – związek opisywany w literaturze wzorami: lub . Oficjalnie, otrzymał go po raz pierwszy Józef Leithner w Wiedniu w 1795 r. Natomiast w latach 1802-1804 chemik Louis Jacque Thenard, profesor Uniwersytetu i Politechniki Paryskiej, opracował metodę otrzymywania tego błękitu oraz zaproponował jego praktyczne zastosowanie jako właśnie pigmentu. Co ciekawe, badania prowadzone w wykopaliskach El Amarna i datowane na 1370 r. p.n.e. wskazują, że partie błękitne obiektów zawierają właśnie glinian kobaltu(II). Przykładem obrazu, w którym znajduje się ten pigment, jest dzieło Wiliama Turnera Ostatnia droga Temeraire’a. Ilustracja przedstawia usypaną z błękitno-niebieskiego proszku górkę, na szarym tle. Glinian kobaltu(II) można otrzymać w następującej reakcji: 12. Żółcienie chromianowe To pigmenty zawierające anion chromianowy(VI) .
Mogą to być: żółcień barytowa ; żółcień cynkowa ; żółcień strontowa . W języku angielskim często określane są one wspólną nazwą lemon yellow. Istnieje również tzw. żółcień chromowa, którą stanowi chromian(VI) ołowiu , często spotykany również w postaci lub . Wszystkie te pigmenty otrzymuje się najprościej poprzez strącenie osadów z użyciem chromianu(VI) lub dichromianu(VI) potasu. Pojawiły się w użyciu w XIX w. Żółcień chromową stosował wspominany tu już wielokrotnie Van Gogh. Za przykład stanowi obraz Pole pszenicy z cyprysami. Ilustracja przedstawia szalkę Petriego z nasypaną górką żółtego proszku. Chromian ołowiu(II) można otrzymać przez strącanie roztworów chromianów, za pomocą roztworów soli ołowiu:

1. Obraz van Gogh`a Van Gogh namalował Widok na Arles z irysami na pierwszym planie paletą pigmentów, składającą się z co najmniej 14 różnych barw i dwóch wypełniaczy. Używał on wielu pigmentów i barwników, jak:
Van Gogh zastosował również podczas malowania dwa różne rodzaje chromu żółtego. Co więcej, zidentyfikowano także wypełniacze, takie jak siarczan(VI) baru i węglan wapnia, które były dodane odpowiednio do szmaragdowej zieleni i żółcieni chromowych. Wszystkie te pigmenty można otrzymać w reakcjach strąceniowych.
2. Biel ołowiowa To chyba obok kredy i gipsu najpopularniejszy biały pigment. Pod względem chemicznym jest to zasadowy węglan ołowiu o wzorze . Pigment ten jest znany i wykorzystywany od starożytności, jednak bardzo rzadko w malarstwie ściennym. Przykładem zastosowania jest choćby Ostatnia Wieczerza Leonarda da Vinci, ale również dzieło Rembrandta Portret 83-letniej kobiety oraz dzieło Tycjana Nie dotykaj mnie.
Co ciekawe, w starożytności biel ołowiowa była stosowana również jako kosmetyk. 
3. Biel cynkowa Jest to tlenek cynku . Wzmiankowano ów pigment, jako możliwy do stosowania, pod koniec XVIII w. Za datę rozpoczęcia jego stosowania należy jednak uznać 1823 r., kiedy to firma Winsor i Newton wprowadziła go do sprzedaży w akwarelach. Biel cynkowa jest zatem pigmentem datującym. Jest on odporny na działanie światła, a pod wpływem siarkowodoru przekształca się w siarczek cynku, czemu nie towarzyszy zmiana barwy. Sam wraz z siarczanem(VI) baru tworzy biel litoponową.
Przykład zastosowania: Vincent Van Gogh, Pole pszenicy z cyprysami – białe chmurki zawierają właśnie biel cynkową.
Tlenek cynku można otrzymać za pomocą poniższej reakcji chemicznej:
4. Cynober Inaczej vermilion, to siarczek rtęci(II) . Jest to czerwony pigment, znany i stosowany od starożytności – wspominają o nim m.in. Teofrast, Witruwiusz, Piliniusz czy Rękopisy Tebańskie.
Przypuszczalnie już w XIV w. powszechnie otrzymywano go syntetycznie. Obecnie jest mniej popularny ze względu na swoją toksyczność. Cynober ma znaczną siłę barwienia, ale z czasem ciemnieje.
Przykładem jego zastosowania jest obraz Tycjana – Wniebowzięcie Najświętszej Marii Panny. 
Siarczek rtęci(II) można otrzymać poprzez reakcję siarkowodoru z solami rtęci(II):
5. Minia To czerwony, czasem czerwono-pomarańczowy pigment, będący pod względem chemicznym tlenkiem ołowiu(II,IV) – .
Także i jego stosuje się już od starożytności, a więc nie datuje dzieł sztuki. Największą popularnością cieszył się w średniowiecznym malarstwie książkowym, tablicowym i ściennym. Z czasem minia zaczęła być stopniowo wypierana z użycia ze względu na toksyczne właściwości. Nazwa pigmentu pochodzi od nazwy rzeki Miño płynącej poprzez półwysep Iberyjski, gdzie tlenek ten został po raz pierwszy wydobyty.
Można go otrzymać poprzez termiczny rozkład bieli ołowiowej , gdzie pośrednim produktem przemiany jest masykot – tlenek ołowiu(II), o barwie żółtej.
Minia zastosowana w dziełach sztuki jest nietrwała i pod wpływem działania światła/wilgoci ciemnieje. Ciekawostką jest fakt, że wielkim fanem tego pigmentu był Vincent Van Gogh.
Minia bywała też stosowana jak czynnik zabezpieczający – np. ołtarz Wita Stwosza w Bazylice Mariackiej w Krakowie został od tyłu pokryty warstwą minii. 
6. Eozyna To czerwony barwnik organiczny, o podanym poniżej wzorze chemicznym: 
7. Koszenila Kwas karminowy (koszenila, karmina) to ciemnoczerwony barwnik organiczny o podanym poniżej wzorze chemicznym:
Występuje naturalnie u owadów (np. czerwców polskich). Z 1 kg suszonych owadów koszenilowych uzyskuje się ok.
50 g karminu.
8. Viridian Viridian to niebiesko-zielony pigment, uwodniony tlenek chromu(III). Jest bardziej zielony niż niebieski. 
Tlenek chromu(III) można otrzymać w reakcji uwodnionego siarczanu(VI) chromu(III) z wodnym roztworem amoniaku:
9. Błękit pruski Charakteryzuje się formułą: , jest to niebieski pigment, otrzymywany sztucznie, a po raz pierwszy przez alchemika i farbiarza Deisbacha w 1704 r. w Berlinie. Jako datę początku jego stosowania przez artystów uznaje się rok 1724. Błękit pruski jest średnio odporny na działania światła i ma niezbyt dobre właściwości kryjące, chociaż odznacza się dużą intensywnością barwienia.
Przykład dzieła, w którym można zobaczyć ów pigment to María de los Dolores Collado y Echagüe, duquesa de Bailén Vincenta Palmaroliego. 
Może być otrzymany w reakcji soli żelaza(III) z heksacyjanożelazianem(II) potasu:
10. Ultramaryna To pigment naturalny, otrzymywany z minerału lapis lazuli. Jest to złożony związek glinokrzemianu sodowego i siarkowego o zmiennym składzie. Przybliżony wzór można zapisać w formie: .
Najstarsze doniesienia o stosowaniu ultramaryny jako pigmentu wiążą się z malarstwem ściennym. Birsztein zidentyfikował ją w malowidłach ściennych w Kara-Tape, datowanych na II-IV w. n.e. Również pojedyncze ziarna ultramaryny wykryto w malowidłach egipskich na płótnie datowanych na IV w. n.e.
Ultramaryna naturalna była pigmentem bardzo drogim, którego wartość zbliżona była do wartości złota. Z tego powodu bardzo intensywnie poszukiwano metody jej syntetycznego otrzymywania na przełomie XVIII i XIX w. Poszukiwania te wspierały nawet różne instytucje, które gwarantowały nagrody finansowe dla odkrywców metody syntezy tego pigmentu. Przełom nastąpił około 1830 r., kiedy metody produkcji przedstawili niezależnie od siebie: Jean Baptiste Guimet oraz Christian Gottlob Gmelin. Od tego czasu ultramaryna syntetyczna praktycznie wyparła tę naturalną z użycia. Pigment ten posiada jasnobłękitne kryształy, ale – oprócz ziaren tego koloru – w ultramarynie naturalnego pochodzenia występują zazwyczaj również ziarna kalcytu oraz pirytu. 
Ultramaryna jest otrzymywana w kilku etapach. Surowce używane do jej produkcji to:
11. Błękit kobaltowy Jest to glinian kobaltu(II) – związek opisywany w literaturze wzorami: lub .
Oficjalnie, otrzymał go po raz pierwszy Józef Leithner w Wiedniu w 1795 r. Natomiast w latach 1802-1804 chemik Louis Jacque Thenard, profesor Uniwersytetu i Politechniki Paryskiej, opracował metodę otrzymywania tego błękitu oraz zaproponował jego praktyczne zastosowanie jako właśnie pigmentu. Co ciekawe, badania prowadzone w wykopaliskach El Amarna i datowane na 1370 r. p.n.e. wskazują, że partie błękitne obiektów zawierają właśnie glinian kobaltu(II).
Przykładem obrazu, w którym znajduje się ten pigment, jest dzieło Wiliama Turnera Ostatnia droga Temeraire’a. 
Glinian kobaltu(II) można otrzymać w następującej reakcji:
12. Żółcienie chromianowe To pigmenty zawierające anion chromianowy(VI) .
Mogą to być:
W języku angielskim często określane są one wspólną nazwą lemon yellow. Istnieje również tzw. żółcień chromowa, którą stanowi chromian(VI) ołowiu , często spotykany również w postaci lub . Wszystkie te pigmenty otrzymuje się najprościej poprzez strącenie osadów z użyciem chromianu(VI) lub dichromianu(VI) potasu.
Pojawiły się w użyciu w XIX w. Żółcień chromową stosował wspominany tu już wielokrotnie Van Gogh. Za przykład stanowi obraz Pole pszenicy z cyprysami.

Chromian ołowiu(II) można otrzymać przez strącanie roztworów chromianów, za pomocą roztworów soli ołowiu:
Korzystając z tabeli rozpuszczalności, zaproponuj równanie reakcji otrzymywania żółcieni chromowej w formie cząsteczkowej. Pamiętaj o uwzględnieniu współczynników stechiometrycznych.
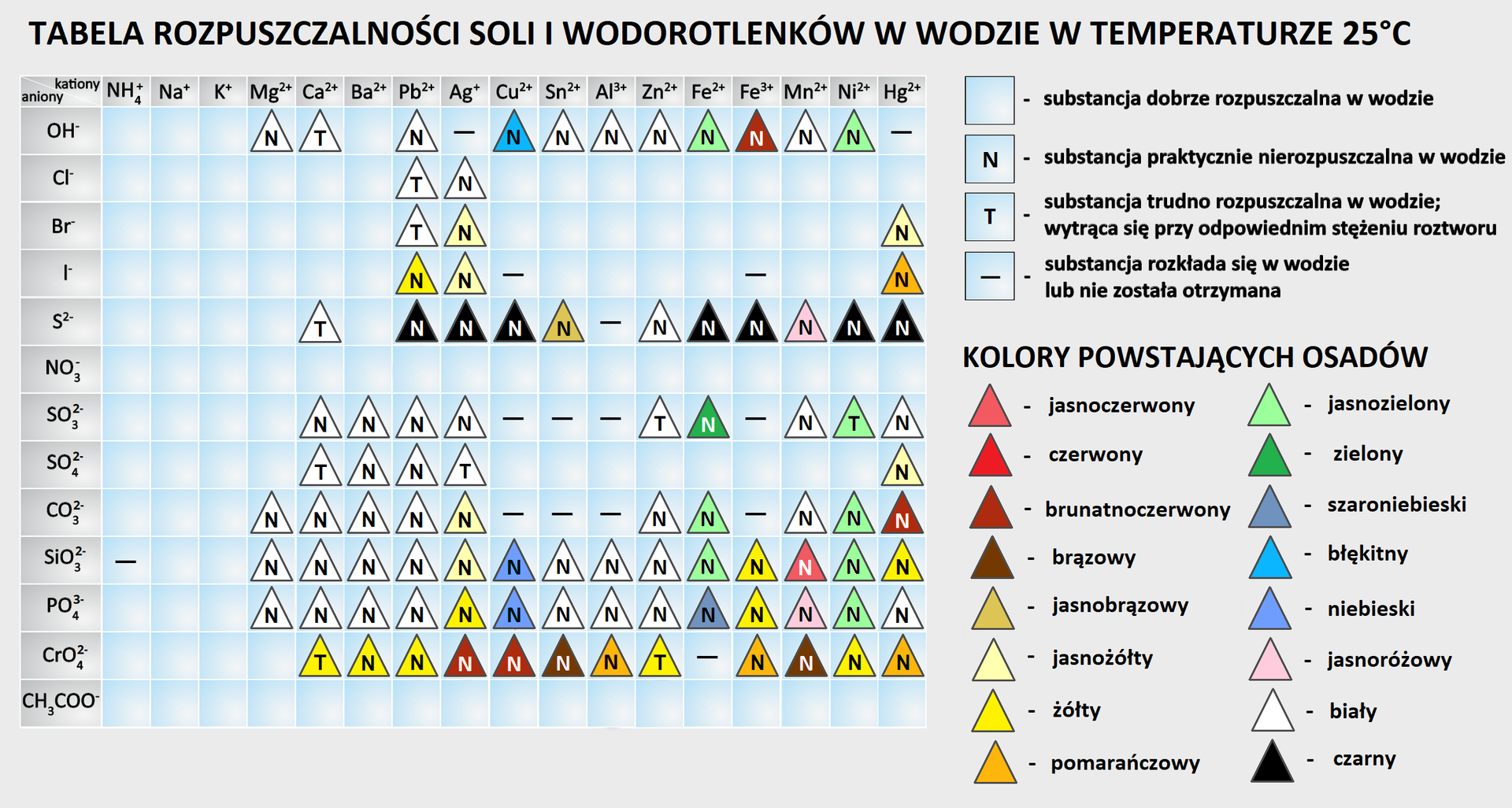
Przyporządkuj wzory sumaryczne pigmentów do ich nazw.
Błękit kobaltowy, Minia ołowiowa, Żółcień chromowa, Biel ołowiana
| 2 PbCO3·Pb(OH)2 | |
| Pb3O4 | |
| PbCrO4 | |
| Co(AlO2)2 |
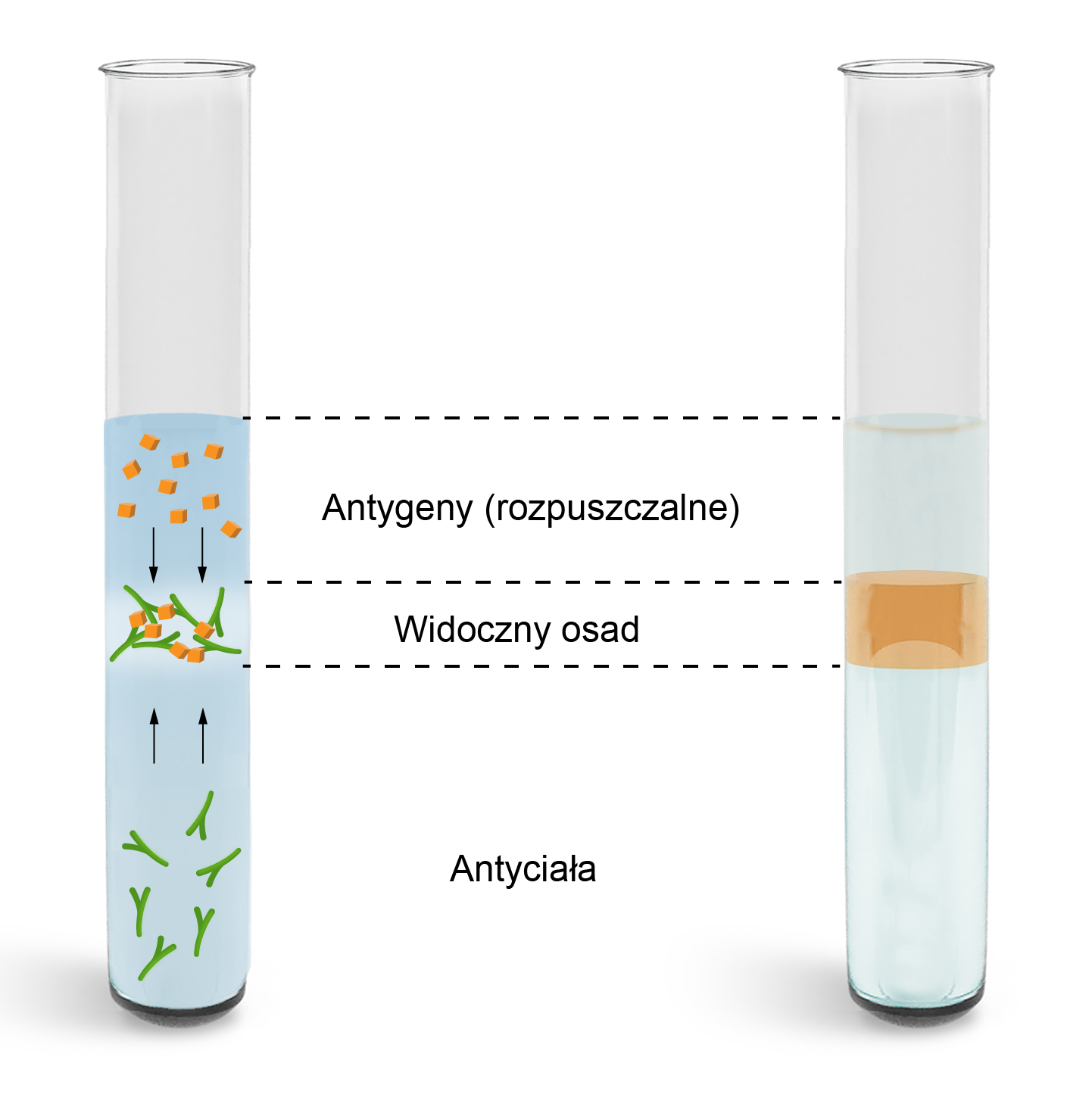
Czy reakcje strąceniowe znalazły zastosowanie w medycynie? Co to jest test Ouchterlony'ego? Jaka jest zasada jego działania? Czy oprócz zalet, istnieją również jego wady? Przeanalizuj poniższą grafikę interaktywną, a następnie odpowiedz na pytania.
Czy reakcje strąceniowe znalazły zastosowanie w medycynie? Co to jest test Ouchterlony'ego? Jaka jest zasada jego działania? Czy oprócz zalet, istnieją również jego wady? Przeanalizuj opis grafiki interaktywnej, a następnie odpowiedz na pytania.
Wyjaśnienie pojęć:
Antygen - preparat chemiczny, która wpływa na odpowiedź immunologiczną organizmu.
Przeciwciała - komórki, które wydziela układ odpornościowy w przypadku kontaktu płynów ustrojowych z antygenami (bakteriami, wirusami) czy z autoantygenami (własnymi tkankami).
Surowica – część osocza krwi, pozbawiona fibrynogenu (białka wytwarzanego w wątrobie) i innych czynników krzepnięcia.
Agar - znany jako E406; preparat żelujący, ekstrahowany z czerwonych alg, takich jak Gracilaria i Gelidium, gdzie głównym składnikiem jest cukier o nazwie galaktoza (trudno przyswajalna przez człowieka).
Żel agarowy - żel powstały przez zmieszanie agaru (dostępnego w handlu w postaci proszku) z wodą.
Wyjaśnij, w jakim celu stosuje się glicerol w próbie obrączkowej, przedstawionej na poniższej fotografii.
Wyjaśnij, w jakim celu stosuje się glicerol w próbie obrączkowej. Zapoznaj się z opisem fotografii.