Grafika interaktywna
Czym różni się amina alifatyczna od aromatycznej? Czy oprócz budowy różnią się też właściwościami fizycznymi? Przeanalizuj grafikę interaktywną, przedstawiającą etyloaminę i anilinę, a następnie przejdź do rozwiązania ćwiczeń.
Czym różni się amina alifatyczna od aromatycznej? Czy oprócz budowy różnią się też właściwościami fizycznymi? Zapoznaj się z opisem grafiki interaktywnej, przedstawiającej etyloaminę i anilinę, a następnie przejdź do rozwiązania ćwiczeń.
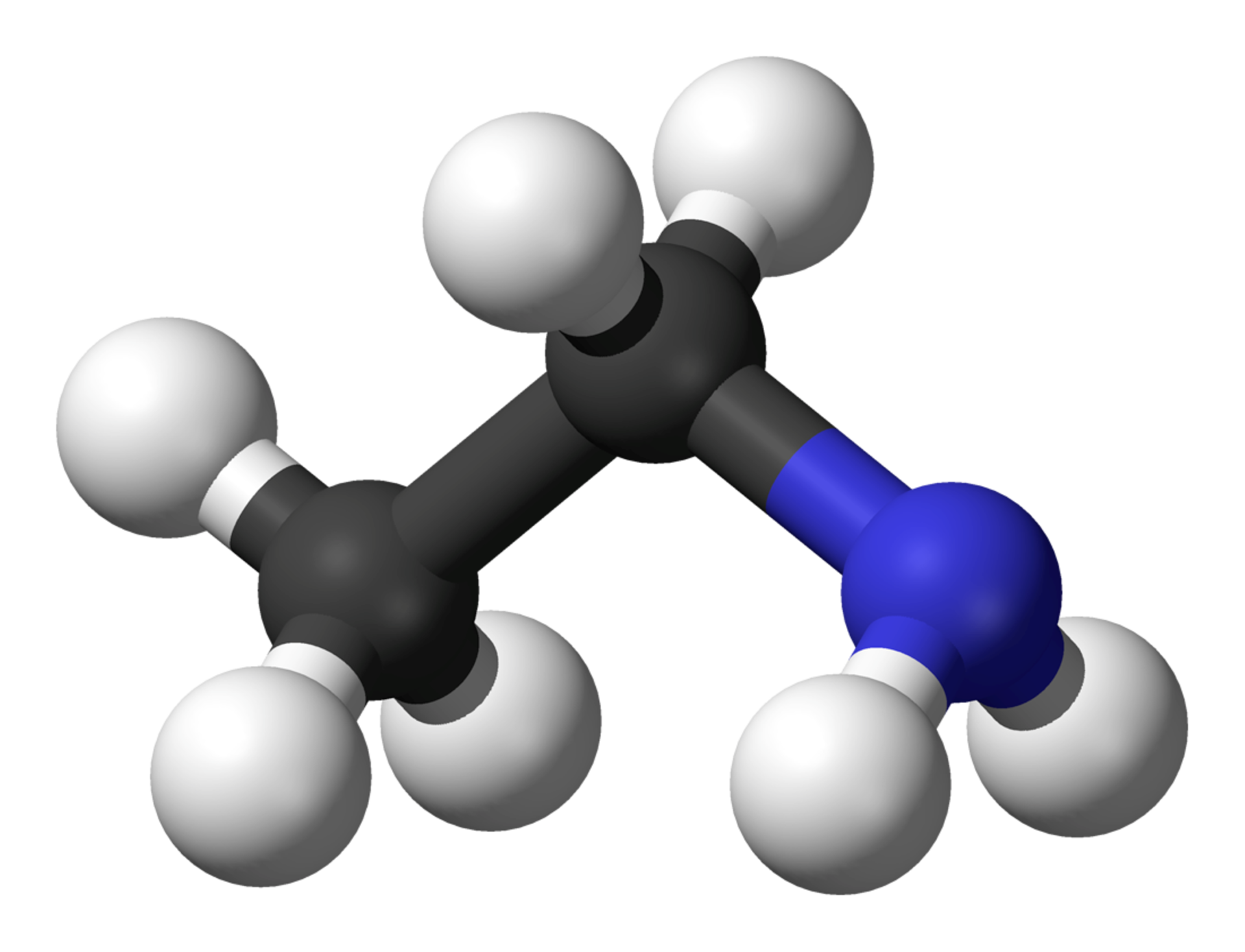
Przyjrzyj się modelom cząsteczek amin I‑rzędowych. Podaj nazwy amin i nazwę grupy funkcyjnej, która jest wspólna zarówno dla amin alifatycznych, jak i aromatycznych.
Zapoznaj się z opisem modeli cząsteczek amin I‑rzędowych. Podaj nazwy amin i nazwę grupy funkcyjnej, która jest wspólna zarówno dla amin alifatycznych, jak i aromatycznych.
Dlaczego aminy alifatyczne są mocniejszymi zasadami niż ? Dlaczego aminy III‑rzędowe są słabszymi zasadami niż aminy II‑rzędowe? Zgodnie z teorią, zasadowość amin powinna wzrastać wraz z ich stopniem podstawienia atomu azotu w cząsteczce aminy, tj. rzędowością (obserwuje się to zjawisko w fazie gazowej). W roztworach wodnych równowaga protonowania nie jest związana tylko z gęstością elektronową na atomie azotu, ale także z możliwością solwatowania tworzącego się kationu. Dla amin trzeciorzędowych możliwość solwatacji kationu jest utrudniona ze względów sterycznych. Dlatego w roztworach wodnych obserwuje się następującą zależność powiązaną z zasadowością amin alifatycznych od ich rzędowości: RIndeks dolny 22NH> RNHIndeks dolny 22> RIndeks dolny 33N. A jak wytłumaczysz fakt, że aminy aromatyczne są dużo słabszymi zasadami niż amoniak i aminy alifatyczne? Czy jest to związane z ich budową?
Przeanalizuj kolejną grafikę interaktywną, a następnie rozwiąż zadania.
Zapoznaj się z opisem kolejnej grafiki interaktywnej, a następnie rozwiąż zadania.
Wskaż zdanie prawdziwe.
- Aminy alifatyczne są słabszymi zasadami niż NH3.
- Aminy III-rzędowe są mocniejszymi zasadami niż aminy II-rzędowe
- Aminy aromatyczne wykazują dużo słabsze właściwości zasadowe od amoniaku i amin alifatycznych.
- Aminy aromatyczne wykazują dużo mocniejsze właściwości zasadowe od amoniaku i amin alifatycznych.
Wskaż zdanie fałszywe.
- W N-fenyloanilinie grupa funkcyjna jest bezpośrednio przyłączona do dwóch pierścieni aromatycznych.
- W N-etyloetanie grupa funkcyjna jest bezpośrednio przyłączona do dwóch grup metylowych.
- W etano-1-aminie grupa funkcyjna jest bezpośrednio przyłączona do jednej grupy etylowej.
- W anilinie grupa funkcyjna jest bezpośrednio przyłączona do pierścienia aromatycznego.