Przeczytaj
Czym są aminy?
Aminy to związki organiczne. Są pochodnymi amoniaku, w którego cząsteczce atom lub atomy wodoru zostały zastąpione grupą alkilową/arylową lub grupami alkilowymi/arylowymi. Rzędowość amin określa liczbę atomów wodoru przy atomie azotu zastąpionych atomami węgla. Prościej mówiąc, określa, ile podstawników niebędących atomami wodoru przyłączonych jest do atomu azotu.
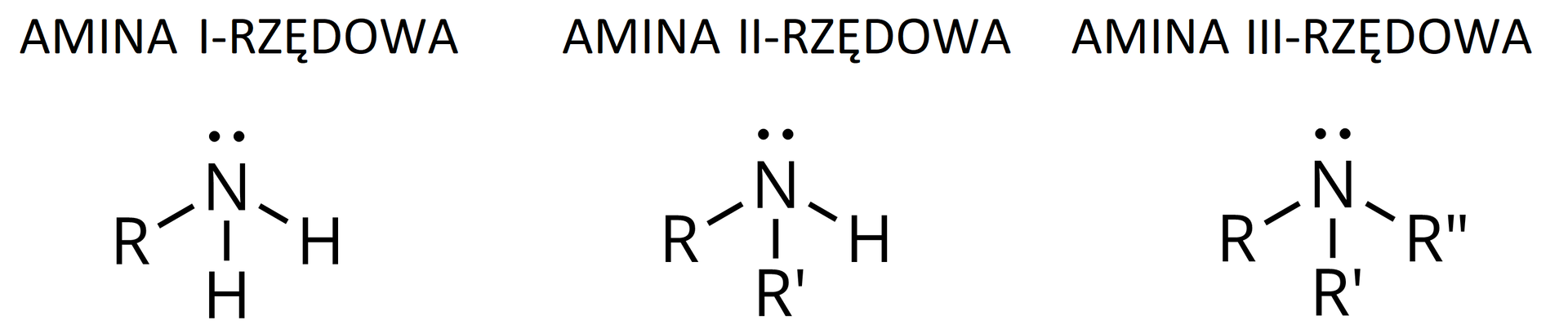
Klasyfikacja amin

Podaj nazwy systematyczne poniższych związków przedstawionych za pomocą wzorów półstrukturalnych. Zaklasyfikuj każdy ze związków do odpowiedniej grupy (aminy alifatyczne/aminy aromatyczne).
A.
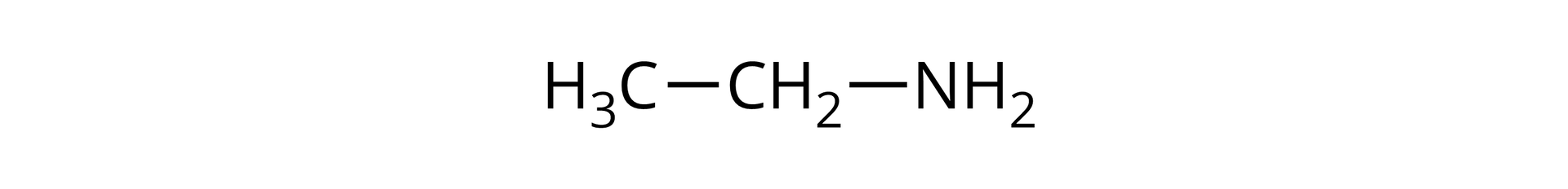
B.

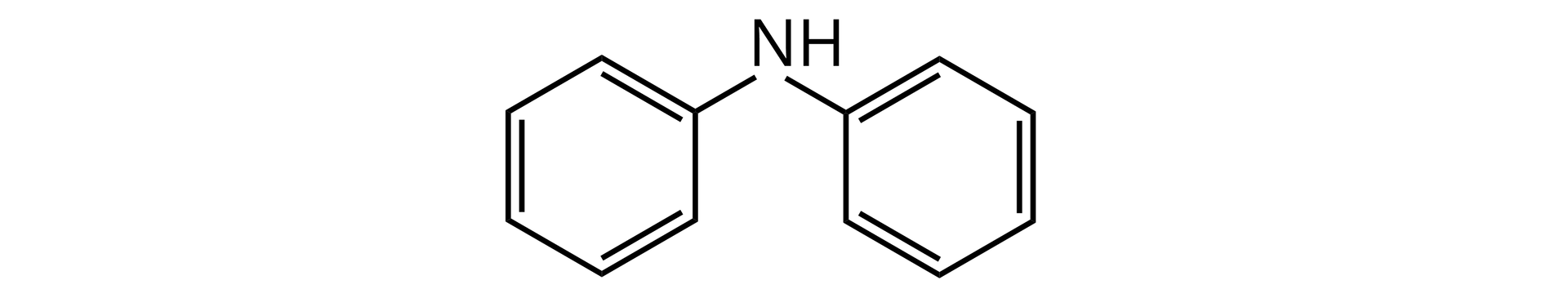
C.
Podobieństwa w budowie amin alifatycznych i aromatycznych
Aminy alifatyczne i aminy aromatyczne posiadają tę samą grupę funkcyjnągrupę funkcyjną. W przypadku amin I‑rzędowych (zarówno alifatycznych jak i aromatycznych) jest to grupa (grupa aminowa). Atom azotu grupy aminowej posiada hybrydyzację spIndeks górny 33 i jest połączony z grupą węglowodorową (alkilową lub arylową) oraz dwoma atomami wodoru. Posiada również wolną parę elektronową. Cząsteczka ma kształt piramidy trygonalnej, natomiast geometria uwzględniająca wszystkie pary elektronowe (wiążące i niewiążące) to tetraedr. Obecność wolnej pary elektronowej na atomie azotu warunkuje zasadowe właściwości amin, ponieważ sprawia, że cząsteczka aminy może być donorem pary elektronowej i pełnić tym samym funkcję zasady.


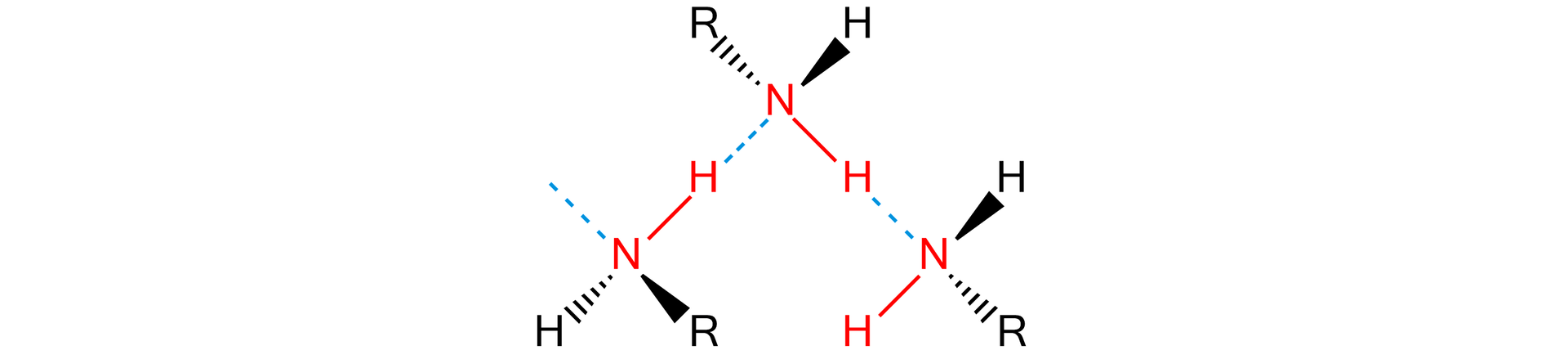
Obecność wolnej pary elektronowej na atomie azotu w aminach sprawia, że mogą one tworzyć wiązania wodorowewiązania wodorowe. Dotyczy to zarówno anim alifatycznych, jak i aromatycznych. Wiązania wodorowe, występujące pomiędzy cząsteczkami amin, są słabsze niż te, które występują pomiędzy grupami hydroksylowymi. Ma to związek z większą polarnością wiązania pomiędzy elektroujemnym pierwiastkiem a wodorem.
Różnica w budowie amin alifatycznych i aromatycznych
Aminy alifatyczne mogą posiadać zarówno grupy alkilowe, jak i arylowe. Jednak istotną cechą jest bezpośrednie połączenie grupy aminowej z grupą alkilową.
Z kolei aminy aromatyczne posiadają w swoich cząsteczkach pierścień aromatyczny, który jest bezpośrednio połączony z grupą aminową.

Konsekwencją takiej budowy jest delokalizacja wolnej pary elektronów atomu azotu grupy aminowej w obrębie pierścienia aromatycznego.

Bezpośrednie połączenie grupy aminowej z pierścieniem aromatycznym sprawia, że aminy aromatyczne ulegają zupełnie innym reakcjom niż aminy alifatyczne, ponieważ grupa aminowa jest grupą aktywującą pierścień aromatyczny. Wpływa to również na zmniejszoną zasadowość amin aromatycznych.
Podsumowanie
Aminy alifatyczne i aminy aromatyczne posiadają taką samą grupę funkcyjną, czyli grupę aminową. Aminy alifatyczne to związki organiczne, w cząsteczkach których azot z grupy funkcyjnej jest bezpośrednio przyłączony do grupy alkilowej. Aminy aromatyczne to związki organiczne, w cząsteczkach których azot z grupy funkcyjnej jest bezpośrednio przyłączony do pierścienia aromatycznego.
Słownik
(łac. functio „czynność”) atom lub grupa atomów w związkach organicznych, która decyduje o właściwościach danego związku oraz jego przynależności do danej klasy związków
(łac. hybrida „mieszaniec”) operacja matematyczna, która umożliwia wytłumaczenie kształtu cząsteczek składających się z wielu atomów; potocznie mówi się, że jest to mieszanie się orbitali s i p; powstają orbitale o takim samym kształcie i energii
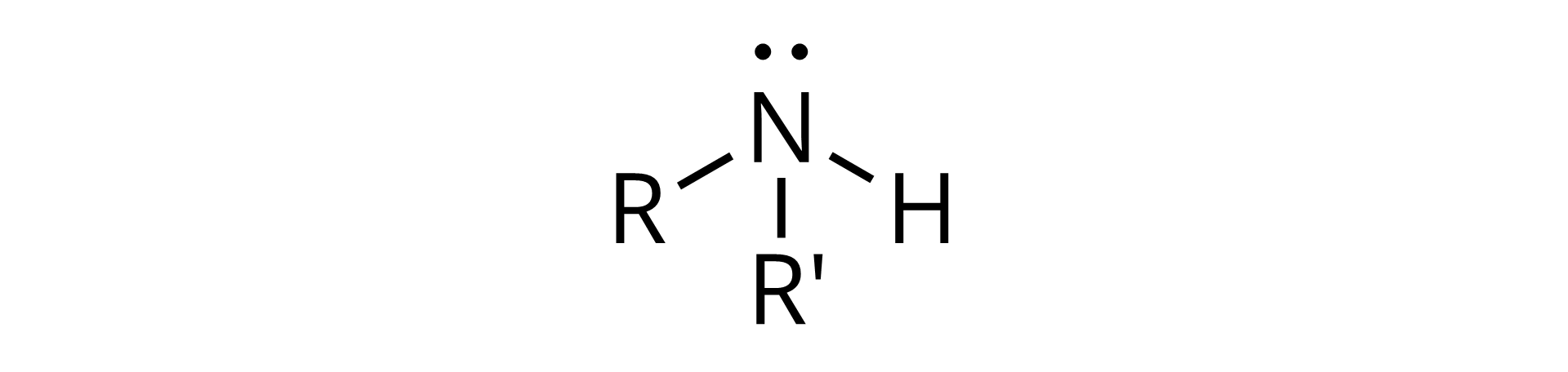
amina, w której cząsteczce jedna grupa węglowodorowa jest powiązana z atomem azotu; wzór ogólny aminy I‑rzędowej: gdzie: oznacza grupę alkilową lub arylową; oznacza grupę aminową
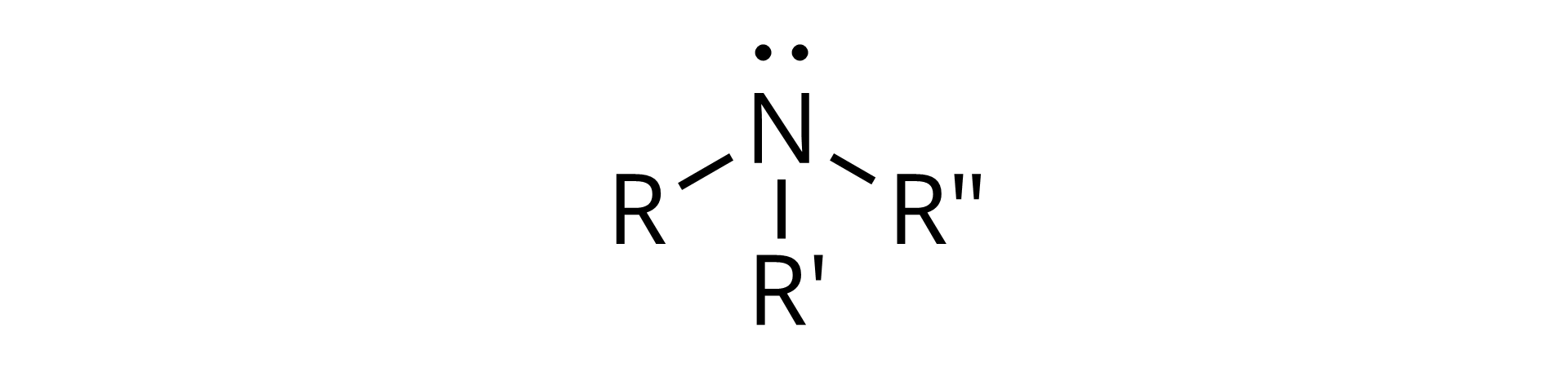
amina, w której cząsteczce dwie grupy węglowodorowe są powiązane z atomem azotu; wzór ogólny aminy alifatycznej II‑rzędowej:
amina, w której cząsteczce trzy grupy węglowodorowe są powiązane z atomem azotu; wzór ogólny aminy alifatycznej III‑rzędowej:
oddziaływania pomiędzy atomem z wolną parą elektronową, który wykazuje dużą elektroujemność, a atomem wodoru, który jest powiązany z atomem o dużej elektroujemności
Bibliografia
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Bobrański B., Chemia organiczna, Warszawa 1992.
Czerwiński A., Czerwińska A., Jelińska- Kazimierczuk M., Kuśmierczyk K., Chemia 2. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2003
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2016.
Hassa R., Mrzigod A., Mrzigod J., To jest chemia. Podręcznik dla szkół ponadgimnazjalnych. Zakres podstawowy, Warszawa 2016.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, Warszawa 2007.
Litwin M., Styka – Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016
McMurry J., Chemia organiczna 4, Warszawa 2004.
Pazdro K. M., Rola – Noworyta A., Chemia. Repetytorium dla przyszłych maturzystów i studentów, Warszawa 2017.