Izotopy pierwiastków
Atomy tego samego pierwiastka mogą różnić się między sobą pewnymi elementami budowy. Nie oznacza to jednak, że tlen którym oddychamy w Polsce, różni się od tego, którym oddychają Inuci.
że atomy są zbudowane z jądra atomowego i poruszających się wokół niego elektronów;
że jądro atomowe składa się z protonów i neutronów;
że suma liczb protonów i neutronów jest nazywana liczbą masową;
że liczba protonów w jądrze to liczba atomowa;
że pierwiastki w układzie okresowym są uporządkowane według wzrastania liczby atomowej.
wyjaśniać, co to są izotopy;
opisywać izotopy za pomocą symboli;
omawiać różnice w budowie atomów izotopów wodoru;
obliczać masę izotopu;
obliczać średnią masę pierwiastka chemicznego.
1. W jaki sposób atomy tego samego pierwiastka chemicznego mogą się różnić między sobą?
Atomy należące do tego samego pierwiastka mają jednakowy ładunek jądra (identyczną liczbę protonów) oraz taką samą liczbę poruszających się wokół jądra elektronów. Jednak, jak się okazuje, atomy te mogą różnić się masą. Przyczyną tego zjawiska jest możliwość występowania w jądrach atomów tego samego pierwiastka różnej liczby neutronów. Te atomy, które mają więcej obojętnych cząstek, mają większą masę.
O atomach pierwiastka, które zawierają jednakową liczbę protonów, a różnią się liczbą neutronów w jądrze, mówi się, że są izotopamiizotopami.
Zastanów się, czy izotopy tego samego pierwiastka mają jednakowe liczby: atomową i masową. Jeśli nie, to która z tych liczb może być różna? Dlaczego?
Pierwiastkiem, który ma kilka izotopów, jest azot. W jądrze jednego z nich znajduje się siedem, a w jądrze drugiego – osiem neutronów. Każdy z tych izotopów ma taką samą liczbę protonów, którą można odczytać z układu okresowego.

Liczba atomowa azotu wynosi 7 i tyle też protonów znajduje się w jądrach wszystkich atomów tego pierwiastka. W przypadku opisanych powyżej izotopów suma protonów i neutronów będzie różna.
Numer atomu | Liczba protonów | Liczba atomowa | Liczba neutronów | Liczba masowa | Opis atomu |
1 | 7 | 7 | 7 | 7 + 7 = 14 | |
2 | 7 | 7 | 8 | 7 + 8 = 15 |
Istotna w opisie izotopów jest informacja dotycząca liczby neutronów, które one zawierają. Dlatego do ich opisu wykorzystuje się głównie liczbę masową, dostarczającą informacji na temat liczby tych cząstek. Liczba atomowa najczęściej jest pomijana z uwagi na to, że można ją znaleźć w układzie okresowym.
Izotopy prezentuje się na dwa sposoby: liczbę masową umieszcza się w górnym indeksie z lewej strony symbolu pierwiastka bądź też po myślniku za nazwą pierwiastka, np.: lub azot‑14.
2. Czy izotopy można znaleźć w przyrodzie?
Pierwiastki chemiczne występujące w przyrodzie są mieszaniną izotopów o stałym składzie procentowym. Mogą one składać się z jednego, kilku lub więcej izotopów.
Niektóre izotopy pierwiastków są trwałe, inne zaś nie. Nietrwałe ulegają przemianom, w których mogą powstać izotopy tego samego bądź innego pierwiastka. Tej przemianie towarzyszy emisja promieniowania.
Na Ziemi można spotkać pierwiastki o liczbie atomowej do 92 włącznie (oprócz technetu i prometu). Pierwiastki o liczbie atomowej do 83 są trwałe. Z uwagi na brak w środowisku naturalnym technetu i prometu na Ziemi istnieje 81 pierwiastków, które mają trwałe izotopy.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D14log14V
- pierwiastki posiadające trwałe izotopy
- pierwiastki występujące na Ziemi
Skład izotopowy pierwiastków chemicznych. Klikając na dany pierwiastek chemiczny występujący naturalnie, wyświetlisz informację o procentowej zawartości poszczególnych jego izotopów w przyrodzie.
Na podstawie układu okresowego przedstawiającego procentową zawartość trwałych izotopów poszczególnych pierwiastków ustal, ile pierwiastków ma tylko jedną naturalną odmianę izotopową i które pierwiastki mają ich najwięcej.
3. Ile izotopów wodoru występuje w przyrodzie?
Izotopy o jednakowej liczbie atomowej należą do tego samego pierwiastka. Zasadniczo wykazują one jednakowe właściwości, a jedynym wyjątkiem są izotopy wodoru. Wodór występujący w przyrodzie jest mieszaniną głównie dwóch trwałych izotopów: (99,985%) i (0,015%). Oznacza to, że na 100 000 atomów wodoru 99 985 atomów to izotopy , a 15 atomów – izotopy . Istnieje jeszcze trzeci, nietrwały izotop . Występuje on w śladowych ilościach. Izotopy wodoru jako jedyne w świecie pierwiastków otrzymały swoje nazwy: prot, deuter i tryt.
Symbol izotopu wodoru
lub wodór‑1
Nazwa izotopu wodoru – prot
Model izotopu wodoru

Symbol izotopu wodoru
lub wodór‑2
Nazwa izotopu wodoru – deuter
Model izotopu wodoru

Symbol izotopu wodoru
lub wodór‑3
Nazwa izotopu wodoru – tryt
Model izotopu wodoru

Łatwo zauważyć, że izotopy wodoru różnią się liczbą nukleonów. Z tego powodu istnieje między nimi duża różnica mas, np. atom deuteru ma masę dwukrotnie większą od masy atomu protu, a tryt – aż trzykrotnie. Zjawisko to wpływa na właściwości tych izotopów: prot, deuter i tryt mają odmienne właściwości.
Izotop | Symbol izotopu | Gęstość [g/dmIndeks górny 33] | Temperatura topnienia [K] | Temperatura wrzenia [K] |
prot | H | 0,08233 | 13,83 | 20,27 |
deuter | D | 0,1645 | 18,73 | 23,67 |
tryt | T | 0,2464 | 20,62 | 25,04 |
Ciężka woda
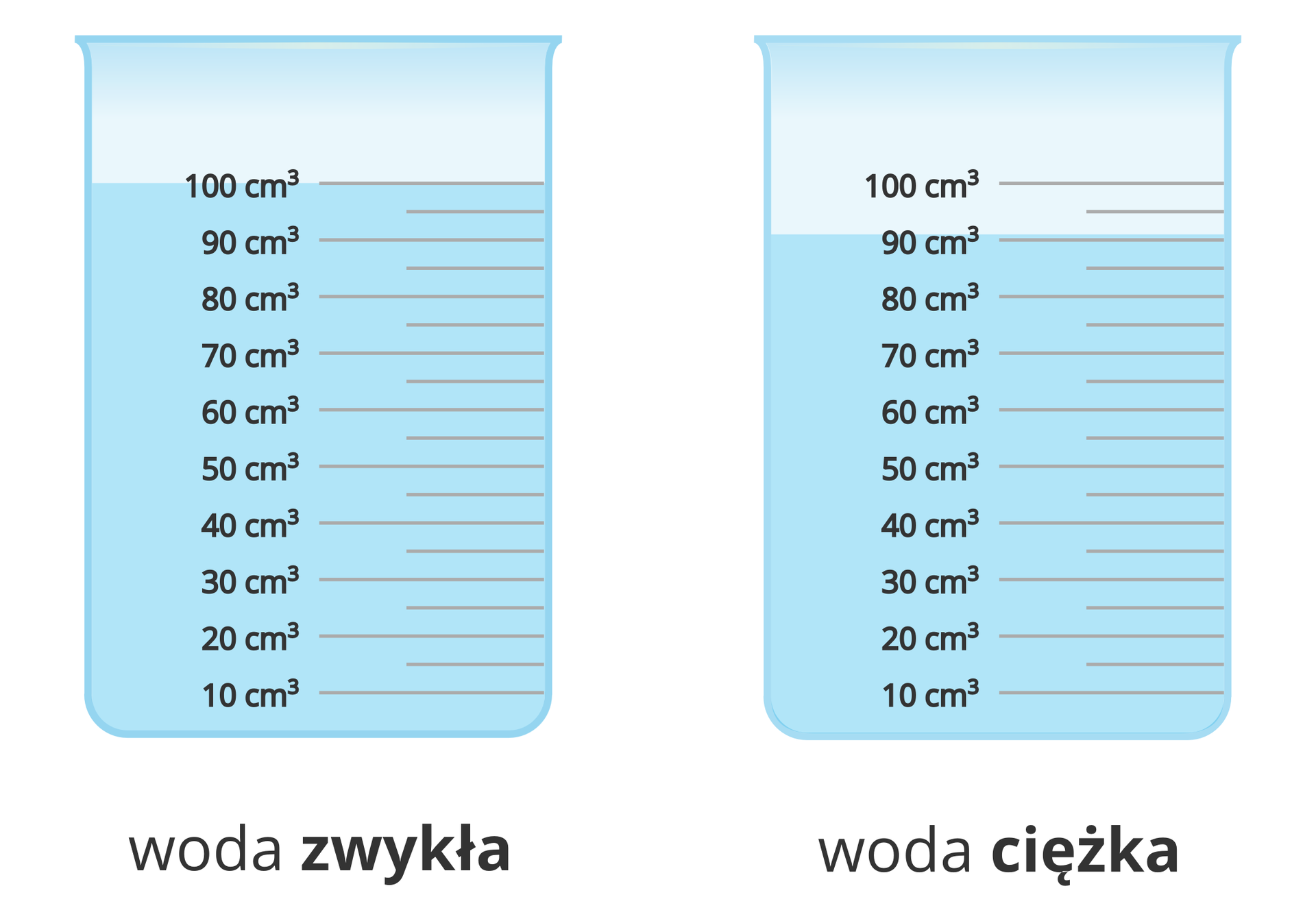
Woda składa się z wodoru i tlenu. Zawarty w niej wodór ma charakterystyczny dla siebie skład izotopowy. Obok protu, w bardzo małych ilościach, występuje w wodzie także deuter. Możliwe jest uzyskanie wody składającej się z tlenu i tylko jednego izotopu wodoru – deuteru. Taką wodę określa się mianem wody ciężkiej. Różni się ona pod względem właściwości fizycznych od wody spotykanej w przyrodzie. Ma większą gęstość oraz wyższą temperaturę wrzenia i topnienia.
Rodzaj wody | Temperatura topnienia | Temperatura wrzenia | Gęstość w temperaturze 298K [g/cmIndeks górny 33] |
zwykła (zbudowana z tlenu i wodoru – mieszaniny izotopów o ustalonym składzie) | 0,00 | 99,974 | 0,998 |
woda ciężka (zbudowana z tlenu i deuteru) | 3,81 | 101,42 | 1,1044 |
Z uwagi na różną gęstość ta sama masa wody ciężkiej i „zwykłej” ma inną objętość. 100 g wody zwykłej zajmuje objętość około 100 cmIndeks górny 33, podczas gdy ta sama masa wody ciężkiej mieści się w około 90,5 cmIndeks górny 33.
4. Gdzie człowiek wykorzystuje izotopy?
Izotopy znalazły zastosowanie w różnych dziedzinach życia człowieka: w medycynie, badaniach naukowych, energetyce, przemyśle, a nawet w gospodarstwie domowym.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D14log14V
5. Jakie masy mają izotopy?
Z uwagi na ogromne różnice między masą elektronu a masą nukleonów (protonu i neutronu) o masie atomu decyduje przede wszystkim liczba obecnych w nim protonów i neutronów. Prawie cała masa atomu jest skupiona w jego jądrze.
Nazwa | Symbol | Masa [u] |
elektron | e (eIndeks górny --) | |
proton | p (pIndeks górny ++) | 1 |
neutron | n (n) | 1 |
Masa protonu jest w przybliżeniu równa masie neutronu i wynosi 1 u (1 u = 1,66 Indeks górny .. 10Indeks górny -24-24 g), dlatego tyle, ile nukleonów zawiera jądro atomowe, wyniesie w przybliżeniu jego masa atomowa wyrażona w unitach. Można powiedzieć, że suma mas protonów i neutronów, czyli liczba masowa, jest liczbowo równa masie atomowej wyrażonej w atomowych jednostkach masy [u].

Korzystając z powyższych informacji i wzoru (masa atomowa [u] = liczba masowa Indeks górny .. 1 u), łatwo można obliczyć, że masa atomowa protu () wynosi 1 u, deuteru () 2 u, natomiast trytu () 3 u.
6. Średnia masa atomowa pierwiastków
Masa atomowa zapisana w układzie okresowym to masa atomowa uśredniona. Dlatego często przyjmuje wartości ułamkowe. Przy jej obliczaniu wzięto pod uwagę to, że pierwiastki chemiczne składają się z izotopów, a każdy izotop ma swój udział w masie atomowej danego pierwiastka.
Analogicznie jest w przypadku próby określenia średniej masy ciała uczniów w klasie na podstawie informacji, że 5% z nich waży 40 kg, następne 15% ma masę 60 kg, a pozostali, czyli 80% uczniów, ważą po 50 kg. Wówczas średnia masa wszystkich uczniów wynosiłaby 51 kg:
Wynik byłby taki, mimo że nikt z uczniów nie ma takiej masy ciała.
Podobnie jest z pierwiastkami chemicznymi – przy obliczaniu ich średnich mas atomowych bierze się pod uwagę skład izotopowy (skład procentowy) każdego z nich. Do obliczania średnich mas atomowych pierwiastków można posłużyć się następującym wzorem:
gdzie:
– procentowa zawartość izotopu.
Przy użyciu powyższego wzoru można obliczyć średnią masę atomową wodoru:

Film dostępny pod adresem /preview/resource/RZilHh72CrYcy
Film rozpoczyna plansza z poleceniem: Wyznacz średnią masę atomową potasu, jeśli jest on mieszaniną następujących izotopów - K-39 w ilości 93,2581%, K-40 w ilości 0,0117% oraz K-41 w ilości 6,7302%. Pod tym napisem pojawia się wzór na średnią masę atomową pierwiastka z jego izotopów, a następnie wzór na średnią masę atomową pierwiastka K o trzech izotopach. Następnie pojawiają się pytania pomocnicze dotyczące masy wszystkich trzech izotopów potasu. Wraz z komentarzem znaki zapytania w równaniach masy trzech izotopów zostają zastąpione wartościami liczbowymi. Z ekranu znikają równania, a pozostają dane liczbowe wymagane do przeprowadzenia obliczeń. Następuje podstawienie danych do wzoru i podanie wyniku: średnia masa atomowa potasu jest równa 39,1347 unitów.
Podsumowanie
Izotopy są to atomy tego samego pierwiastka chemicznego, które mają jednakową liczbę protonów oraz różną liczbę neutronów.
Większość pierwiastków chemicznych występujących w przyrodzie stanowi mieszaninę izotopów o stałym składzie.
Izotopy wodoru to: prot (), deuter () i tryt (). Różnią się one właściwościami.
Izotopy mają zastosowanie między innymi w medycynie (w obrazowaniu i leczeniu zmian nowotworowych), w przemyśle (do otrzymywania energii), w badaniach naukowych (do określania wieku materiałów pochodzenia organicznego oraz określania przebiegu przemian jednych substancji w drugie).
Masa atomowa pierwiastka chemicznego jest średnią masą atomową otrzymaną po uwzględnieniu jego składu izotopowego.
Masa izotopu jest liczbowo w przybliżeniu równa jego liczbie masowej.
Wyjaśnij, dlaczego nie można wykorzystać metody określania wieku materiałów pochodzenia organicznego na podstawie zawartości nietrwałego izotopu węgla‑14 do oceny wieku pokładów węgla kamiennego i ropy naftowej. Zadanie to wykonaj w formie notatki w zeszycie.
Słowniczek
odmiany tego samego pierwiastka, które mają jednakową liczbę atomową (liczbę protonów w jądrze) i różną liczbę masową (liczbę neutronów w jądrze)
Zadania
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Każdy z pierwiastków składa się z co najmniej dwóch izotopów. | □ | □ |
| Wszystkie izotopy danego pierwiastka mają jednakową masę. | □ | □ |
| Tryt zawiera trzy nukleony. | □ | □ |
| Masa prezentowana przy symbolu pierwiastka w układzie okresowym jest masą najpowszechniej występującego izotopu tego pierwiastka. | □ | □ |
| Masa izotopu jest równa liczbowo w przybliżeniu sumie jego protonów i neutronów. | □ | □ |
Uzupełnij zdanie, wybierając właściwe wyrażenia z listy. Izotopy tego samego pierwiastka mają jednakową liczbę:
- protonów.
- elektronów.
- atomową.
- elektronów walencyjnych.
- powłok elektronowych.
- nukleonów.
- neutronów.
- masową.
Wskaż zapis przedstawiający izotop chloru, którego jądro zawiera 20 neutronów.
Oblicz, jaką przybliżoną masę atomową ma izotop kobaltu: . Wybierz właściwą odpowiedź.
- 59 u
- 32 u
- 86 u
- 27 u
Oblicz, jaką masę atomową ma izotop jodu, jeśli w jego jądrze znajdują się 74 neutrony. Wskaż właściwą odpowiedź.
- 127 u
- 74 u
- 53 u
- 21 u
Oblicz średnią masę atomową żelaza, jeśli jego skład izotopowy jest następujący: , , , . Wskaż poprawną odpowiedź.
- 55,8546 u
- 56,2500 u
- 56,000 u
Oblicz, jaką masę wyrażoną w atomowych jednostkach masy ma 10 000 atomów miedzi, jeśli skład izotopowy tego pierwiastka jest następujący: , Wskaż właściwą odpowiedź.
- 636 166 u
- 10 000 u
- 65 000 u
- 630 000 u
- 29 u
- 63,616 u