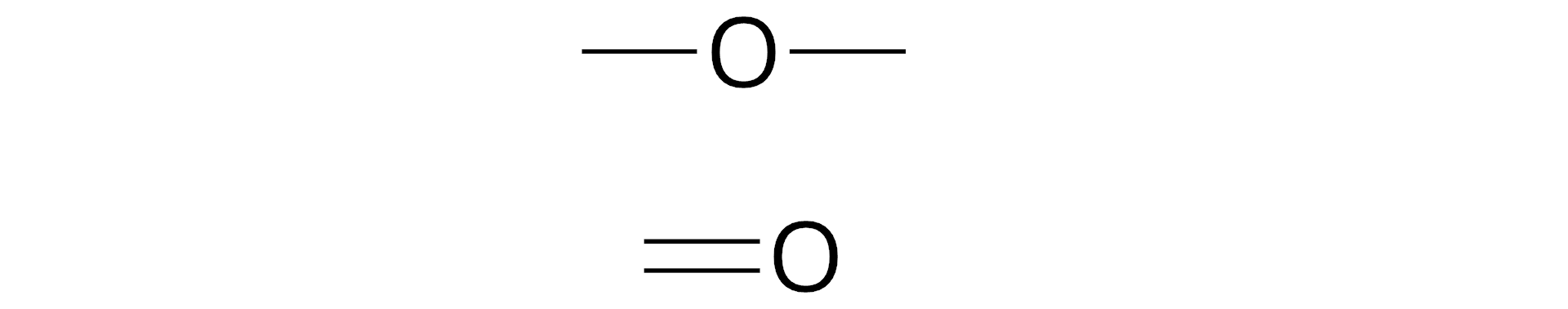
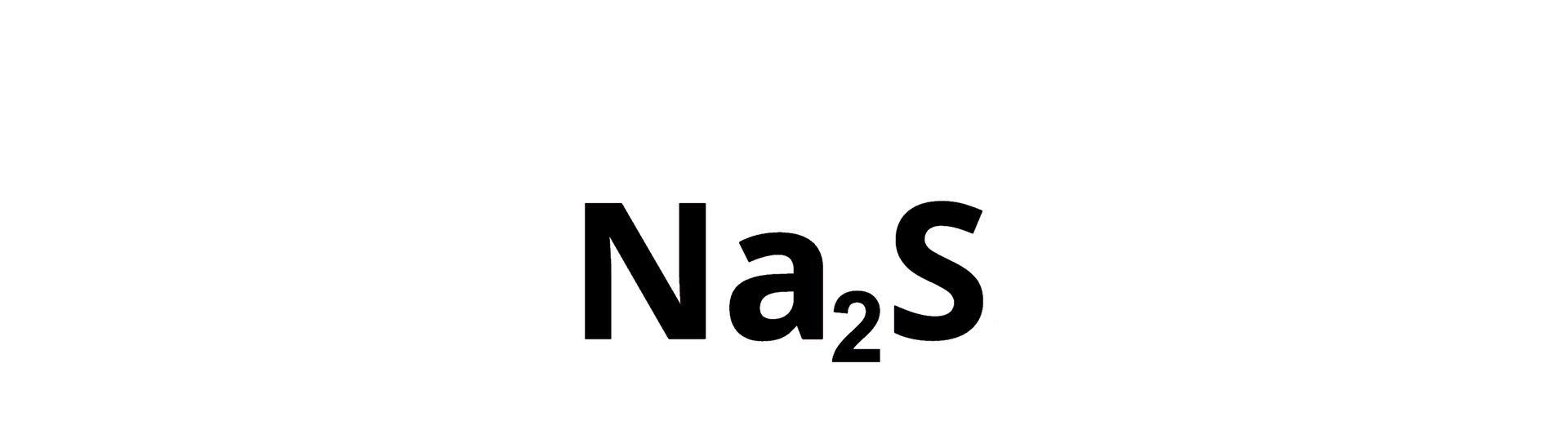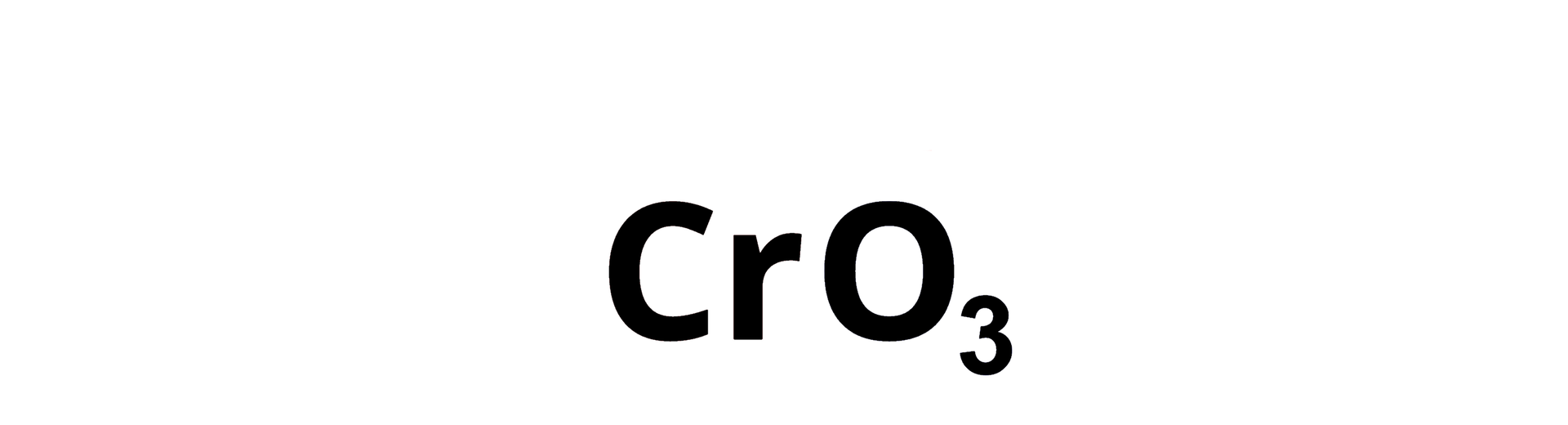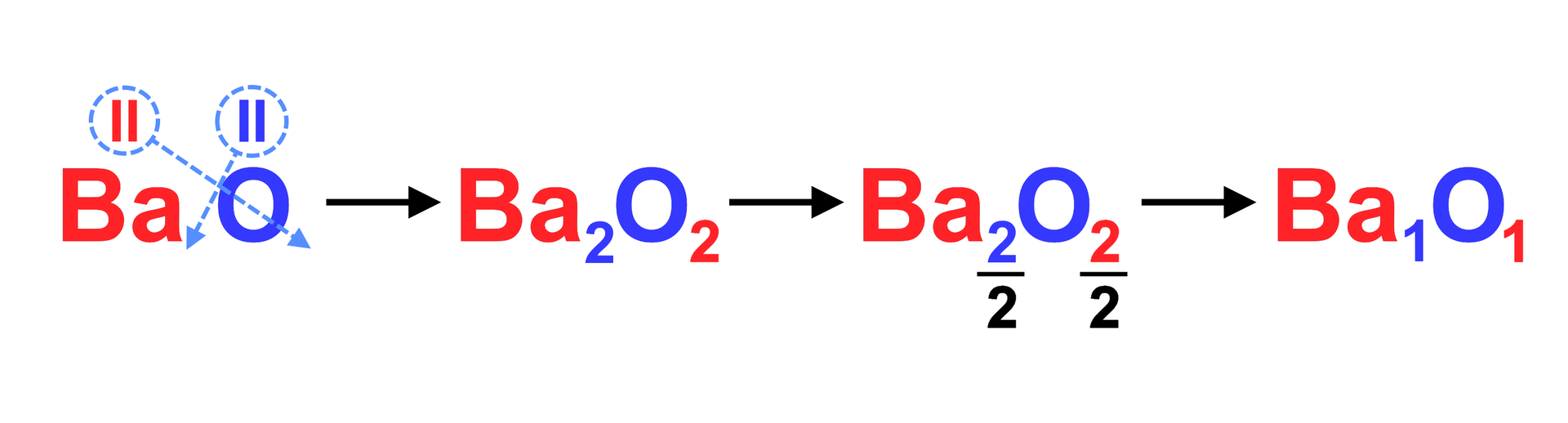Jak definiujemy wartościowość?
Podczas zgłębiania wiedzy chemicznej, nie trzeba wszystkiego uczyć się na pamięć. Często wystarczy znajomość pewnych ogólnych reguł, pozwalających na opisywanie nowych faktów. Przykładem są wzory sumaryczne niektórych związków, które w dość prosty sposób można prawidłowo zapisać na podstawie tylko jednej informacji o atomach pierwiastków tworzących substancję złożoną.
Co to jest wzór strukturalny cząsteczki?
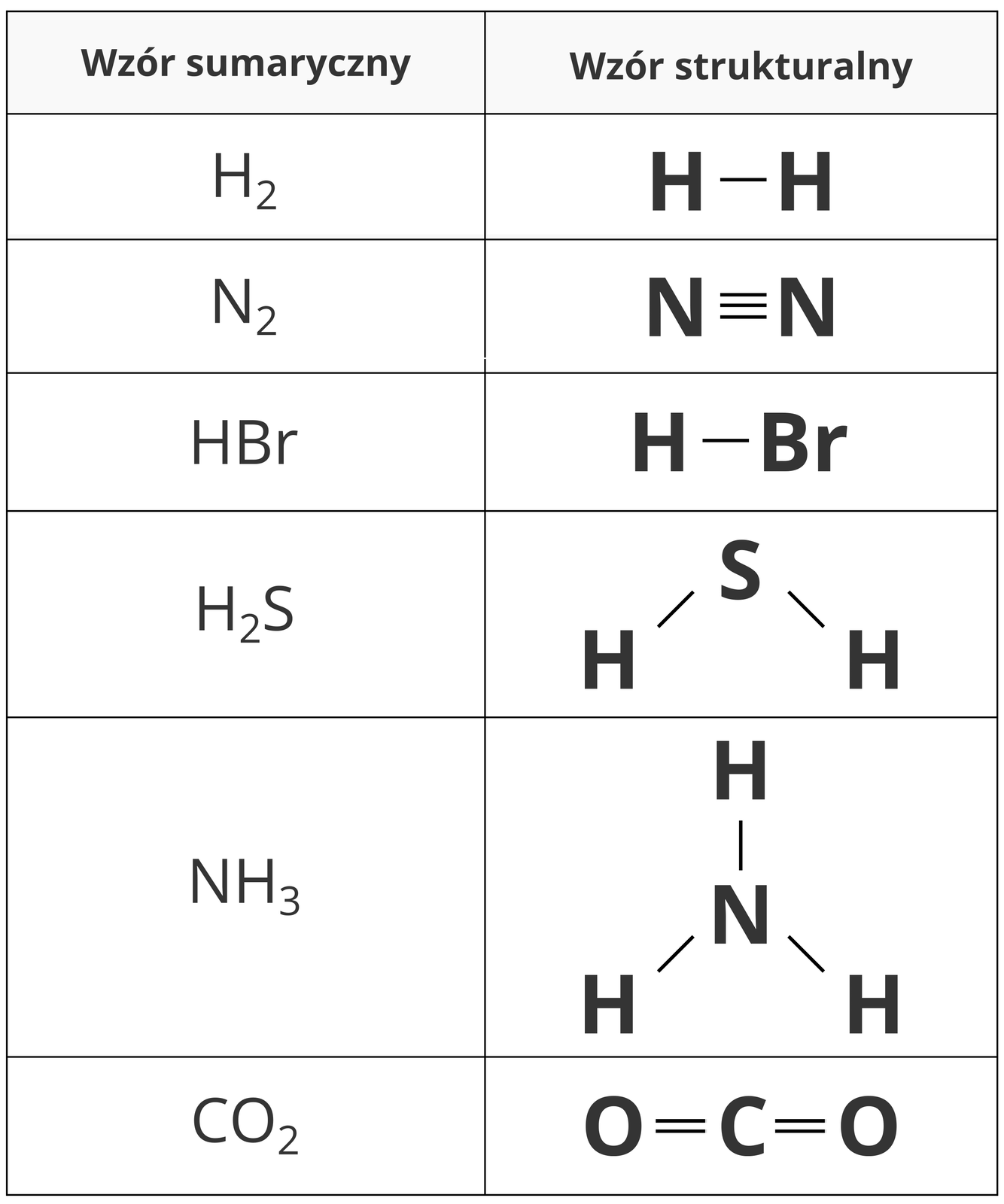
Na podstawie wzorów sumarycznychwzorów sumarycznych związków o budowie kowalencyjnej, możemy ustalić skład ich cząsteczek: liczbę i rodzaj atomów poszczególnych pierwiastków. Jednak nie jesteśmy w stanie przewidzieć, w jaki sposób atomy są ze sobą połączone. Tej informacji dostarcza inny wzór, zwany wzorem strukturalnymwzorem strukturalnym. Odzwierciedla on uproszczony sposób i kolejność połączenia atomów w cząsteczce.
We wzorze strukturalnym, podobnie jak we wzorze sumarycznym, posługujemy się symbolami pierwiastków do oznaczenia atomów tworzących cząsteczkę związku chemicznego. Za pomocą kresek przedstawiamy wiązania pomiędzy atomami (jedna kreska symbolizuje jedno wiązanie).
Przykładowo, cząsteczka wody o wzorze sumarycznym , ma następujący wzór strukturalny:
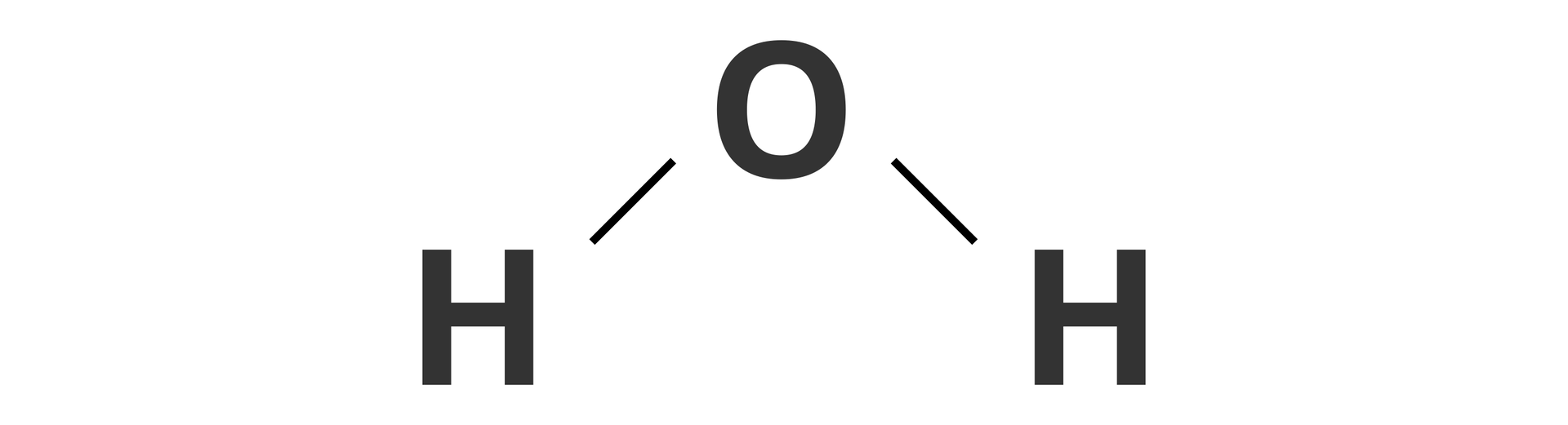
Na jego podstawie możemy stwierdzić, że w cząsteczce wody każdy atom wodoru jest połączony z atomem tlenu wiązaniem pojedynczym oraz że atomy wodoru nie są ze sobą bezpośrednio związane. Wzór strukturalny nie określa, jak poszczególne atomy są ułożone w przestrzeni.
W poniższej tabeli zestawiono wzory sumaryczne i strukturalne cząsteczek wybranych substancji o budowie kowalencyjnej.
Czy można opisywać budowę związków jonowych za pomocą wzorów strukturalnych?
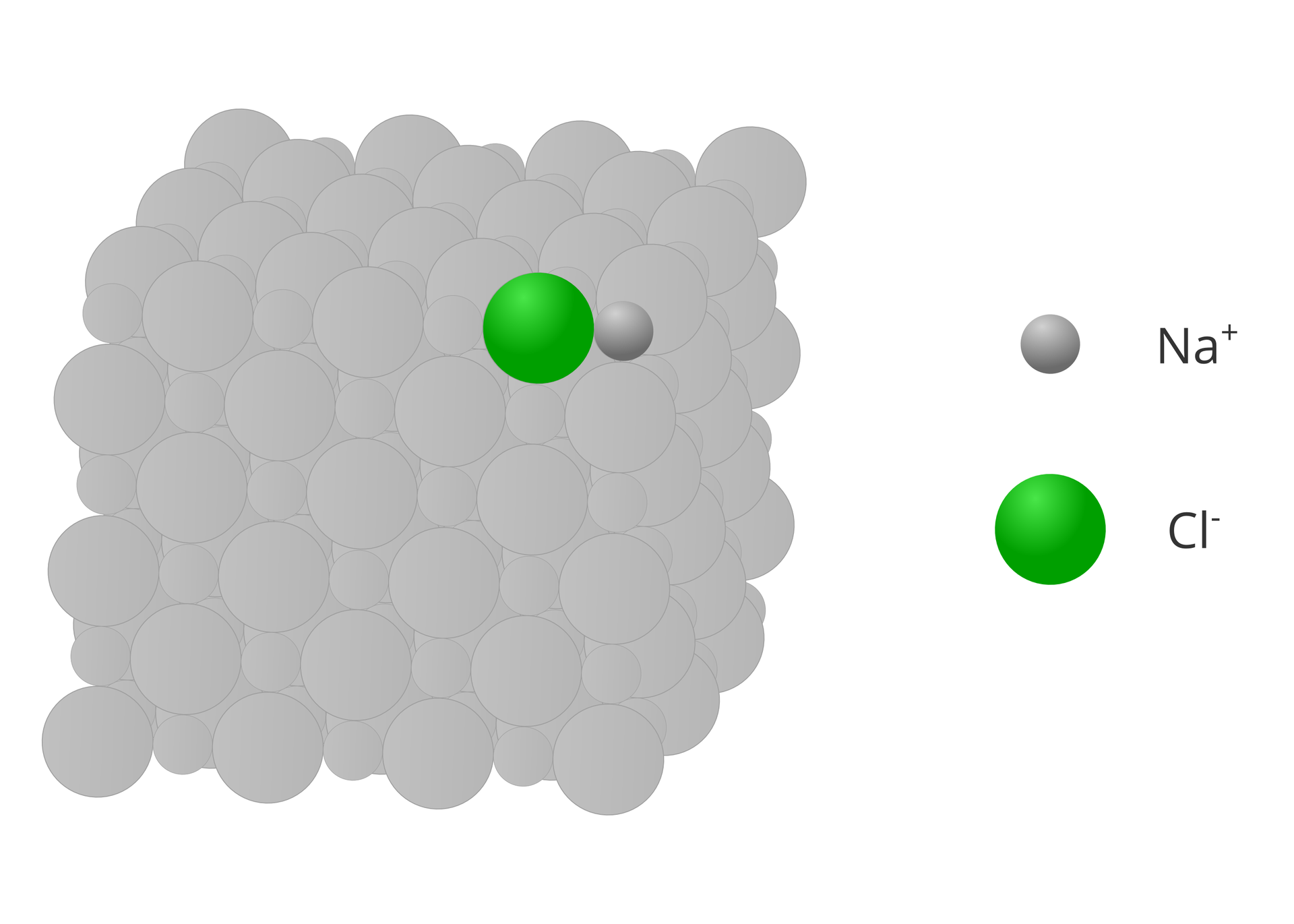
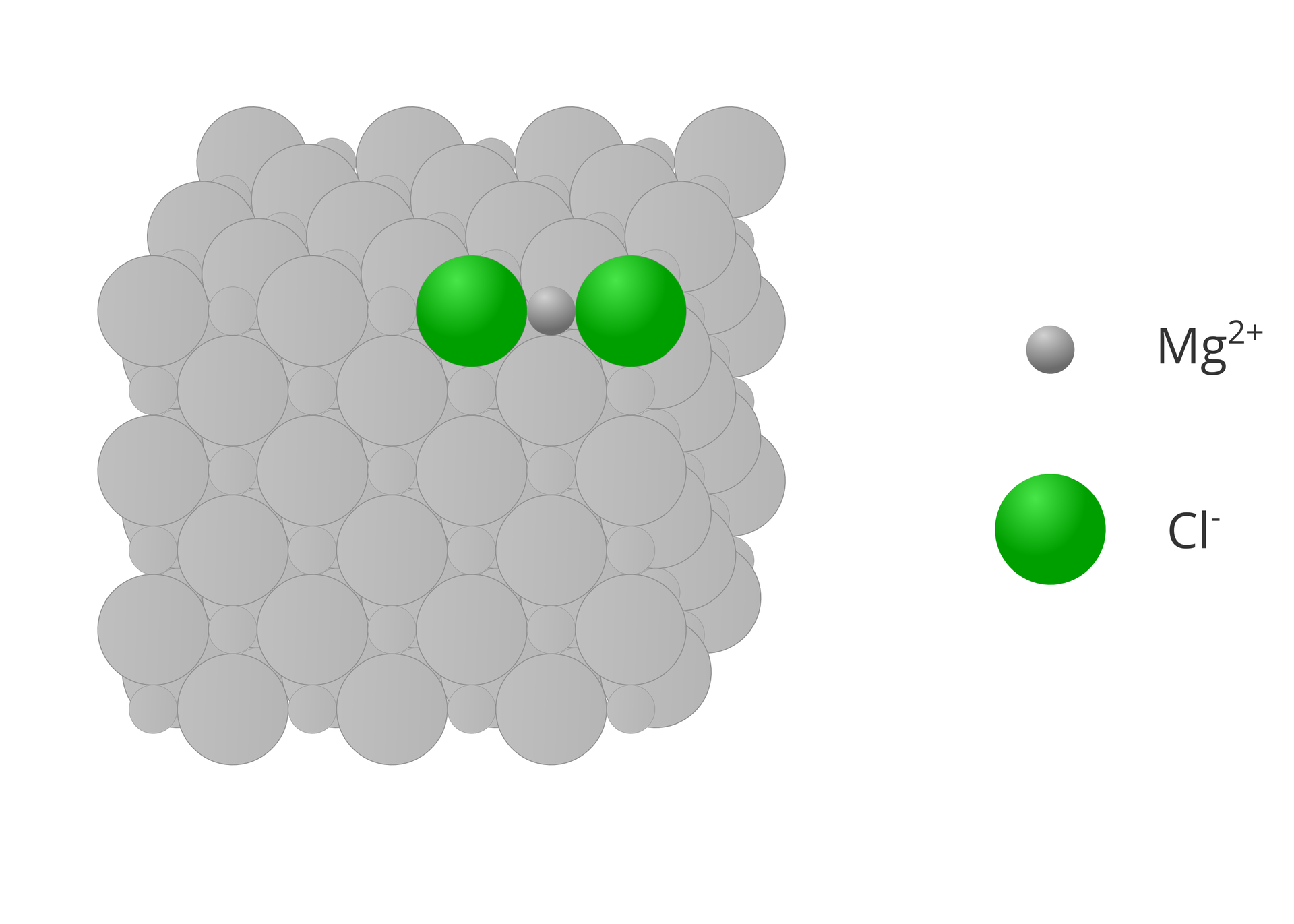
Wzory strukturalne rysujemy aby opisać budowę cząsteczek związków chemicznych. Związki o budowie jonowej nie tworzą cząsteczek, ale kryształy. Dlatego też, związków o budowie jonowej nie opisujemy za pomocą wzorów strukturalnych.
Co to jest wartościowość?
Liczbę wiązań, które tworzy atom danego pierwiastka chemicznego, łącząc się z innymi atomami, nazywa się wartościowościąwartościowością. Przy jej opisywaniu posługujemy się cyframi rzymskimi.
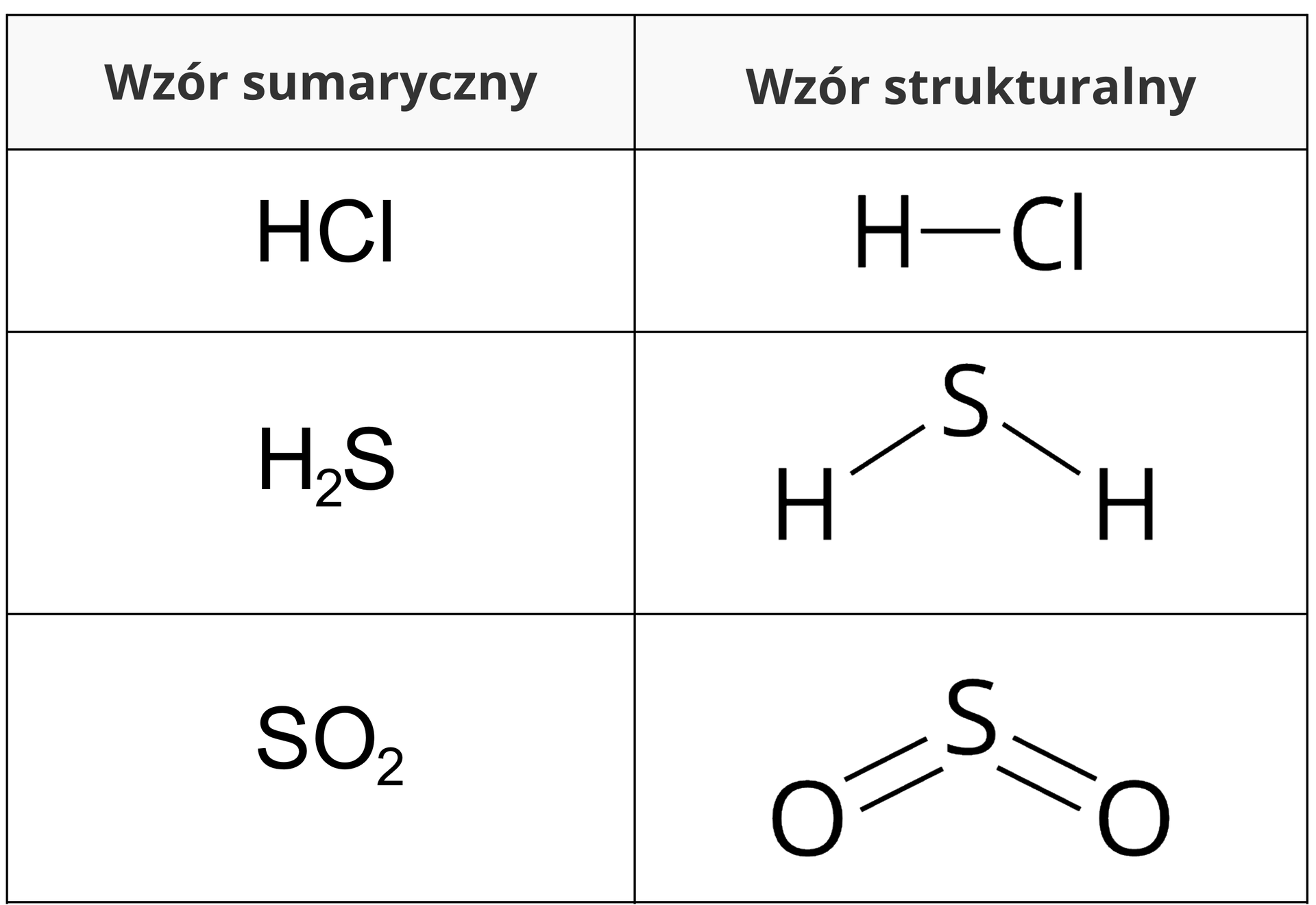
Wartościowość atomów pierwiastków, które tworzą związek o budowie kowalencyjnej, możemy łatwo określić na podstawie wzoru strukturalnego cząsteczki. Na poniższych grafikach zobrazowano wyznaczanie wartościowości atomów pierwiastków wchodzących w skład związków chemicznych o wzorach sumarycznych: (amoniak) oraz (tlenek węgla()).


W poniższej tabeli znajdują się wzory sumaryczne trzech związków chemicznych o budowie kowalencyjnej oraz odpowiadające im wzory strukturalne ich cząsteczek. Na podstawie zamieszczonych wzorów strukturalnych, określ wartościowość atomów wszystkich pierwiastków chemicznych wchodzących w skład każdej z rozpatrywanych cząsteczek.
Jak określamy wartościowość w związkach jonowych?
Choć pojęcie wartościowości zdefiniowane jest dla związków chemicznych o budowie kowalencyjnej, to w dużym uproszczeniu, pewne związane z nią założenia, wykorzystujemy też dla związków o budowie jonowej. W tym przypadku wartościowość danego jonu jest równa liczbowo jego ładunkowi, który występuje w krysztale związku. Przy określaniu wartościowości jonów pomijamy znaki dodatnie i ujemne.
Czy atomy pierwiastków mogą mieć dowolną wartościowość?
Istnieją pierwiastki, których atomy w większości tworzonych przez nie związków chemicznych mają stałą wartościowość. Na przykład sód czy wodór zawsze mają wartościowość równą jeden (). Istnieją również i takie pierwiastki, których atomy lub jony – w zależności od rodzaju związku chemicznego – mogą wykazywać różną wartościowość. I tak węgiel w związku o wzorze sumarycznym przyjmuje wartościowość równą dwa (), a w dwutlenku węgla o wzorze sumarycznym jego wartościowość wynosi cztery ().
Pewną pomoc w przewidywaniu wartościowości niektórych pierwiastków w związkach z wodorem oraz ich maksymalną wartościowość w związkach z tlenem, stanowi układ okresowy.
Może on stanowić pewną pomoc w przewidywaniu maksymalnej wartościowości atomów niektórych pierwiastków w związkach z wodorem lub tlenem.
Numer grupy | Maksymalna wartościowość pierwiastków względem tlenu |
|---|---|
Numer grupy | Maksymalna wartościowość pierwiastków względem tlenu |
|---|---|
Na podstawie danych zawartych w tabelach, można stwierdzić, że atomy pierwiastków należących do grup: , , i mają jednakowe najwyższe wartościowości w związkach zarówno z tlenem, jak i wodorem. Pierwiastki należące do pozostałych grup układu okresowego wykazują różną wartościowość w związkach chemicznych z tlenem i wodorem.
Atomy (jony) pierwiastków należących do grupy układu okresowego, we wszystkich związkach chemicznych, mają wartościowość równą jeden (). Z kolei atomy (jony) pierwiastków należących do grupy układu okresowego, we wszystkich związkach chemicznych, wykazują wartościowość równą dwa ().
Maksymalna wartościowość atomów poszczególnych pierwiastków chemicznych (znajdujących się w grupach i oraz układu okresowego) w związkach z tlenem równa jest liczbie elektronów walencyjnych w atomach tych pierwiastków. Przykładowo, krzem położony jest w grupie układu okresowego. Możemy z tego wnioskować, że atom krzemu ma cztery elektrony walencyjne, a więc jego maksymalna wartościowość w związkach z tlenem będzie równa cztery (). Wyjątek stanowi należący do grupy układu okresowego fluor, który we wszystkich związkach chemicznych ma wartościowość równą jeden (), choć jego atomy mają jednocześnie po siedem elektronów walencyjnych.
Większość pierwiastków należących do grup układu okresowego to niemetale. Aby osiągnąć trwałą energetycznie konfigurację najbliższego gazu szlachetnego (helowca), podczas tworzenia związków chemicznych z wodorem ich atomy muszą uwspólnić odpowiednią liczbę elektronów.
Przykładowo azot należy do grupy układu okresowego, w związku z czym jego atom ma pięć elektronów walencyjnych. Do osiągnięcia trwałej energetycznie konfiguracji atomu neonu brakuje mu zatem jeszcze trzech – stąd wartościowość azotu w związku z wodorem będzie równa trzy ().
Z kolei siarka znajduje się w grupie układu okresowego. Jej atom ma sześć elektronów walencyjnych, więc do osiągnięcia trwałej energetycznie konfiguracji atomu argonu brakuje jej jeszcze dwóch, dlatego wartościowość siarki w związku z wodorem będzie równa dwa ().
Tlen w związkach chemicznych jest zawsze dwuwartościowy (ma wartościowość równą ). Fluor (jak już wspomniano) jest zawsze jednowartościowy (ma wartościowość równą ), a glin trójwartościowy (ma wartościowość równą ).
Określ wartościowość pierwiastków wymienionych w poniższej tabeli wobec wodoru i tlenu. W drugiej kolumnie zapisz maksymalną wartościowość, jaką dany pierwiastek przyjmuje w związkach chemicznych z tlenem.
Określ wartościowość pierwiastków wymienionych w poniższej tabeli wobec wodoru i tlenu. W drugiej kolumnie zapisz maksymalną wartościowość, jaką dany pierwiastek przyjmuje w związkach chemicznych z tlenem.
Czy można określić wzór sumaryczny związku chemicznego na podstawie wartościowości atomów tworzących go pierwiastków?
Jeśli znamy wartościowość atomów dwóch pierwiastków, które razem tworzą związek chemiczny, to praktycznie w każdym przypadku jesteśmy w stanie określić jego wzór sumaryczny. Nie musimy przy tym wiedzieć, jaki rodzaj wiązań występuje w związku (czy są to wiązania kowalencyjne czy jonowe). W wielu przypadkach otrzymany wzór sumaryczny jest zgodny z rzeczywistością i dobrze opisuje skład cząsteczki lub najmniejszy zbiór powtarzających się jonów w związku o budowie jonowej.
Ustalenie kolejności symboli we wzorze sumarycznym może stanowić pewien problem. Jeśli analizowany związek utworzony jest przez metal i niemetal, to we wzorze sumarycznym jako pierwszy piszemy symbol metalu, a następnie z jego prawej strony wstawiamy symbol drugiego pierwiastka.
Jeden z prostszych sposobów określania wzorów sumarycznych związków chemicznych, na podstawie znajomości wartościowości tworzących go pierwiastków, poznamy na przykładach.
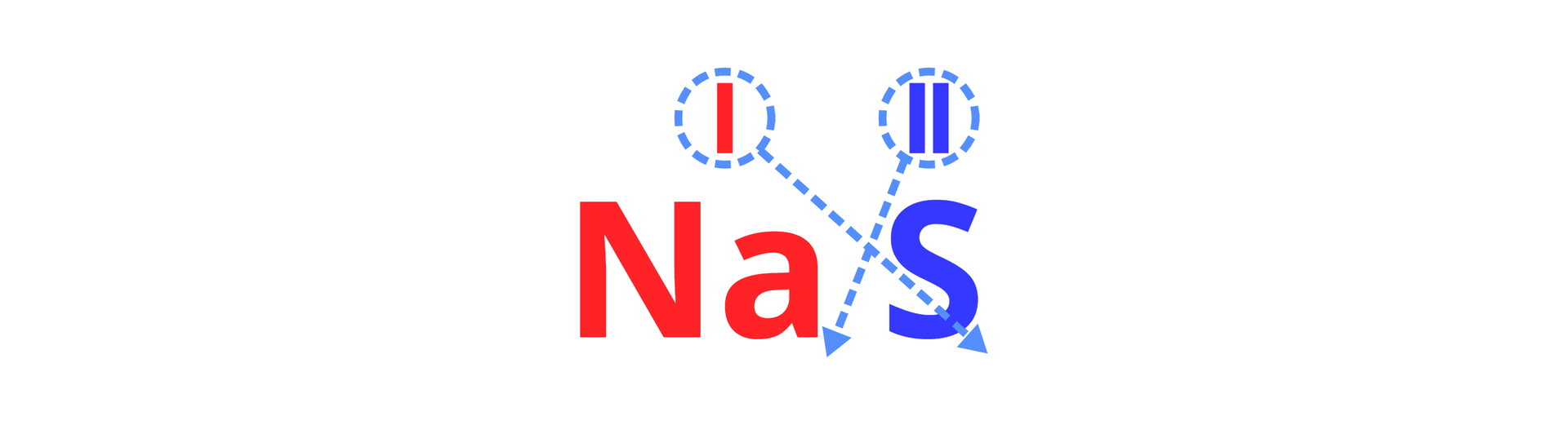
Wyznaczanie wzoru sumarycznego związku chemicznego, który składa się z jonów sodu o wartościowości jeden () i jonów siarki o wartościowości równej dwa ().
Zapisywanie wartościowości pierwiastków
Wartościowość pierwiastków możemy opisywać słownie, np. „atom węgla ma wartościowość równą cztery” lub „węgiel jest czterowartościowy”. Innym sposobem jest użycie chemicznych skrótów. Przy symbolu pierwiastka, w nawiasie, zapisuje się jego wartościowość, np. węgiel o wartościowości cztery to „” lub
„węgiel()”. Trzeba pamiętać, że między symbolem lub nazwą pierwiastka a nawiasem, nie powinno być odstępu (spacji).
Wyznaczanie wzoru sumarycznego związku chemicznego, który składa się z chromu() i tlenu().
W przykładach i rozpatrzyliśmy wzory sumaryczne dwupierwiastkowych związków chemicznych, utworzonych z metalu i niemetalu. W identyczny sposób, znając wartościowość odpowiednich pierwiastków, można ustalić wzory sumaryczne dwupierwiastkowych związków chemicznych dwóch niemetali.
Wyznacz wzory sumaryczne dwupierwiastkowych związków chemicznych utworzonych z pierwiastków o podanych wartościowościach. Uzupełnij poniższą tabelę. Symbole pierwiastków chemicznych we wzorach sumarycznych zapisz w takiej kolejności, w jakiej występują one w poszczególnych rubrykach tabeli.
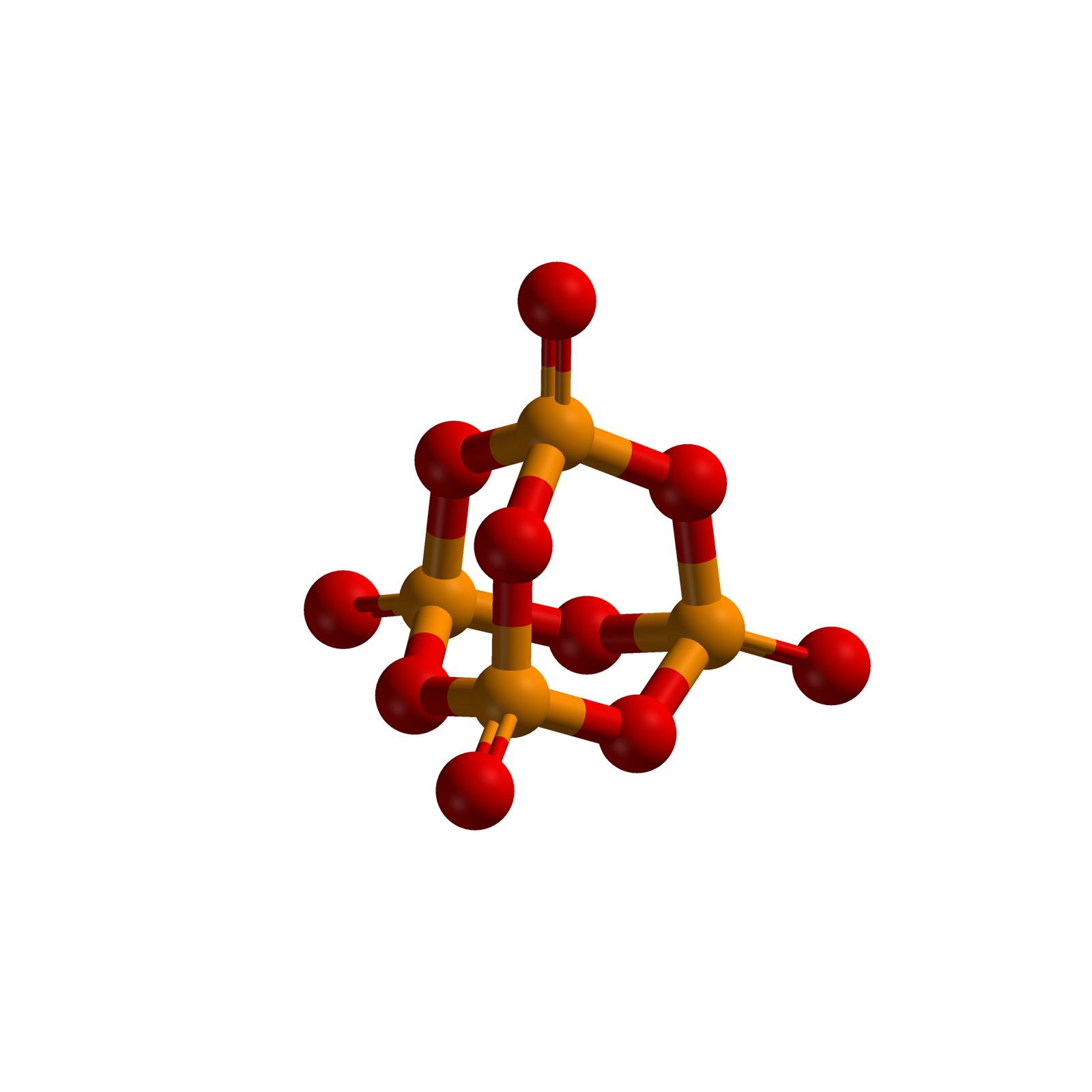
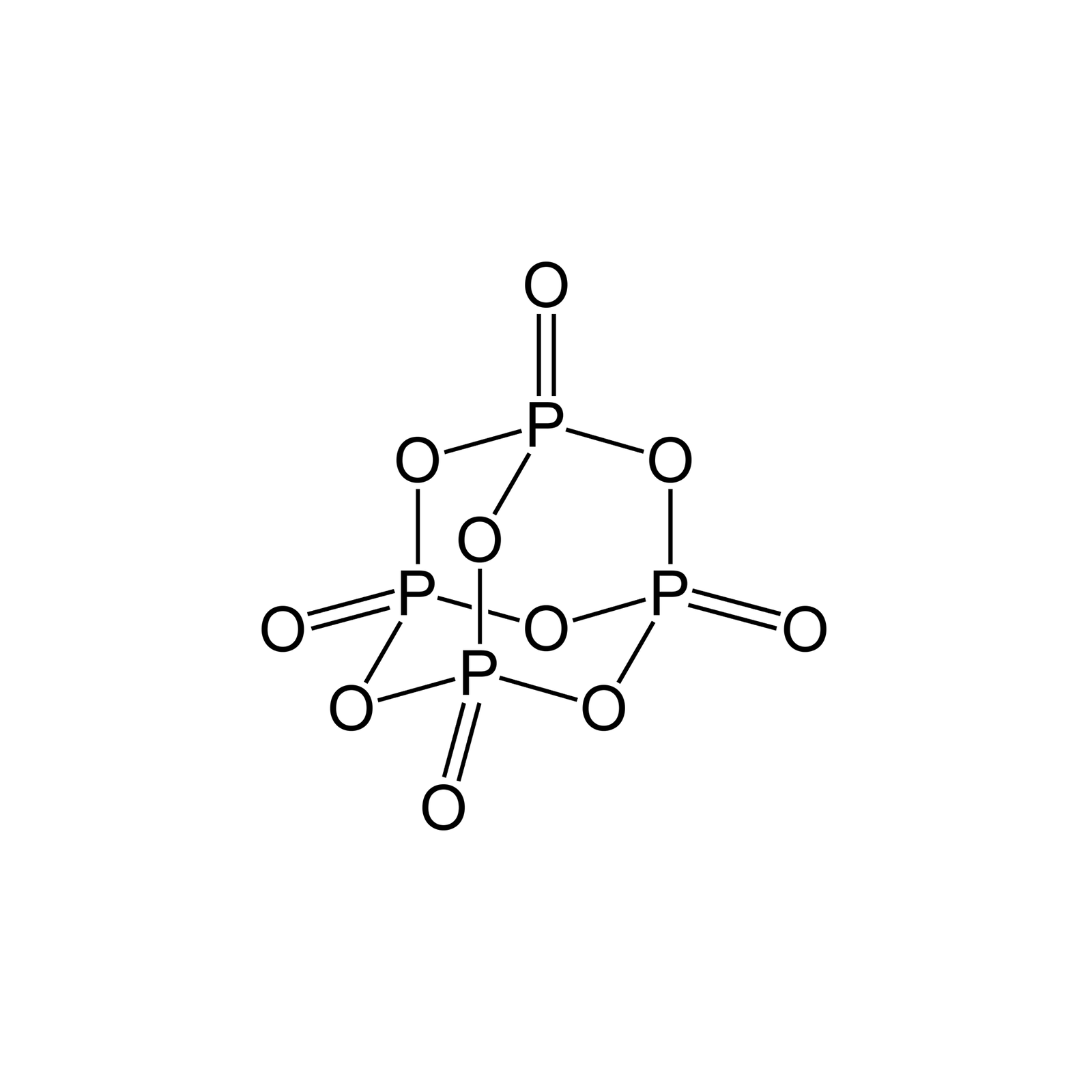
Połączenie fosforu() z tlenem()
Gdybyśmy chcieli zapisać wzór sumaryczny związku fosforu() i tlenu() zgodnie z poznanymi zasadami, to otrzymalibyśmy następujący zapis: . Mimo to, w praktyce zapisujemy: . Dlaczego? Badania wykazały, że cząsteczka tego związku składa się z czterech atomów fosforu i dziesięciu atomów tlenu. Wzór nie odzwierciedla tego faktu. Zapis jest tzw. wzorem rzeczywistymwzorem rzeczywistym cząsteczki, a wzór tzw. wzorem empirycznymwzorem empirycznym.
W jaki sposób ustalamy wartościowość jednego z pierwiastków w związku dwupierwiastkowym?
W związkach dwupierwiastkowych (utworzonych przez dwa pierwiastki) można określić wartościowość jednego pierwiastka, jeśli zna się wartościowość drugiego. Warto więc pamiętać, że – jak już wspomniano – niektóre pierwiastki chemiczne (np. te należące do i grupy układu okresowego oraz tlen i fluor) mają taką samą wartościowość we wszystkich związkach chemicznych. Podobnie chlor w chlorkach ma zawsze wartościowość równą jeden () (tak samo jak brom w bromkach i jod w jodkach), a siarka w siarczkach jest dwuwartościowa.
Jeśli we wzorze sumarycznym związku nie występują żadne indeksy stechiometryczne (lub w rzadkich przypadkach są sobie równe), to pierwiastki tworzące dany związek chemiczny mają jednakową wartościowość.
Na przykład w związku o wzorze sumarycznym , w którym wartościowość tlenu wynosi dwa (), miedź ma identyczną wartościowość (równą ). Podobnie sytuacja ma miejsce w chlorku sodu o wzorze sumarycznym – sód i chlor mają taką samą wartościowość, równą jeden ().
W niektórych przypadkach, aby określić wartościowość drugiego z pierwiastków tworzących związek chemiczny, należy dokonać odpowiednich przekształceń i obliczeń. Najprostszy ze sposobów zostanie przedstawiony na poniższym przykładzie.
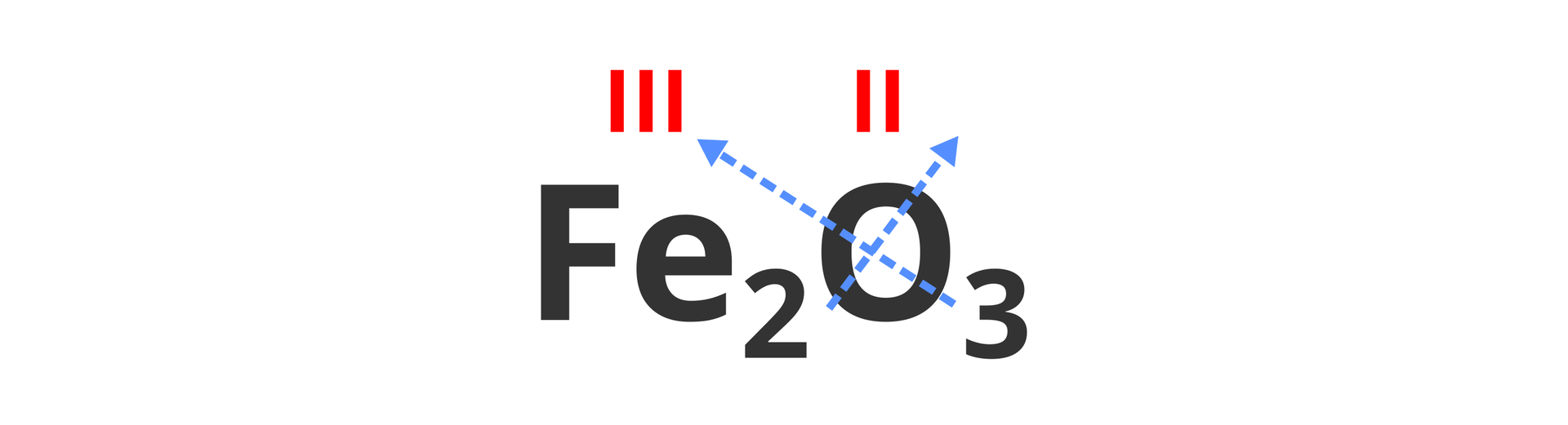
Wyznaczanie wartościowości żelaza w związku chemicznym o wzorze , w którym wartościowość chloru wynosi jeden ().
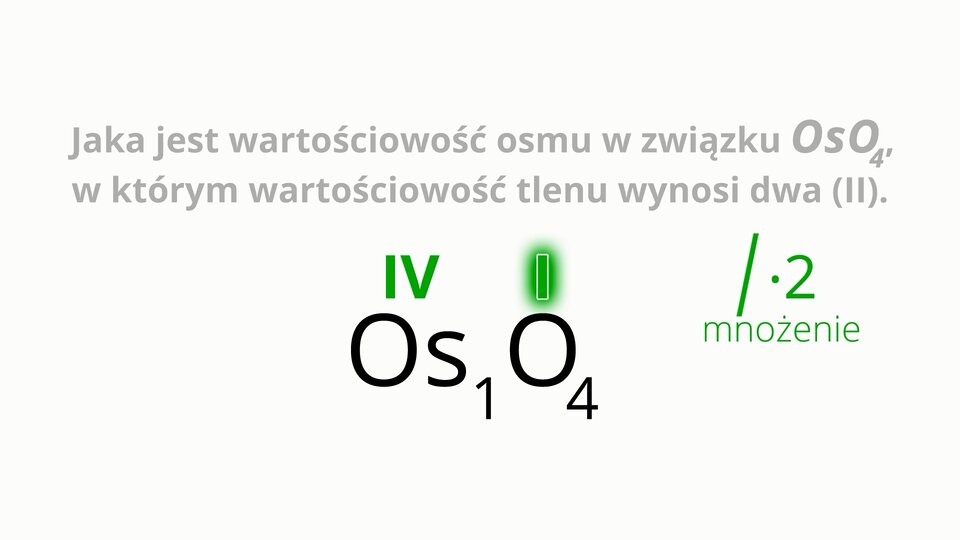
Wyznaczanie wartościowości osmu w związku chemicznym o wzorze , w którym wartościowość tlenu wynosi dwa ().
W poniższej animacji wyjaśniono, w jaki sposób można wyznaczyć wartościowość osmu w związku chemicznym o wzorze . Zapoznaj się z animacją. Przedstawiony w niej tok postępowania zapisz w zeszycie.
Film dostępny pod adresem /preview/resource/R1PbLgEUYT9ss
Animacja przedstawia w jaki sposób wyznaczyć wartościowość osmu w jego związku z tlenem.
W jaki sposób tworzymy nazwy tlenków na podstawie ich wzorów sumarycznych?
Związki tlenu z innymi pierwiastkami są nazywane tlenkami. Jednym z wyjątków jest związek tlenu z fluorem (o wzorze sumarycznym ), zwany difluorkiem tlenu. We wszystkich tlenkach tlen ma wartościowość równą dwa (). Na tej podstawie, znając wzór tlenku, możemy określać wartościowość pierwiastków związanych z tlenem w tlenkach.
Nazwy tlenków są dwuczłonowe. Pierwszy człon to wyraz „tlenek”, a drugim jest nazwa pierwiastka w dopełniaczu, np. „tlenek sodu”. Wiele pierwiastków tworzy po kilka tlenków, w których ich wartościowość jest różna. Przykładem są związki ołowiu z tlenem o wzorach sumarycznych: .
W pierwszym tlenku ołów ma wartościowość cztery (), w drugim zaś dwa (). Dlatego, aby jednoznacznie określić rodzaj związku, np. tlenku, w jego nazwie podaje się często wartościowość pierwiastka połączonego z tlenem. Wymienione powyżej związki ołowiu z tlenem to odpowiednio: tlenek ołowiu() i tlenek ołowiu(). W ich nazwach nie określa się wartościowości tlenu, ponieważ ona zawsze wynosi dwa ().
Przeanalizuj wzory sumaryczne oraz nazwy tlenków zawartych w poniższej tabeli.
Wzór sumaryczny związku | Wartościowość tlenu w tlenku | Wartościowość pierwiastka w tlenku | Nazwa tlenku |
|---|---|---|---|
tlen() | węgiel() | tlenek węgla() | |
węgiel() | tlenek węgla() | ||
siarka() | tlenek | ||
siarka() | tlenek | ||
ołów() | tlenek ołowiu() | ||
ołów() | tlenek ołowiu() | ||
srebro() | tlenek srebra() | ||
miedź() | tlenek miedzi() | ||
mangan() | tlenek | ||
chlor() | tlenek chloru() |
Zwróć uwagę, że w nazwach tlenków, pomiędzy nazwą pierwiastka a zapisaną w nawiasie wartościowością, nie ma przerwy (spacji).
Tworząc nazwy tlenków metali należących do grup i , nie podaje się ich wartościowości, ponieważ – jak już wspomniano – pierwiastki te mają w związkach chemicznych zawsze tylko jedną charakterystyczną wartościowość: metale grupy – jeden (), a metale grupy – dwa (). Podobna zasada dotyczy między innymi glinu i cynku. Z uwagi na to, że glin ma w związkach chemicznych wartościowość zawsze równą trzy (), a cynk zawsze równą dwa (), nie podaje się wartościowości tych pierwiastków w nazwie związków.
Ustalanie nazwy tlenku o wzorze sumarycznym
Uzupełnij poniższą tabelę. Napisz nazwy tlenków o podanych wzorach sumarycznych.
W jaki sposób ustalamy wzory sumaryczne na podstawie nazwy?
Na podstawie pełnej nazwy tlenku, w łatwy sposób można napisać jego wzór sumaryczny. Pamiętajmy, że wartościowość tlenu w tych związkach jest równa
dwa (). Wartościowość drugiego pierwiastka trzeba znać bądź jest ona podana w nazwie tlenku. Jeśli tam nie podano wartościowości drugiego z tworzących tlenek pierwiastków, to odczytujemy ją z układu okresowego. Zatem jeśli pierwiastek należy do grupy układu okresowego, to jego wartościowość będzie równa jeden (), jeśli zaś jest to pierwiastek położony w grupie, to będzie miał wartościowość dwa ().
Przeanalizuj poniższe przykłady:
Zapisywanie wzoru sumarycznego tlenku baru
Zapisywanie wzoru sumarycznego tlenku azotu().
W jaki sposób rysujemy wzory strukturalne związków o budowie kowalencyjnej na podstawie znajomości wartościowości pierwiastków?
Ustalenie wzoru strukturalnego cząsteczki związku na podstawie jego wzoru sumarycznego nie zawsze jest możliwe. Bez wiedzy na temat istniejących połączeń pomiędzy poszczególnymi atomami nie narysujemy wzoru cząsteczki związku składającego się z atomów trzech pierwiastków, jak np substancji o wzorze sumarycznym . W przypadku związków dwupierwiastkowych jest to możliwe, jeśli zna się wartościowość atomów obu pierwiastków.
W poniższej animacji wyjaśniono, w jaki sposób można narysować wzór strukturalny dwupierwiastkowego związku chemicznego azotu z wodorem o budowie kowalencyjnej. Zapoznaj się z animacją. Przedstawiony w niej tok postępowania zapisz w zeszycie.

Film dostępny pod adresem /preview/resource/R1bIz27e4dkHX
Animacja przedstawia, w jaki sposób narysować wzór strukturalny związku azotu z wodorem.
Usystematyzuj swoją wiedzę wykonując ćwiczenia.
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
16., III, V, 14., tlenkami, VI, 17., VII, VIII, 13., I, 13., II, 2., 13., 1., 17., zawsze mają, metalikami, 16., 15., 1., 14., 14., 2., wodorkami, 17., 16., IV, 15., 15., mogą mieć
Pierwiastki ........................ jednakową wartościowość we wszystkich związkach. Pierwiastki należące do grupy 1. układu okresowego mają we wszystkich związkach wartościowość ......................... Wartościowość równą dwa jest charakterystyczna dla pierwiastków ........................ grupy układu okresowego. Związki metali z tlenem nazywa się ......................... W nazwie tlenku nie podaje się wartościowości pierwiastków grupy ........................ i .........................
Uzupełnij luki w tekście. Wybierz właściwe określenie spośród podanych.
można, nie można, wszystkich, jonowej, cząsteczkowej, tylko cząsteczkowych, tylko jonowych
Wzór sumaryczny można zapisać dla .......................................... związków. Wzoru strukturalnego nie można przedstawić dla związków o budowie ........................................... Na podstawie wzoru strukturalnego .......................................... określić wartościowość atomów tworzących cząsteczkę.
Połącz wzory tlenków z ich nazwami.
<span aria-label="Mn indeks dolny, 2, O indeks dolny, 7" role="math"><math><mrow><msub><mtext>Mn</mtext><mtext>2</mtext></msub><msub><mtext>O</mtext><mtext>7</mtext></msub></mrow></math></span>, <span aria-label="PbO" role="math"><math><mrow><mi>PbO</mi></mrow></math></span>, <span aria-label="SO indeks dolny, trzy" role="math"><math><mrow><msub><mi>SO</mi><mn>3</mn></msub></mrow></math></span>, <span aria-label="MnO indeks dolny, dwa" role="math"><math><mrow><msub><mi>MnO</mi><mn>2</mn></msub></mrow></math></span>, <span aria-label="PbO indeks dolny, dwa" role="math"><math><mrow><msub><mi>PbO</mi><mn>2</mn></msub></mrow></math></span>
| tlenek ołowiu(II) | |
| tlenek ołowiu(IV) | |
| tlenek manganu(IV) | |
| tlenek manganu(VII) | |
| tlenek siarki(VI) |
Wskaż nazwę związku o wzorze .
- tlenek rtęci(II)
- tlenek rtęci(I)
- tlenek rtęci(IV)
- tlenek wodoru
- tlenek magnezu
- tlenek helu
Podsumowanie
Wartościowość jest cechą pierwiastków tworzących związki chemiczne; jest to w uproszczeniu liczba wiązań, które tworzy atom danego pierwiastka, łącząc się z innymi atomami. Opisuje się ją przy użyciu cyfr rzymskich.
Wartościowość pierwiastka w związkach kowalencyjnych jest równa liczbie wiązań, które tworzą w cząsteczkach jego atomy z innymi.
Wartościowość pierwiastka w związkach jonowych jest równa wartości bezwzględnej ładunków jego jonów.
Na podstawie układu okresowego można określić wartościowość względem wodoru i maksymalną wartościowość względem tlenu dla pierwiastków z grup i oraz , , , i
Pierwiastki znajdujące się w grupie układu okresowego, w tworzonych związkach chemicznych mają zawsze wartościowość równą jeden, a te znajdujące się w grupie, mają wartościowość dwa.
Tlen w tlenkach ma wartościowość dwa. Na podstawie tej informacji i wzoru sumarycznego związku (tlenku), można określić wartościowość drugiego pierwiastka w połączeniach z tlenem.
W nazwach tlenków podaje się wartościowość pierwiastka, który w związkach chemicznych może mieć różną wartościowość.
Słownik
liczba wiązań, które tworzy atom danego pierwiastka chemicznego, łącząc się z innymi atomami
(teoretyczny) wzór sumaryczny, który (podobnie jak wzór rzeczywisty) ukazuje rodzaj obecnych w związku atomów (lub jonów) oraz najprostszy ich stosunek liczbowy; często zdarza się, że wzór empiryczny danego związku chemicznego jest taki sam jak jego wzór rzeczywisty
wzór sumaryczny, który ukazuje faktyczną (rzeczywistą) liczbę atomów (lub jonów) w analizowanym związku chemicznym
wzór, który odzwierciedla sposób połączenia atomów w cząsteczce; na jego podstawie można określić liczbę, rodzaj atomów oraz ich wartościowość
wzór ukazujący liczbę i rodzaj atomów tworzących dany związek chemiczny