Jakie substancje zaliczamy do metali, a jakie do niemetali?
Substancje proste (pierwiastki chemiczne) dzielimy na dwie grupy: na metale i niemetale. Czy zastanawiało Cię kiedyś, dlaczego druga z wymienionych grup nosi nazwę „niemetale”? Skąd wziął się ten przedrostek w nazwie? Przeanalizuj poniższy materiał i spróbuj samodzielnie odpowiedzieć na te pytania.
Metale
Wyniki badań wskazują na to, że metale trafiły na naszą planetę przypadkowo, jako część składowa asteroidów, które w nią uderzały. W trakcie powstawania Ziemi, płynne żelazo oraz inne substancje o dużej gęstości – w tym metale, takie jak nikiel, złoto i platyna – przemieszczały się w stronę środka planety, formując jej jądro. Jądro Ziemi zawiera prawdopodobnie tyle metali, że wystarczyłoby ich na pokrycie całej powierzchni Ziemi warstwą o grubości czterech metrów.
Metale są wykorzystywane przez człowieka od wieków.
W przyrodzie, w stanie wolnym (niezwiązanym z innymi pierwiastkami) występują jedynie nieliczne z metali. Należą do nich m.in.: srebro, złoto, miedź, platyna. Większość metali występuje w przyrodzie zwykle w postaci tak zwanych rud (w uproszczeniu, w postaci związków chemicznych z innymi pierwiastkami). Czyste metale można pozyskać, poddając odpowiednie rudy określonym procesom metalurgicznym.
W poniższej galerii zamieszczono zdjęcia wybranych rud niektórych metali.
Galeria: Rudy wybranych metali
W poniższej galerii znajdują się zdjęcia wybranych metali. Obejrzyj je i napisz, jakie właściwości fizyczne metali możemy określić na ich podstawie. Następnie zastanów się, czy wszystkie zapisane przez Ciebie właściwości fizyczne są takie same dla każdego z analizowanych metali.
Wybrane właściwości fizykochemiczne metali i niemetali
Przeprowadź eksperyment w wirtualnym laboratorium i sprawdź, jakie właściwości fizykochemiczne posiadają badane w nim pierwiastki chemiczne. Zidentyfikuj, które z nich to metale, a które należą do niemetali. Porównaj właściwości niemetali z właściwościami znajdujących się w wirtualnym laboratorium metali. Na podstawie przeprowadzonych prób oceń, czy możemy wskazać zestaw właściwości fizykochemicznych wspólnych dla wszystkich niemetali. W czasie przeprowadzania eksperymentów uzupełnij dziennik laboratoryjny, a następnie polecenia i ćwiczenia zamieszczone pod laboratorium.
Wykorzystując wirtualne laboratorium, przeprowadź doświadczenie mające na celu sprawdzenie właściwości fizykochemicznych wybranych metali i niemetali, a następnie uzupełnij dziennik laboratoryjny.
Uwaga! Grafit jest odmianą alotropowąalotropową węgla, z kolei fosfor czerwony to odmiana alotropowa fosforu.
Uczeń badał w laboratorium chemicznym następujące substancje: siarkę, węgiel (grafit), fosfor czerwony, miedź, wodór oraz magnez.
W poniższym materiale filmowym przeprowadzono doświadczenie, które pozwoliło na zbadanie pewnych właściwości fizykochemicznych trzech metali: sodu, potasu oraz wapnia. Zapoznaj się z tym materiałem i, na podstawie zawartych w nim informacji, oceń poprawność poniższych stwierdzeń.

Film dostępny pod adresem /preview/resource/R1XCbR3JpAeAE
Na filmie przeprowadzono doświadczenie pozwalające na zbadanie zachowania trzech metali: sodu, potasu oraz wapnia w kontakcie z wodą.
2. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12.
3. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12.
Badanie wykonane w wirtualnym laboratorium pokazało, że miedź i magnez wykazują 4 wpólne cechy - posiadają metaliczny połysk, są kowalne, przewodzą prąd elektryczy oraz przewodzą ciepło.
Na podstawie tych właściwości fizycznych – dobrego przewodnictwa prądu elektrycznego i ciepła, kowalnościkowalności oraz charakterystycznego połysku – możemy zdefiniować metalemetale. Każdy bowiem posiada wszystkie te cztery cechy jednocześnie.
Czy na podstawie odpowiednich właściwości fizycznych możemy również zdefiniować grupę niemetali? A może moglibyśmy uznać, że jeśli dana substancja prosta nie posiada wszystkich czterech cech, którymi charakteryzują się metale jednocześnie, to na pewno jest ona niemetalem?

Film dostępny pod adresem /preview/resource/RgmoeGqgOUjho
Film nawiązujący do treści materiału dotyczącej metali i niemetali.
W powyższym filmie pojawiło się kilka pojęć których jeszcze możesz nie znać, takich jak np. elektroujemność, ale z pewnością poznasz ich znaczenie podczas dalszej. Póki co możesz je po prostu pominąć.
Na półce stoi ozdoba koloru srebrnego. W jaki sposób bez narzędzi sprawdzisz, czy ozdoba została wykonana z metalu, czy z tworzywa sztucznego, a następnie pomalowana metaliczną farbą?
Niemetale
NiemetaleNiemetale, tak jak metale to pierwiastki chemiczne, a więc substancje proste.
Z prób przeprowadzonych w wirtualnym laboratorium można wnioskować, że niemetale charakteryzują się zróżnicowanymi właściwościami fizykochemicznymi. W poniższej galerii zamieszczono zdjęcia wybranych niemetali w warunkach normalnychwarunkach normalnych. Zapoznaj się z nimi, a następnie wykonaj polecenie zamieszczone pod galerią.
Wybrane niemetale w warunkach normalnych.
Poniżej zamieszczono materiał filmowy, który opisuje niektóre właściwości wybranych niemetali. Zapoznaj się z informacjami zawartymi w tym materiale, a następnie rozwiąż znajdujące się pod nim ćwiczenie.

Film dostępny pod adresem /preview/resource/R7ONG2h3okJLv
Na filmie zaprezentowano zdjęcia niektórych niemetali, a także opisano ich właściwości. Wybranymi niemetalami omawianymi przez lektora są: diament, grafit, siarka, fosfor biały, fosfor czerwony, jod, brom, chlor i fluor.
Niemetale w warunkach normalnych są ciałami stałymi lub gazami (wyjątkiem jest brom, będący w tych warunkach cieczą). Substancje te charakteryzują się różnym zabarwieniem i w większości nie posiadają połysku (wyjątkami są między innymi grafit i jod). Niemetale będące ciałami stałymi nie są kowalne, lecz kruche. W większości nie przewodzą prądu elektrycznego i ciepła (z wyjątkiem chociażby wspomnianego grafitu). Niemetale charakteryzują się również zróżnicowaną gęstością oraz temperaturami wrzenia i topnienia, a także palnością.
Jakie inne właściwości posiadają metale i niemetale?
W poniższej tabeli zamieszczono informacje o wybranych właściwościach fizycznych niektórych niemetali oraz metali w temperaturze pokojowej, pod ciśnieniem normalnym. Zapoznaj się z nimi, a następnie wykonaj polecenie pod tabelą
Wybrane właściwości fizykochemiczne niektórych niemetali i metali | |||||||
|---|---|---|---|---|---|---|---|
Nazwa pierwiastka | Gęstość | Temperatura wrzenia | Temperatura topnienia | Czy przewodzi prąd elektryczny? | Czy przewodzi ciepło? | Czy posiada połysk? | Czy jest kowalny? |
węgiel (grafit) | od do | (sublimacja) | (pod ciśnieniem około ) | tak | tak | tak | nie |
jod | nie | nie | tak | nie | |||
siarka | nie | nie | nie | nie | |||
chlor | nie | nie | nie | - | |||
tlen | nie | nie | nie | - | |||
azot | (w temperaturze ) | nie | nie | nie | - | ||
brom | nie | nie | nie | - | |||
miedź | tak | tak | tak | tak | |||
magnez | tak | tak | tak | tak | |||
cynk | tak | tak | tak | tak | |||
żelazo | tak | tak | tak | tak | |||
Dla porównania, gęstość wody w temperaturze pokojowej wynosi około .
W poniższym multimedium ujęto niektóre informacje dotyczące wybranych pierwiastków chemicznych. W celu określenia właściwości fizykochemicznych i zastosowań tych pierwiastków chemicznych zapoznaj się z poniższą aplikacją.
Grafika interaktywna ukazuje właściwości fizyczne i chemiczne wybranych pierwiastków chemicznych. Z prawej strony znajduje się szeroki niebieski pasek ze spisem treści. Po naciśnięciu na dany dział zmienia się grafika znajdująca się po prawej stronie. Na samej górze znajduje się poziomy niebieski pasek, na którym wyświetlana jest nazwa wybranego w danym momencie działu. Po jego obu stronach znajdują się strzałki w lewo i w prawo, które również pozwalają na przełączanie się między działami. Pierwszy dział nazwany jest: Układ okresowy pierwiastków. Po jego wybraniu pojawia się grafika przedstawiająca układ okresowy pierwiastków chemicznych. Zawiera on wszystkie znane pierwiastki chemiczne, które są ułożone według rosnącej liczby atomowej. Liczba atomowa informuje zarówno o ilości protonów wchodzących w skład danego jądra, jak i liczbie elektronów w atomie niezjonizowanym, która ma decydujący wpływ na właściwości chemiczne atomu. Ułożenie pierwiastków w układzie okresowym wynika z ich budowy wewnętrznej – z liczby powłok elektronowych danego atomu oraz liczby elektronów znajdujących się na ostatniej, zewnętrznej powłoce. Pierwiastki znajdujące się w tych samych wierszach (okresach) układu okresowego posiadają tę samą liczbę powłok elektronowych, więc są one opisane tą samą główną liczbą kwantową. Kolumny układu, czyli grupy, zawierają z reguły pierwiastki posiadające tę samą liczbę elektronów w zewnętrznej powłoce. Metale zostały oznaczone kolorem niebieskim, niemetale – kolorem żółtym, gazy szlachetne – kolorem pomarańczowym, a nieokreślone – kolorem szarym. Przy wybranych pierwiastkach znajdują się ponumerowane od jednego do dwudziestu sześciu przyciski. Pierwszym z nich jest wodór, z numerem jeden. Po naciśnięciu przycisku pojawia się biała ramka z tekstem: Wodór; jeden; wybrane właściwości fizyczne: bezbarwny gaz, gęstość osiemset dziewięćdziesiąt dziewięć dziesięciotysięcznych kilograma na metr sześcienny, temperatura topnienia minus dwieście pięćdziesiąt dziewięć stopni Celsjusza, temperatura wrzenia minus dwieście pięćdziesiąt trzy stopnie Celsjusza; wybrane właściwości chemiczne: bezwonny, palny (z tlenem tworzy mieszaninę wybuchową); piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień i czarną poziomą linię pod nim, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym butelkę; wybrane zastosowania: surowiec do syntezy amoniaku , który następnie wykorzystuje się między innymi do produkcji nawozów sztucznych (azotowych), substrat do utwardzania tłuszczów ciekłych w przemyśle spożywczym (produkcja margaryny), palniki wodorowo–tlenowe stosowane do precyzyjnego cięcia i spawania metali między innymi przez jubilerów, czynnik chłodzący stosowany między innymi do zamrażania produktów spożywczych i do chłodzenia generatorów dużej mocy (stosowanych w elektrowniach), paliwo głownie w rakietach i statkach kosmicznych, a obecnie coraz częściej w samochodach i środkach transportu publicznego (zarówno jako paliwo konwencjonalne, jak i w tak zwanych ogniwach paliwowych). Następny jest przycisk z numerem dwa, po jego naciśnięciu pojawia się biała ramka z tekstem: Węgiel; sześć; wybrane właściwości fizyczne: grafit (odmiana alotropowa węgla) – czarne, połyskujące ciało stałe; gęstość (grafit) dwa tysiące dwieście sześćdziesiąt kilogramów na metr sześcienny; temperatura topnienia trzy tysiące sześćset czterdzieści dwa stopnie Celsjusza; temperatura wrzenia cztery tysiące dwieście stopni Celsjusza; wybrane właściwości chemiczne: palny (w podwyższonej temperaturze); piktogramy ostrzegawcze: substancja nie jest klasyfikowana jako niebezpieczna według kryteriów GHS (Global Harmonised System – Globalnie Ujednolicony System Klasyfikacji i Oznakowania); wybrane zastosowania: grafit – produkcja suchych smarów i farb antykorozyjnych, grafit do ołówków, produkcja elektrod węglowych, materiał ognioodporny – produkcja ognioodpornych naczyń, tygli, cegieł; diament – wyrób biżuterii (oszlifowany diament to brylant), produkcja materiałów ściernych, produkcja noży do cięcia szkła, wierteł i ostrzy (między innymi w narzędziach chirurgicznych). Następny jest przycisk z numerem trzy, po jego naciśnięciu pojawia się biała ramka z tekstem: Azot; siedem; wybrane właściwości fizyczne: bezbarwny gaz, gęstość jeden i dwieście pięćdziesiąt jeden tysięcznych kilograma na metr sześcienny; temperatura topnienia minus dwieście dziesięć stopni Celsjusza; temperatura wrzenia minus sto dziewięćdziesiąt sześć stopni Celsjusza; wybrane właściwości chemiczne: bezwonny, niepalny, mało aktywny chemicznie; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym butelkę; wybrane zastosowania: surowiec do syntezy , który następnie wykorzystuje się między innymi do produkcji nawozów sztucznych (azotowych), zapewnienie obojętnej (ochronnej) atmosfery (na przykład jako wypełnienie opakowań produktów żywnościowych), po skropleniu stosowany między innymi do uzyskiwania niskich temperatur (poniżej minus stu stopni Celsjusza) i zamrażania żywności. Następny jest przycisk z numerem cztery, po jego naciśnięciu pojawia się biała ramka z tekstem: Tlen; osiem; wybrane właściwości fizyczne: bezbarwny gaz, gęstość jeden i czterysta dwadzieścia dziewięć kilogramów na metr sześcienny; temperatura topnienia minus dwieście osiemnaście stopni Celsjusza; temperatura wrzenia minus sto osiemdziesiąt trzy stopnie Celsjusza; wybrane właściwości chemiczne: bezwonny, podtrzymuje spalanie, ale nie jest palny; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień i czarną poziomą linię pod nim, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym butelkę; wybrane zastosowania: tlenoterapia w medycynie, składnik mieszanek do oddychania wykorzystywanych między innymi przez nurków, palniki acetylenowo–tlenowe do cięcia i spawania metali. Następny jest przycisk z numerem pięć, po jego naciśnięciu pojawia się biała ramka z tekstem: sód; jedenaście; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość dziewięćset sześćdziesiąt osiem kilogramów na metr sześcienny; temperatura topnienia dziewięćdziesiąt osiem stopni Celsjusza; temperatura wrzenia osiemset osiemdziesiąt trzy stopnie Celsjusza; wybrane właściwości chemiczne: bezwonny, bardzo aktywny chemicznie (powinien być przechowywany bez dostępu powietrza i wilgoci, na przykład pod warstwą nafty; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień i czarną poziomą linię pod nim, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym dwie probówki, z których wylewa się substancja spadająca na czarną powierzchnię oraz na dłoń; wybrane zastosowania: substrat do otrzymywania różnych związków chemicznych, lampy sodowe dające charakterystyczne żółte światło (stosowane między innymi w uprawie roślin oraz do oświetlania terenów otwartych). Następny jest przycisk z numerem sześć, po jego naciśnięciu pojawia się biała ramka z tekstem: magnez; dwanaście; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość tysiąc siedemset trzydzieści osiem kilogramów na metr sześcienny, temperatura topnienia sześćset pięćdziesiąt stopni Celsjusza, temperatura wrzenia tysiąc dziewięćdziesiąt stopni Celsjusza; wybrane właściwości chemiczne: bezwonny, palny (w tlenie spala się białym, oślepiającym płomieniem); piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień i czarną poziomą linię pod nim; wybrane zastosowania: substrat do otrzymywania szeregu związków chemicznych, ochrona stali przed korozją, składnik stopów, z których produkuje się obudowy niektórych urządzeń elektronicznych (między innymi kamer i aparatów fotograficznych). Następny jest przycisk z numerem siedem, po jego naciśnięciu pojawia się biała ramka z tekstem: glin; trzynaście; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość dwa tysiące siedemset kilogramów na metr sześcienny, temperatura topnienia sześćset sześćdziesiąt stopni Celsjusza, temperatura wrzenia dwa tysiące pięćset dziewiętnaście stopni Celsjusza; wybrane właściwości chemiczne: bezwonny, palny; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień i czarną poziomą linię pod nim; wybrane zastosowania: pakowanie żywności (folia aluminiowa), produkcja luster, otrzymywanie metali w przemyśle metalurgicznym (proces aluminotermii), składnik farb i barwników, w postaci odpowiednich stopów – produkcja drutów, rur, blach, itp. Następny jest przycisk z numerem osiem, po jego naciśnięciu pojawia się biała ramka z tekstem: krzem; czternaście; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość dwa tysiące trzysta trzydzieści kilogramów na metr sześcienny, temperatura topnienia tysiąc czterysta czternaście stopni Celsjusza, temperatura wrzenia dwa tysiące dziewięćset stopni Celsjusza; wybrane właściwości chemiczne: bezwonny, z tlenem reaguje w wysokich temperaturach; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień i czarną poziomą linię pod nim, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym wykrzyknik; wybrane zastosowania: półprzewodnik (składnik między innymi fotoogniw i tranzystorów), składnik stali (poprawiający między innymi jej sprężystość). Następny jest przycisk z numerem dziewięć, po jego naciśnięciu pojawia się biała ramka z tekstem: fosfor; piętnaście; wybrane właściwości fizyczne: fosfor czerwony (odmiana alotropowa fosforu) – czerwone, kruche ciało stałe, fosfor biały (odmiana alotropowa fosforu) – białe, lepkie, woskowate ciało stałe, gęstość tysiąc osiemset dwadzieścia trzy kilogramy na metr sześcienny, temperatura topnienia czterdzieści cztery stopni Celsjusza, temperatura wrzenia dwieście osiemdziesiąt jeden stopni Celsjusza; wybrane właściwości chemiczne: bezwonny, fosfor czerwony ulega samozapłonowi w temperaturze od dwustu sześćdziesięciu do czterystu stopni Celsjusza, fosfor biały w postaci zbitej próbki ulega samozapłonowi w temperaturze od dwudziestu pięciu do sześćdziesięciu stopni Celsjusza, a w postaci proszku – natychmiast, w związku z powyższym należy go przechowywać pod warstwą wody; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień i czarną poziomą linię pod nim; wybrane zastosowania: składnik draski na pudełkach od zapałek (fosfor czerwony), surowiec do syntezy szeregu związków chemicznych (w tym nawozów sztucznych), produkcja bomb zapalnych (fosfor biały). Następny jest przycisk z numerem dziesięć, po jego naciśnięciu pojawia się biała ramka z tekstem: siarka; szesnaście; wybrane właściwości fizyczne: żółte ciało stałe, gęstość tysiąc dziewięćset sześćdziesiąt kilogramów na metr sześcienny, temperatura topnienia sto piętnaście stopni Celsjusza, temperatura wrzenia czterysta czterdzieści pięć stopni Celsjusza; wybrane właściwości chemiczne: ma charakterystyczny (nieprzyjemny) zapach, palna (w tlenie spala się niebieskim płomieniem); piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym wykrzyknik; wybrane zastosowania: surowiec do produkcji szeregu związków chemicznych (w tym kwasu siarkowego sześć nazywanego „krwią przemysłu chemicznego”, produkcja zapałek i sztucznych ogni, fungicyd stosowany do ochrony roślin, składnik preparatów stosowanych do leczenia chorób skóry (między innymi leków przeciwtrądzikowych), surowiec wykorzystywany w wulkanizacji gumy. Następny jest przycisk z numerem jedenaście, po jego naciśnięciu pojawia się biała ramka z tekstem: chlor; siedemnaście; wybrane właściwości fizyczne: żółtozielony gaz, gęstość trzy i dwieście czternaście tysięcznych kilograma na metr sześcienny, temperatura topnienia minus sto dwa stopnie Celsjusza, temperatura wrzenia minus sto trzydzieści cztery stopnie Celsjusza; wybrane właściwości chemiczne: ma charakterystyczny (nieprzyjemny), duszący zapach, toksyczny, aktywny chemicznie; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym czaszkę i skrzyżowane kości, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym nieżywą rybę, w tle drzewo, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płonący okrąg, pod nim znajduje się pozioma linia, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym butelkę; wybrane zastosowania: uzdatnianie wody, surowiec do otrzymywania szeregi związków chemicznych, produkcja farb, barwników, rozpuszczalników, produkcja tworzyw sztucznych (głównie poli(chlorku winylu) znanego pod skrótem handlowym PCW), bielenie tkanin. Następny jest przycisk z numerem dwanaście, po jego naciśnięciu pojawia się biała ramka z tekstem: potas; dziewiętnaście; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość osiemset pięćdziesiąt sześć kilogramów na metr sześcienny, temperatura topnienia sześćdziesiąt trzy stopnie Celsjusza, temperatura wrzenia siedemset pięćdziesiąt dziewięć stopni Celsjusza, miękki, można go kroić nożem; wybrane właściwości chemiczne: bezwonny, bardzo aktywny chemicznie (powinien być przechowywany bez dostępu powietrza i wilgoci, na przykład pod warstwą nafty); piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień i czarną poziomą linię pod nim, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym dwie probówki, z których wylewa się substancja spadająca na czarną powierzchnię oraz na dłoń; wybrane zastosowania: surowiec w syntezie szeregu związków chemicznych, określanie wieku skał (tak zwane datowanie), po stopieniu – czynnik chłodzący w reaktorach jądrowych. Następny jest przycisk z numerem trzynaście, po jego naciśnięciu pojawia się biała ramka z tekstem: wapń; dwadzieścia; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość tysiąc pięćset pięćdziesiąt kilogramów na metr sześcienny, temperatura topnienia osiemset czterdzieści dwa stopnie Celsjusza, temperatura wrzenia tysiąc czterysta osiemdziesiąt cztery stopnie Celsjusza, miękki, można go kroić nożem; wybrane właściwości chemiczne: bezwonny, palny, aktywny chemicznie (powinien być przechowywany bez dostępu powietrza i wilgoci, na przykład pod warstwą nafty); piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień i czarną poziomą linię pod nim; wybrane zastosowania: środek zabezpieczający przy produkcji niektórych metali i ich stopów, oczyszczanie i osuszanie ropy naftowej, surowiec w syntezie wielu związków chemicznych (w tym wapnia palonego i wapna gaszonego używanych w przemyśle budowlanym. Następny jest przycisk z numerem czternaście, po jego naciśnięciu pojawia się biała ramka z tekstem: żelazo; dwadzieścia sześć; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość siedem tysięcy osiemset siedemdziesiąt cztery kilogramy na metr sześcienny, temperatura topnienia tysiąc pięćset trzydzieści osiem stopni Celsjusza, temperatura wrzenia dwa tysiące osiemset sześćdziesiąt jeden stopni Celsjusza, przyciągane przez magnez; wybrane właściwości chemiczne: bezwonne, podatne na korozję; piktogramy ostrzegawcze: substancja nie jest klasyfikowana jako niebezpieczna według kryteriów GHS (Global Harmonised System – Globalnie Ujednolicony System Klasyfikacji i Oznakowania); wybrane zastosowania: produkcja stopów – między innymi stali i żeliwa, stal – materiał konstrukcyjny w budownictwie, produkcja między innymi części maszyn i urządzeń przemysłowych, blach, karoserii, narzędzi kowalskich i ślusarskich, żeliwo – produkcja między innymi maszyn części pojazdów, pieców, kaloryferów, ogrodzeń. Następny jest przycisk z numerem piętnaście, po jego naciśnięciu pojawia się biała ramka z tekstem: miedź; dwadzieścia dziewięć; wybrane właściwości fizyczne: czerwonobrunatne, połyskujące ciało stałe, gęstość osiem tysięcy dziewięćset sześćdziesiąt kilogramów na metr sześcienny, temperatura topnienia tysiąc osiemdziesiąt pięć stopni Celsjusza, temperatura wrzenia dwa tysiące pięćset sześćdziesiąt dwa stopnie Celsjusza; wybrane właściwości chemiczne: bezwonna, stosunkowo odporna na działanie czynników środowiska; piktogramy ostrzegawcze: substancja nie jest klasyfikowana jako niebezpieczna według kryteriów GHS (Global Harmonised System – Globalnie Ujednolicony System Klasyfikacji i Oznakowania); wybrane zastosowania: produkcja przewodów elektrycznych, produkcja instalacji wodociągowych, meteriał na pokrycia dachowe i piorunochrony, składnik stopów (głównie mosiądzu i brązu) wykorzystywanych do produkcji różnego rodzaju przedmiotów użytkowych. Następny jest przycisk z numerem szesnaście, po jego naciśnięciu pojawia się biała ramka z tekstem: cynk; trzydzieści; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość siedem tysięcy sto czterdzieści kilogramów na metr sześcienny, temperatura topnienia czterysta dwadzieścia stopni Celsjusza, temperatura wrzenia dziewięćset siedem stopni Celsjusza; wybrane właściwości chemiczne: bezwonny, stosunkowo aktywny chemicznie; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień i czarną poziomą linię pod nim, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym nieżywą rybę, w tle drzewo; wybrane zastosowania: ochrona blach (i innych elementów) stalowych przed korozją, składnik stopów (między innymi mosiądzu). Następny jest przycisk z numerem siedemnaście, po jego naciśnięciu pojawia się biała ramka z tekstem: brom; trzydzieści pięć; wybrane właściwości fizyczne: czerwonobrunatna ciecz, gęstość trzy tysiące sto dwadzieścia kilogramów na metr sześcienny, temperatura topnienia minus siedem stopni Celsjusza, temperatura wrzenia pięćdziesiąt dziewięć stopni Celsjusza; wybrane właściwości chemiczne: ma charakterystyczny (nieprzyjemny) drażniący zapach, o stosunkowo dużej aktywności chemicznej, toksyczny; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym czaszkę i skrzyżowane kości, biały romb z czerwonym obramowaniem i czarnym obrazkiem dwie probówki, z których wylewa się substancja spadająca na czarną powierzchnię oraz na dłoń, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym nieżywą rybę, w tle drzewo; wybrane zastosowania: surowiec do produkcji szeregu związków chemicznych, produkcja farb, dezynfekcja wody w basenach. Następny jest przycisk z numerem osiemnaście, po jego naciśnięciu pojawia się biała ramka z tekstem: srebro; czterdzieści siedem; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość dziesięć tysięcy czterysta dziewięćdziesiąt kilogramów na metr sześcienny, temperatura topnienia dziewięćset sześćdziesiąt dwa stopnie Celsjusza, temperatura wrzenia dwa tysiące sto sześćdziesiąt dwa stopnie Celsjusza; wybrane właściwości chemiczne: bezwonne, stosunkowo odporne na działanie czynników środowiska, toksyczny; piktogramy ostrzegawcze: substancja nie jest klasyfikowana jako niebezpieczna według kryteriów GHS (Global Harmonised System – Globalnie Ujednolicony System Klasyfikacji i Oznakowania); wybrane zastosowania: zabezpieczanie przedmiotów wykonanych ze stali przed korozją (na przykład puszek do konserw), składnik stopu do lutowania). Następny jest przycisk z numerem dziewiętnaście, po jego naciśnięciu pojawia się biała ramka z tekstem: cyna; pięćdziesiąt; wybrane właściwości fizyczne: cyna biała (odmiana alotropowa cyny) – srebrzystobiałe, połyskujące ciało stałe, gęstość siedem tysięcy trzysta dziesięć kilogramów na metr sześcienny, temperatura topnienia dwieście trzydzieści dwa stopnie Celsjusza, temperatura wrzenia dwa tysiące sześćset dwa stopnie Celsjusza; wybrane właściwości chemiczne: bezwonne, reaguje z tlenem w podwyższonej temperaturze; piktogramy ostrzegawcze: substancja nie jest klasyfikowana jako niebezpieczna według kryteriów GHS (Global Harmonised System – Globalnie Ujednolicony System Klasyfikacji i Oznakowania); wybrane zastosowania: wyroby jubilerskie, produkcja między innymi luster, naczyń, sztućców, instrumentów muzycznych, produkcja sprzętu elektrycznego i elektronicznego, ogniw fotowoltaicznych. Następny jest przycisk z numerem dwadzieścia, po jego naciśnięciu pojawia się biała ramka z tekstem: jod; pięćdziesiąt trzy; wybrane właściwości fizyczne: szaroczarne, połyskujące ciało stałe, gęstość cztery tysiące dziewięćset czterdzieści dziewięć kilogramów na metr sześcienny, temperatura topnienia sto czternaście stopni Celsjusza, temperatura wrzenia sto osiemdziesiąt cztery stopnie Celsjusza; wybrane właściwości chemiczne: ma charakterystyczny (nieprzyjemny) drażniący zapach, o stosunkowo dużej aktywności chemicznej, w czystej postaci toksyczny; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym wykrzyknik, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym nieżywą rybę, w tle drzewo; wybrane zastosowania: środek dezynfekujący (jodyna – roztwór jodu w etanolu), leczenie i profilaktyka chorób. Następny jest przycisk z numerem dwadzieścia jeden, po jego naciśnięciu pojawia się biała ramka z tekstem: bar; pięćdziesiąt sześć; wybrane właściwości fizyczne: srebrzystoszare, połyskujące ciało stałe, gęstość trzy tysiące pięćset dziesięć kilogramów na metr sześcienny, temperatura topnienia siedemset trzydzieści stopni Celsjusza, temperatura wrzenia tysiąc osiemset siedemdziesiąt stopni Celsjusza; wybrane właściwości chemiczne: bezwonny, palny, aktywny chemicznie (powinien być przechowywany bez dostępu powietrza i wilgoci, na przykład pod warstwą nafty); piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym płomień z poziomą linią poniżej, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym wykrzyknik; wybrane zastosowania: dodatek do stopów ołowiu, zwiększający ich twardość, pochłaniacz gazów w lampach próżniowych. Następny jest przycisk z numerem dwadzieścia dwa, po jego naciśnięciu pojawia się biała ramka z tekstem: złoto; siedemdziesiąt dziewięć; wybrane właściwości fizyczne: żółte, połyskujące ciało stałe, gęstość dziewiętnaście tysięcy trzysta kilogramów na metr sześcienny, temperatura topnienia tysiąc sześćdziesiąt cztery stopnie Celsjusza, temperatura wrzenia dwa tysiące osiemset pięćdziesiąt sześć stopni Celsjusza; wybrane właściwości chemiczne: bezwonne, odporne na działania czynników środowiska; piktogramy ostrzegawcze: substancja nie jest klasyfikowana jako niebezpieczna według kryteriów GHS (Global Harmonised System – Globalnie Ujednolicony System Klasyfikacji i Oznakowania); wybrane zastosowania: wyroby jubilerskie, produkcja nici do haftowania, pokrycia ochronne w sztucznych satelitach, pokrycia złącz elektrycznych (na przykład złącz kabli USB), dodatek do jedzenia (E sto siedemdziesiąt pięć). Następny jest przycisk z numerem dwadzieścia trzy, po jego naciśnięciu pojawia się biała ramka z tekstem: rtęć; osiemdziesiąt; wybrane właściwości fizyczne: srebrzystobiała, połyskująca ciecz, gęstość trzynaście tysięcy pięćset trzydzieści cztery kilogramy na metr sześcienny, temperatura topnienia minus trzydzieści dziewięć stopni Celsjusza, temperatura wrzenia trzysta pięćdziesiąt siedem stopni Celsjusza; wybrane właściwości chemiczne: bezwonna, toksyczna; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym czaszkę i skrzyżowane kości, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym pęknięte popiersie człowieka, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym nieżywą rybę, w tle drzewo; wybrane zastosowania: lampy rtęciowe (światło nadfioletowe), wydobywanie złota i srebra, produkcja amalgamatów wykorzystywanych między innymi do wykonywania plomb dentystycznych, wypełnienie termometrów, manometrów i barometrów. Następny jest przycisk z numerem dwadzieścia cztery, po jego naciśnięciu pojawia się biała ramka z tekstem: ołów; osiemdziesiąt dwa; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość jedenaście tysięcy trzysta czterdzieści kilogramów na metr sześcienny, temperatura topnienia trzysta dwadzieścia siedem stopni Celsjusza, temperatura wrzenia tysiąc siedemset czterdzieści dziewięć stopni Celsjusza; wybrane właściwości chemiczne: bezwonny, o stosunkowo małej aktywności chemicznej, toksyczny; piktogramy ostrzegawcze: biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym wykrzyknik, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym pęknięte popiersie człowieka, biały romb z czerwonym obramowaniem i czarnym obrazkiem przedstawiającym nieżywą rybę, w tle drzewo; wybrane zastosowania: baterie kwasowo–ołowiowe (akumulatory samochodowe), budowa aparatury chemicznej odpornej na działanie niektórych kwasów, osłona pocisków karabinowych, produkcja wypełnień fartuchów ochronnych do RTG. Następny jest przycisk z numerem dwadzieścia pięć, po jego naciśnięciu pojawia się biała ramka z tekstem: polon; osiemdziesiąt cztery; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość dziewięć tysięcy sto dziewięćdziesiąt sześć kilogramów na metr sześcienny, temperatura topnienia dwieście pięćdziesiąt pięć stopni Celsjusza, temperatura wrzenia dwieście sześćdziesiąt dwa stopnie Celsjusza; wybrane właściwości chemiczne: bezwonny, o stosunkowo małej aktywności chemicznej, toksyczny; piktogramy ostrzegawcze: żółty trójkąt z czarnym obramowaniem i czarnym obrazkiem w środku ukazującym symbol promieniowania; wybrane zastosowania: badania naukowe, źródła ciepła i elektryczności w satelitach. Następny jest przycisk z numerem dwadzieścia sześć, po jego naciśnięciu pojawia się biała ramka z tekstem: rad; osiemdziesiąt osiem; wybrane właściwości fizyczne: srebrzystobiałe, połyskujące ciało stałe, gęstość pięć tysięcy kilogramów na metr sześcienny, temperatura topnienia siedemset stopni Celsjusza, temperatura wrzenia tysiąc siedemset trzydzieści siedem stopni Celsjusza; wybrane właściwości chemiczne: bezwonny, stosunkowo aktywny chemicznie, toksyczny; piktogramy ostrzegawcze: żółty trójkąt z czarnym obramowaniem i czarnym obrazkiem w środku ukazującym symbol promieniowania; wybrane zastosowania: badania naukowe. Kolejny dział nazwany jest: Gazy. Po jego wybraniu pojawia się grafika przedstawiająca układ okresowy pierwiastków chemicznych podobny do poprzedniego, jednak gazy szlachetne, wodór, azot, tlen, fluor i chlor oznaczono kolorem zielonym. W górnej części grafiki znajduje się przycisk z numerem jeden, po jego naciśnięciu pojawia się tekst: Kolorem zielonym wyszczególniono te pierwiastki, które w temperaturze pokojowej i pod ciśnieniem atmosferycznym występują w postaci gazowej. Następnie przy wybranych pierwiastkach znajdują się ponumerowane od dwóch do pięciu przyciski. Pierwszym z nich jest wodór, z numerem dwa, po jego naciśnięciu pojawia się biała ramka z tekstem: wodór; jeden; wodór jest bezbarwnym gazem (zamieszczono zdjęcie podłużne zamknięte naczynie z bezbarwnym gazem). W lampie wyładowczej czysty wodór świeci podobnie do gazów szlachetnych (zamieszczono zdjęcie przedstawiające lampę wyładowczą świecącą się na jasnofioletowy kolor). Następny jest przycisk z numerem trzy, po jego naciśnięciu pojawia się biała ramka z tekstem: azot; siedem; azot jest bezbarwnym gazem (zamieszczono zdjęcie przedstawiające lampę wyładowczą z bezbarwnym gazem). Poniżej temperatury minus sto dziewięćdziesiąt sześć stopni Celsjusza występuje w ciekłym stanie skupienia (zamieszczono zdjęcie ukazujące bezbarwną ciecz wylewającą się z naczynia). Następny jest przycisk z numerem cztery, po jego naciśnięciu pojawia się biała ramka z tekstem: tlen; osiem; tlen w temperaturze pokojowej jest bezbarwnym gazem. Poniżej temperatury topnienia występuje w formie jasnoniebieskiej cieczy (zamieszczono zdjęcie ukazujące zlewkę zakrytą folią aluminiową, w której znajduje się jasnoniebieski płyn). Ostatni jest przycisk z numerem pięć, po jego naciśnięciu pojawia się biała ramka z tekstem: chlor; siedemnaście; chlor jest zielonożółtym gazem (zamieszczono zdjęcie ukazujące podłużne, zamknięte naczynie zawierające jasnożółty płyn). Kolejny dział nazwany jest: Ciecze. Po jego wybraniu pojawia się grafika przedstawiająca układ okresowy pierwiastków chemicznych podobny do pierwszego, jednak brom i rtęć oznaczono kolorem zielonym. W górnej części grafiki znajduje się przycisk z numerem jeden, po jego naciśnięciu pojawia się tekst: Kolorem zielonym wyszczególniono te pierwiastki, które w temperaturze pokojowej i pod ciśnieniem atmosferycznym występują w postaci cieczy. Następnie przy wybranych pierwiastkach znajdują się ponumerowane od dwóch do trzech przyciski. Pierwszym z nich jest brom, z numerem dwa, po jego naciśnięciu pojawia się biała ramka z tekstem: brom; trzydzieści pięć; brom jest jedynym niemetalem, który w temperaturze pokojowej występuje w ciekłym stanie skupienia (zamieszczono zdjęcie ukazujące probówkę, z ciemnoczerwoną cieczą). Następny jest przycisk z numerem trzy, po jego naciśnięciu pojawia się biała ramka z tekstem: rtęć; osiemdziesiąt; rtęć jest jedynym metalem, który w temperaturze pokojowej występuje w ciekłym stanie skupienia (zamieszczono zdjęcie ukazujące podłużne, zamknięte szklane naczynie, w którym znajduje się srebrna, metaliczna ciecz). Ostatni dział nazwany jest: Ciała stałe. Po jego wybraniu pojawia się grafika przedstawiająca układ okresowy pierwiastków chemicznych podobny do pierwszego, jednak większość pierwiastków oznaczono kolorem zielonym. Wyjątkami są: wodór, gazy szlachetne, azot, tlen, fluor, chlor, brom, rtęć, rutherford, dubn, seaborg, bohr, has i pierwiastki nieokreślone. W górnej części grafiki znajduje się przycisk z numerem jeden, po jego naciśnięciu pojawia się tekst: Kolorem zielonym wyszczególniono te pierwiastki, które w temperaturze pokojowej i pod ciśnieniem atmosferycznym występują w postaci ciał stałych. Dla niektórych z nich przedstawiono również dodatkowe informacje dotyczące wyglądu tych pierwiastków. Następnie przy wybranych pierwiastkach znajdują się ponumerowane od dwóch do dwudziestu jeden przyciski. Pierwszym z nich jest węgiel, z numerem dwa, po jego naciśnięciu pojawia się biała ramka z tekstem: węgiel; sześć; węgiel występuje w formie kilku odmian alotropowych, różniących się właściwościami fizykochemicznymi. Diament, będący jedną z wspomnianych odmian alotropowych tworzy na ogół bezbarwne, twarde kryształy (zamieszczono zdjęcie ukazujące kawałek przezroczystej, błyszczącej skały). Oszlifowane diamenty zwane są brylantami (zamieszczono zdjęcie ukazujące oszlifowany diament). Grafit z kolei występuje w postaci czarnego, połyskującego ciała stałego (zamieszczono zdjęcie ukazujące czarną, połyskującą skałę o nierównej powierzchni). Następny jest przycisk z numerem trzy, po jego naciśnięciu pojawia się biała ramka z tekstem: sód; jedenaście; sód to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące szare trójkątne kawałki o metalicznym połysku). W związku z jego reaktywnością sód należy przechowywać pod warstwą nafty (zamieszczono zdjęcie ukazujące szarofioletową substancję w przezroczystej nafcie). Następny jest przycisk z numerem cztery, po jego naciśnięciu pojawia się biała ramka z tekstem: magnez; dwanaście; magnez to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące żółtoszary kawałek magnezu; jest on pokryty ostrymi wypustkami o nierównej powierzchni). Następny jest przycisk z numerem pięć, po jego naciśnięciu pojawia się biała ramka z tekstem: glin; trzynaście; glin to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące małe, metalicznie połyskujące kawałki metalu). Następny jest przycisk z numerem sześć, po jego naciśnięciu pojawia się biała ramka z tekstem: krzem; czternaście; krzem to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące czarną, metalicznie połyskującą skałę). Następny jest przycisk z numerem siedem, po jego naciśnięciu pojawia się biała ramka z tekstem: fosfor; piętnaście; fosfor występuje w formie kilku odmian alotropowych. Najpopularniejszymi z nich są fosfor czerwony: (zamieszczono zdjęcie ukazujące stosik brunatnoczerwonego proszku). Fosfor biały: (zamieszczono zdjęcie ukazujące mały słoik zakręcony czarną pokrywką, wewnątrz którego znajduje się zanurzony w przezroczystym płynie kawałek fosforu. Wyglądem przypomina on kredę). Oprócz tego występuje jeszcze w postaci fioletowej i czarnej. Następny jest przycisk z numerem osiem, po jego naciśnięciu pojawia się biała ramka z tekstem: siarka; szesnaście; siarka to żółte ciało stałe (zamieszczono zdjęcie ukazujące stos drobnych kawałków żółtej skały). Następny jest przycisk z numerem dziewięć, po jego naciśnięciu pojawia się biała ramka z tekstem: potas; dziewiętnaście; potas to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące cztery prostokątne kawałki szarego, połyskującego metalu). Ze względu na jego wysoką aktywność chemiczną należy przechowywać do na przykład pod naftą. Następny jest przycisk z numerem dziesięć, po jego naciśnięciu pojawia się biała ramka z tekstem: wapń; dwadzieścia; wapń to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące zbliżenie na probówkę, w której znajdują się bryłki szarego, połyskującego metalu o nieregularnych kształtach). Następny jest przycisk z numerem jedenaście, po jego naciśnięciu pojawia się biała ramka z tekstem: żelazo; dwadzieścia sześć; żelazo to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące kawałek szarego, połyskującego metalu o walcowatym kształcie). Następny jest przycisk z numerem dwanaście, po jego naciśnięciu pojawia się biała ramka z tekstem: miedź; dwadzieścia dziewięć; miedź to czerwonobrunatne, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące kawałek brunatnopomarańczowego, połyskującego metalu o nieregularnym kształcie i chropowatej powierzchni). Następny jest przycisk z numerem trzynaście, po jego naciśnięciu pojawia się biała ramka z tekstem: cynk; trzydzieści; cynk to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące kawałek szarego, delikatnie połyskującego metalu o nieregularnym kształcie i gładkiej powierzchni). Następny jest przycisk z numerem czternaście, po jego naciśnięciu pojawia się biała ramka z tekstem: srebro; czterdzieści siedem; srebro to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące kawałek srebrzystego, połyskującego metalu o nieregularnym kształcie i chropowatej powierzchni). Następny jest przycisk z numerem piętnaście, po jego naciśnięciu pojawia się biała ramka z tekstem: cyna; pięćdziesiąt; cyna to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące szalkę, na której znajduje się stosik małych metalicznych kawałków o zaokrąglonym kształcie). Następny jest przycisk z numerem szesnaście, po jego naciśnięciu pojawia się biała ramka z tekstem: jod; pięćdziesiąt trzy; jod to szaroczarne, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące zbliżenie na kolbę okrągłodenną wypełnioną drobnymi ciemnoszarymi kawałkami przypominającymi rozkruszony węgiel). W stanie gazowym jod tworzy fioletowe pary (zamieszczono zdjęcie ukazujące drobne ciemnofioletowe kawałki, z których wydobywają się fioletowe opary). Następny jest przycisk z numerem siedemnaście, po jego naciśnięciu pojawia się biała ramka z tekstem: bar; pięćdziesiąt sześć; bar to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące zbliżenie na kolbę, w której znajduje się bryłka gładkiego, ciemnoszarego metalu). Następny jest przycisk z numerem osiemnaście, po jego naciśnięciu pojawia się biała ramka z tekstem: złoto; siedemdziesiąt dziewięć; złoto to żółte, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące bryłkę zółtopomarańczowego metalu o nieregularnym kształcie i chropowatej powierzchni). Następny jest przycisk z numerem dziewiętnaście, po jego naciśnięciu pojawia się biała ramka z tekstem: ołów; osiemdziesiąt dwa; ołów to srebrzystoszare, połyskujące ciało stałe (zamieszczono zdjęcie ukazujące dwa kawałki szarego, połyskującego metalu o kanciastych kształtach i gładkiej powierzchni). Następny jest przycisk z numerem dwadzieścia, po jego naciśnięciu pojawia się biała ramka z tekstem: polon; osiemdziesiąt cztery (zamieszczono grafikę ukazującą symbol promieniowania); polon został odkryty w tysiąc osiemset dziewięćdziesiątym ósmym roku przez małżeństwo: Marię–Skłodowską Curie i Piotra Curie. Nazwa tego pierwiastka chemicznego pochodzi od łacińskiego słowa Polonia i została mu nadana na sześć Polski, będącej w tamtym czasie pod zaborami. Polon jest silnie radioaktywnym pierwiastkiem chemicznym, który między innymi ze względu na tą właściwość nie znajduje obecnie powszechnego zastosowania. Wykorzystuje się go głównie w badaniach naukowych między innymi jako źródło promieniowania alfa lub (wraz z berylem) jako źródło do otrzymywania neutronów (zamieszczono czarno–białe zdjęcie ukazujące Marię Skłodowską–Curie siedzącą przy stole. Kobieta ubrana jest w luźną sukienkę. Za nią stoi Piotr Curie ubrany w koszulę i marynarkę). Polon był dawniej stosowany również jako źródło ciepła w satelitach i pojazdach kosmicznych. Został także użyty w niehumanitarnym celu. Wraz z berylem stanowił bowiem zapalnik pierwszych dwóch bomb atomowych zrzuconych na Hiroszimę i Nagasaki w tysiąc dziewięćset czterdziestym piątym roku. Nawet niewielkie ilości polonu są dla ludzi silnie toksyczne. Śmiertelna dawka polonu dla dorosłego człowieka to jeden mikrogram, czyli jedna milionowa grama. Siódmego listopada tysiąc dziewięćset jedenastego roku, Maria Skłodowska–Curie już jako wdowa, otrzymała Nagrodę Nobla z chemii za odkrycie radu i polonu oraz za badania nad promieniotwórczością. Ostatni jest przycisk z numerem dwadzieścia jeden, po jego naciśnięciu pojawia się biała ramka z tekstem: rad; osiemdziesiąt osiem; rad został odkryty w tysiąc osiemset dziewięćdziesiątym ósmym roku przez małżeństwo: Marię Skłodowską–Curie i Piotra Curie. Nazwa tego pierwiastka chemicznego pochodzi od łacińskiego słowa radius, czyli promień. Rad jest silnie radioaktywnym pierwiastkiem chemicznym. Związki chemiczne radu (chlorek radu oraz węglan radu) używane były dawniej między innymi w radioterapii oraz do produkcji farb luminescencyjnych (wykorzystywanych na przykład do pokrywania tarcz „świecących” zegarków). Okazało się jednak, że ze względu na wspomniane właściwości radioaktywne, rad powoduje u ludzie białaczkę. Dlatego też ograniczono jego zastosowanie i obecnie wykorzystuje się go między innymi w badaniach naukowych. Siódmego listopada tysiąc dziewięćset jedenastego roku, Maria Skłodowska–Curie już jako wdowa, otrzymała Nagrodę Nobla z chemii za odkrycie radu i polonu oraz za badania nad promieniotwórczością (zamieszczono grafikę ukazującą symbol promieniowania).
Po przeprowadzeniu badań w wirtualnym laboratorium oraz po analizie tekstu zawartego w tym materiale, można stwierdzić, że nie da się wskazać jednoznacznie właściwości fizykochemicznych, które byłyby charakterystyczne dla wszystkich niemetali jednocześnie.
Stąd do definiowania niemetali używa się często definicji metali. Jak już wspomniano, metale to pierwiastki chemiczne, które charakteryzują się dobrym przewodnictwem cieplnym i elektrycznym, kowalnością i połyskiem. Jeżeli badana substancja prosta nie posiada którejkolwiek z wymienionych właściwości definicyjnych metali, zaliczana jest do niemetali. Oznacza to jednocześnie, że niemetale mogą posiadać niektóre (wybrane) właściwości (cechy) metali.
Analizując dane z zamieszczonej powyżej tabeli można zauważyć, że niemetalem, który posiada najwięcej wspólnych cech (właściwości) z metalami, jest węgiel, a konkretnie jego odmiana alotropowa – grafit. Podobnie jak metale, przewodzi ciepło i prąd elektryczny, ma także charakterystyczny (metaliczny) połysk. Grafit nie jest jednak kowalny, a więc nie posiada wszystkich czterech cech definicyjnych metali jednocześnie. Dlatego zgodnie z powyższym, zaliczamy go do niemetali.
Zastosowanie metali
Trudno w dzisiejszych czasach wyobrazić sobie życie bez metali. Określone właściwości tej grupy związków chemicznych wykorzystuje się w różnych gałęziach przemysłu i w różnych dziedzinach życia. Przykładowo, dobre przewodnictwo elektryczne pozwoliło na wykorzystanie niektórych metali do produkcji przewodów elektrycznych. Jednak często zdarza się, że do stworzenia określonego przedmiotu nie używa się tylko jednego, określonego metalu, ale stopu metali.
Stop metali to mieszanina jednorodna, która powstała z połączenia metalu z innym pierwiastkiem, zwykle innym metalem, po ich stopieniu, a następnie schłodzeniu otrzymanej masy. W skład stopu mogą wchodzić nie tylko metale, ale także niemetale (np. węgiel). Jeśli ma być on mieszaniną jednorodną metalu z niemetalem, to wspomniany metal musi stanowić w tej mieszaninie zdecydowaną większość (musi być głównym składnikiem stopu).
W wyniku stapiania odpowiednich metali, można uzyskać materiały o określonych właściwościach – innych niż czyste metale. Najczęściej stopy metali produkuje się w celu otrzymania materiałów o zwiększonej wytrzymałości.
W poniższej galerii zamieszczono zdjęcia przedmiotów wykonanych z odpowiednich stopów metali.
Korzystając z dostępnych źródeł informacji (np. encyklopedii, czasopism naukowych lub internetu), sporządź notatkę, w której wymienisz po kilka zastosowań przynajmniej dziesięciu wybranych metali. Notatkę przedstaw w formie mapy myśli, używając w tym celu poniższego generatora (aby to zrobić, kliknij przycisk „edytuj”, który znajduje się w prawym górnym rogu pola mapy myśli).
Korzystając z dostępnych źródeł informacji (np. encyklopedii, czasopism naukowych lub Internetu), sporządź notatkę, w której wymienisz po kilka zastosowań przynajmniej dziesięciu wybranych metali.
Gdzie stosuje się niemetale?
Niemetale, dzięki różnorodnym właściwościom, znalazły wiele zastosowań. Są używane między innymi do produkcji nawozów sztucznych, barwników, leków, środków odkażających, materiałów wybuchowych czy sztucznych ogni. Należące do niemetali gazy szlachetne wykorzystuje się między innymi w technice oświetleniowej do wypełniania neonów. Niemetale, podobnie jak metale, odgrywają znaczącą rolę we właściwym funkcjonowaniu organizmu człowieka, np. fluor bierze udział w procesach tworzenia kości i zębów oraz zapobiega próchnicy.
Korzystając z dostępnych źródeł informacji (np. encyklopedii, czasopism naukowych lub internetu), sporządź notatkę, w której wymienisz po kilka zastosowań przynajmniej dziesięciu wybranych niemetali. Notatkę przedstaw w formie mapy myśli, korzystając z poniższego generatora. W tym celu kliknij ikonkę „edytuj”, która znajduje się w prawym górnym rogu pola generatora.
Korzystając z dostępnych źródeł informacji (np. encyklopedii, czasopism naukowych lub internetu), sporządź notatkę, w której wymienisz po kilka zastosowań przynajmniej dziesięciu wybranych niemetali.
Z jakich niemetali jest zbudowany organizm człowieka?
Organizmy żywe (w tym ciało ludzkie) są zbudowane z różnego rodzaju substancji chemicznych, wśród których większość stanowią substancje złożone, a więc związki chemiczne. Mogą one mieć różną budowę. W organizmie istnieją w postaci cząsteczek lub jonów. Niezależnie od budowy, utworzone są w zdecydowanej większości ze wspomnianych czterech pierwiastków chemicznych: węgla, wodoru, tlenu oraz azotu. Wymienione pierwiastki zaliczane są do niemetali i stanowią około masy wszystkich substancji wchodzących w skład organizmu człowieka.
Niektóre związki chemiczne, które znajdują się w ludzkim organizmie, zbudowane są również z innych niemetali. Wśród nich należy wymienić fosfor oraz siarkę.
Na poniższej grafice zilustrowano przybliżoną procentową zawartość niemetali (w procentach masowych), występujących w organizmie człowieka w postaci odpowiednich związków chemicznych.
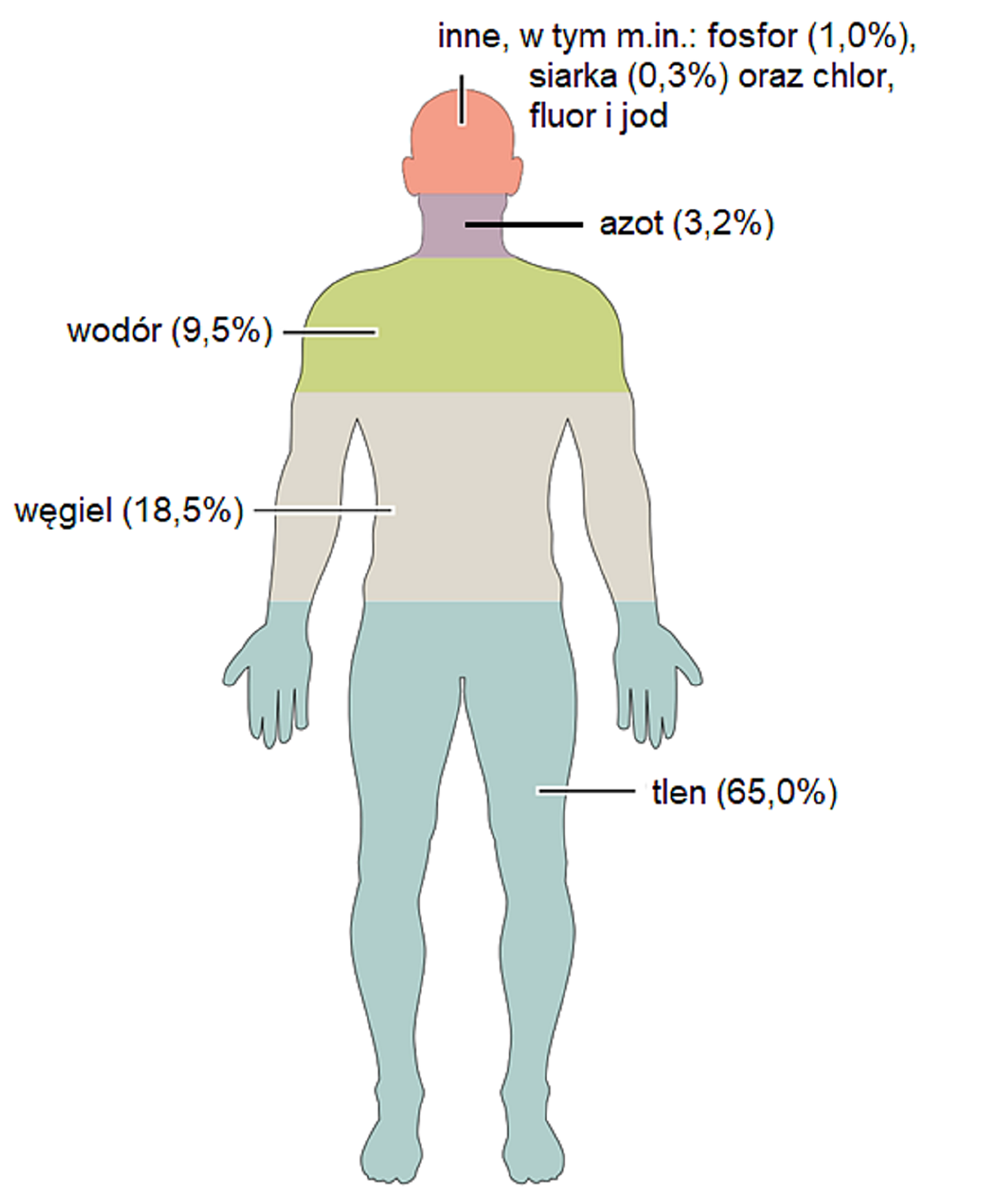
Uwaga: Pod hasłem „inne”, oprócz wymienionych na grafice niemetali, znajdują się również metale (między innymi wapń, potas, sód i magnez)
Oblicz masy poszczególnych niemetali (węgla, tlenu, wodoru, azotu, fosforu oraz siarki), które w postaci różnego rodzaju związków chemicznych wchodzą w skład organizmu człowieka o masie . Wyniki podaj w kilogramach (nie zaokrąglaj ich).
Analizowane pierwiastki chemiczne, a dokładnie substancje chemiczne, w skład których te pierwiastki wchodzą, spełniają wiele różnych funkcji w organizmie. Niektóre z nich, dla wybranych związków chemicznych, wymieniono na poniższym schemacie.
Podsumowanie

Pierwiastki chemiczne dzielimy na metale i niemetale.
Każdy metal (w temperaturze pokojowej) charakteryzuje się jednocześnie czterema właściwościami: dobrym przewodnictwem cieplnym i elektrycznym, kowalnością i metalicznym połyskiem.
Metale mają w temperaturze pokojowej stały stan skupienia (jedynym wyjątkiem jest ciekła rtęć).
Większość metali ma srebrzystoszare zabarwienie (wyjątki: żółte złoto i rudobrązowa miedź).
Niemetale nie mają wspólnych właściwości, za pomocą których można je zdefiniować, dlatego do niemetali zaliczamy te pierwiastki, które nie spełniaja definicji metali.
Niemetale:
występują we wszystkich stanach skupienia;
mają różne barwy;
mogą mieć charakterystyczne zapachy;
mają różny zakres temperatur wrzenia i topnienia;
zazwyczaj są złymi przewodnikami prądu elektrycznego oraz złymi przewodnikami ciepła
węgiel w postaci grafitu i grafenu oraz fosfor czarny, mimo że są niemetalami, przewodzą prąd elektryczny oraz ciepło;
diament przewodzi ciepło;
w większości, w temperaturze pokojowej, występują w stałym stanie skupienia.
Słownik
pierwiastki chemiczne, które w odróżnieniu od metali źle przewodzą prąd elektryczny (z wyjątkiem grafitu, grafenu i fosforu czarnego) i ciepło (z wyjątkiem diamentu, grafitu i fosforu czarnego); w stanie stałym są na ogół kruche, bez metalicznego połysku (z wyjątkiem jodu, krzemu, grafitu); w uproszczeniu – pierwiastki chemiczne, które nie posiadają jednocześnie wszystkich czterech cech (właściwości) definicyjnych metali: dobrego przewodnictwa prądu i ciepła, połysku metalicznego i kowalności; brak którejkolwiek z wymienionych (czterech) właściwości pozwala na zaklasyfikowanie badanej substancji prostej do niemetali
(gr. métallon –kopalnia, kruszec) substancje proste (pierwiastki chemiczne), które charakteryzują się dobrym przewodnictwem cieplnym i elektrycznym, są kowalne i mają charakterystyczny połysk; wymienione właściwości wynikają z obecnego w metalach wiązania metalicznego
(gr. állos –obcy, inny, trópos–sposób, postać) występowanie tego samego pierwiastka chemicznego w dwóch lub więcej odmianach różniących się budową krystaliczną (sposobem połączenia atomów w strukturze krystalicznej) lub liczbą atomów pierwiastka w cząsteczkach; do niemetali występujących w różnych odmianach alotropowych należą między innymi węgiel (grafit, diament, fulereny, grafen), fosfor (fosfor czerwony, fosfor biały, fosfor czarny) oraz tlen (ditlen – , ozon – , tetratlen – )
podatność metali na zmianę kształtu pod wpływem kucia; kowalność materiału określa się zwykle na drodze odpowiednich prób technologicznych; „domowym” sposobem można zbadać kowalność materiału, umieszczając jego próbkę na kowadle i uderzając w nią młotkiem
temperatura () i ciśnienie ()
pierwiastki chemiczne niezbędne do życia i prawidłowego funkcjonowania organizmu, występujące w organizmie w ilościach od jego suchej masy; makroelementami wśród niemetali są m.in.: węgiel, tlen, azot, wodór oraz siarka
pierwiastki chemiczne niezbędne do życia i prawidłowego funkcjonowania organizmu, występujące w organizmie w bardzo małych (śladowych) ilościach; mikroelementami wśród niemetali są m.in.: bor, jod, fluor
































