Mapa pojęć
Czy znasz jakiś związek arsenu? Przeanalizuj mapę i zapoznaj się ze związkami nieorganicznymi oraz organicznymi arsenu, a następnie wykonaj zadania.
- Nazwa kategorii: Arsen
- Nazwa kategorii: związki organiczne
- Nazwa kategorii: adamsyt
- Nazwa kategorii: difenylochloroarsyna
- Nazwa kategorii: luizyt
- Nazwa kategorii: arsenicyna A
- Nazwa kategorii: acetarsol Koniec elementów należących do kategorii związki organiczne
- Nazwa kategorii: związki nieorganiczne
- Nazwa kategorii: urypigment (As[subscript]2[/]S[subscript]3[/])
- Nazwa kategorii: lelingit (FeAs[subscript]2[/])
- Nazwa kategorii: arsenopiryt (FeAsS)
- Nazwa kategorii: realgar (As[subscript]2[/]S[subscript]2[/])
- Nazwa kategorii: kobaltyn (CoAsS)
- Nazwa kategorii: enargit (Cu[subscript]3[/]AsS[subscript]4[/])
- Nazwa kategorii: prustyt (Ag[subscript]3[/]AsS[subscript]3[/]) Koniec elementów należących do kategorii związki nieorganiczne
- Nazwa kategorii: odmiany alotropowe
- Nazwa kategorii: arsen-α (heksagonalny), szary półmetal; połysk metaliczny; kruchy; przewodnik prądu elektrycznego; na powietrzu matowieje; reaguje z wodą (intensywnie) i kwasem azotowym
- Nazwa kategorii: arsen-β (bezpostaciowy), czarny; reaguje z kwasem azotowym i wodą królewską
- Nazwa kategorii: arsen-γ (regularny), żółty, przezroczysty, trwały w niskich temperaturach Koniec elementów należących do kategorii odmiany alotropowe
- Elementy należące do kategorii Arsen
- Elementy należące do kategorii związki organiczne
- Elementy należące do kategorii związki nieorganiczne
- Elementy należące do kategorii odmiany alotropowe
-
Arsen
-
związki organiczne
-
adamsyt
-
difenylochloroarsyna
-
luizyt
-
arsenicyna A
-
acetarsol
-
-
związki nieorganiczne
-
urypigment (As[subscript]2[/]S[subscript]3[/])
-
lelingit (FeAs[subscript]2[/])
-
arsenopiryt (FeAsS)
-
realgar (As[subscript]2[/]S[subscript]2[/])
-
kobaltyn (CoAsS)
-
enargit (Cu[subscript]3[/]AsS[subscript]4[/])
-
prustyt (Ag[subscript]3[/]AsS[subscript]3[/])
-
-
odmiany alotropowe
-
arsen-α (heksagonalny), szary półmetal; połysk metaliczny; kruchy; przewodnik prądu elektrycznego; na powietrzu matowieje; reaguje z wodą (intensywnie) i kwasem azotowym
-
arsen-β (bezpostaciowy), czarny; reaguje z kwasem azotowym i wodą królewską
-
arsen-γ (regularny), żółty, przezroczysty, trwały w niskich temperaturach
-
-
Określ liczbę neutronów, protonów i elektronów jonu .
Liczba neutronów: ............
Liczba protonów: ............
Liczba elektronów: ............
Na zdjęciu umieszczono butelkę z roztworem pewnego związku arsenu. Podaj wzór sumaryczny oraz nazwę Stocka dla tego związku.
Zapoznaj się z opisem zdjęcia, na którym umieszczono butelkę z roztworem pewnego związku arsenu. Podaj wzór sumaryczny oraz nazwę Stocka dla tego związku.

Wybierz, który ze związków arsenu jest przedstawiony na poniższym modelu cząsteczki.
Wybierz, który ze związków arsenu jest opisany na ilustracji przedstawiającej model cząsteczki.
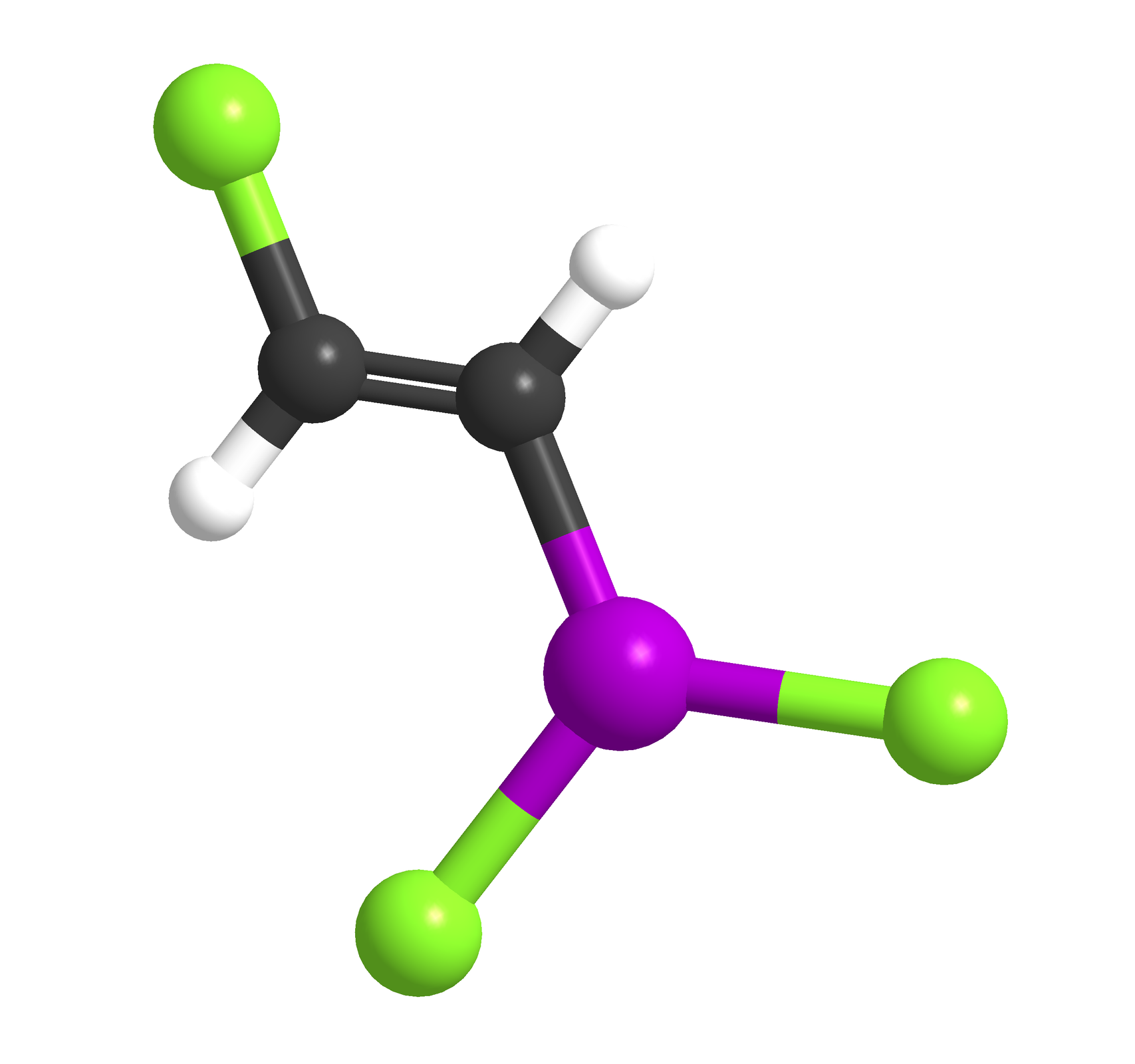
- 2-chlorowinylodichloroarsyny
- Cl-CH=CH-AsCl2
- luizyt A
- wszystkie odpowiedzi są prawidłowe
Który ze związków arsenu jest przedstawiony na poniższym modelu cząsteczki?
- 2-chlorowinylodichloroarsyny
- Cl-CH=CH-AsCl2
- luizyt A
- wszystkie odpowiedzi są prawidłowe