Prawo zachowania masy i stałości składu
Nic w przyrodzie nie ginie
– to powiedzenie dotyczy podstawowej zasady rządzącej przemianami w naszym świecie. Jego zasadność poparto wynikami wielu obserwacji i eksperymentów na długo przed tym, zanim ludzie dowiedzieli się o istnieniu atomów i o sposobach ich łączenia. W tym module poznasz treść fundamentalnych praw, których sformułowanie przyczyniło się do rozwoju nauk przyrodniczych.
że reakcje chemiczne to przemiany, podczas których powstają nowe substancje;
że równanie reakcji chemicznej to zapis przebiegu przemiany chemicznej za pomocą symboli pierwiastków i wzorów związków chemicznych;
że substraty to substancje biorące udział w reakcji chemicznej, a produkty to substancje otrzymane w jej wyniku;
jak określić stosunek masowy w związku chemicznym na podstawie jego wzoru.
definiować prawo zachowania masy oraz prawo stałości składu;
interpretować prawo stałości składu;
stosować w obliczeniach chemicznych prawo zachowania masy i prawo stałości składu.
1. Czy masa substratów zmienia się podczas reakcji chemicznej?
Obserwując przebieg reakcji chemicznych, możemy opisać efekty, które im towarzyszą, na przykład zmianę barwy, efekt dźwiękowy, emisję światła. Czasami możemy także odnieść wrażenie, że substancji biorących udział w reakcji ubywa lub przybywa.


Już w XVIII wieku zajmowano się porównywaniem mas substratów i produktów. Badania te, prowadzone niezależnie przez dwóch chemików, Rosjanina Michaiła ŁomonosowaMichaiła Łomonosowa (1756) i Francuza Antoine’a LavoisieraAntoine’a Lavoisiera (czyt. antła lawłaziera)(1785), doprowadziły do sformułowania ogólnego prawa przyrody, które nazwano prawem zachowania masyprawem zachowania masy. Według tego prawa w układzie zamkniętym (w którym produkty reakcji nie opuszczają tego układu) łączna masa substratów jest równa sumie mas produktów. Oznacza to, że z tej samej masy substratów powstaje taka sama masa produktów, czyli że podczas przemiany chemicznej masa substancji w nich uczestniczących nie ulega zmianie.
Konieczność uzgadniania (bilansowania) równań reakcji jest właśnie konsekwencją przestrzegania prawa zachowania masy. Aby suma mas substratów była identyczna z łączną masą produktów, liczby atomów tego samego rodzaju po obu stronach równania reakcji muszą być jednakowe.
Czy masa produktów jest większa, mniejsza, czy taka sama jak masa substratów, z których powstały?
Masa produktów jest identyczna z masą użytych substratów.
waga analityczna,
soda oczyszczona,
ocet,
mała kolba miarowa,
balonik,
łyżeczka.
Do balonika wsyp 2–3 łyżeczki sody oczyszczonej.
Do kolby miarowej nalej 20–30 cmIndeks górny 33 octu.
Załóż balonik na szyjkę kolby. Uważaj przy tym, aby soda nie dostała się do wnętrza kolby.
Postaw zestaw na wadze analitycznej.
Gdy masa kolby na wadze ustali się, podnieś balonik i wsyp sodę do octu.
Obserwuj wskazania wagi.
Po wsypaniu sody do octu reakcja przebiegała gwałtownie. Objętość mieszaniny reakcyjnej wzrosła. Masa układu reakcyjnego nie uległa zmianie.
Przeprowadzone doświadczenie potwierdza prawo zachowania masy. W czasie trwania przemiany masa substancji bioracych udział w reakcji chemicznej nie ulega zmianie.

Film dostępny na portalu epodreczniki.pl
Film rozpoczyna się ujęciem stołu laboratoryjnego zawierającego substancje i sprzęt niezbędne do przeprowadzenia doświadczenia. Znajduje się tutaj waga cyfrowa, kolbka stożkowa z miarką, łyżeczka, balonik, opakowanie sody spożywczej i butelka octu. Na tym tle wyświetlany jest biały napis Reakcja sody oczyszczonej z octem. W tle sceny widać rozmyte dłonie i fartuch demonstratora. Zmiana ujęcia na prezentujące w zbliżeniu kolejne elementy zestawu. Do kolbki wlewany jest ocet, a do balonika wsypywana soda oczyszczona. Balonik naciągany jest na szyjkę kolby. Cały zestaw ustawiony zostaje na wadze, która wskazuje 119,45 grama. Ręka demonstratora unosi balonik przesypując jego zawartość, czyli sodę do octu. Reakcja jest gwałtowna, wydzielający się gaz i piana napełniają balonik. Nie wpływa to żaden sposób na wskazania wagi. Z lewej strony obrazu wjeżdża na ekran czarna plansza, na której pojawia się napis. Masa reagentów jest stała. Następuje zmiana ujęcia na zbliżenie wskaźnika wagi. Pojawia się kolejny napis: Przebieg reakcji jest zgodny z prawem zachowania masy.
2. Jak można wykorzystać prawo zachowania masy w obliczeniach chemicznych?
Prawo zachowania masy pomaga określić masę jednej substancji, gdy znamy masy pozostałych substratów i produktów. Znajomość tego prawa pozwala także obliczyć między innymi ilość produktów powstających z określonej masy substratów. Na przykład, jeśli wiemy, że przereagowały ze sobą 2,4 g magnezu i 1,6 g tlenu, to w prosty sposób możemy ustalić, że w wyniku tej reakcji chemicznej powstały tlenku magnezu:
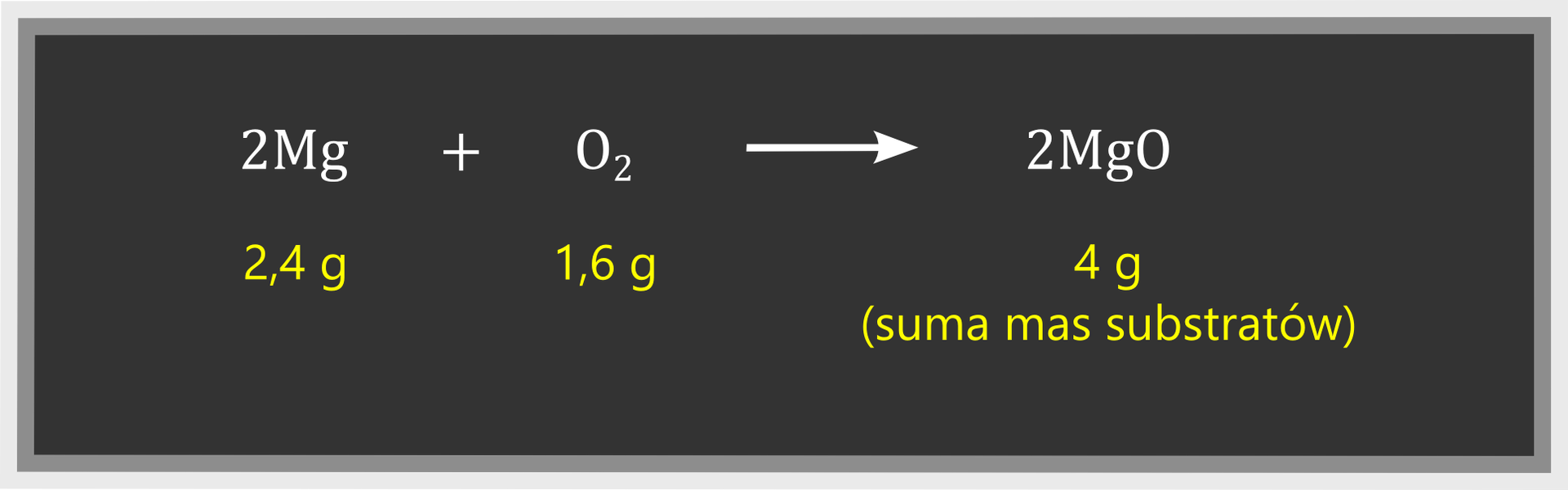
W przypadku innej przemianie – reakcji wymiany tlenku miedzi(II) z węglem – możemy ustalić masę miedzi, jeśli znamy masy substratów i masę drugiego produktu:

Zgodnie z prawem zachowania masy łączna masa substratów ma być równa sumie mas produktów:
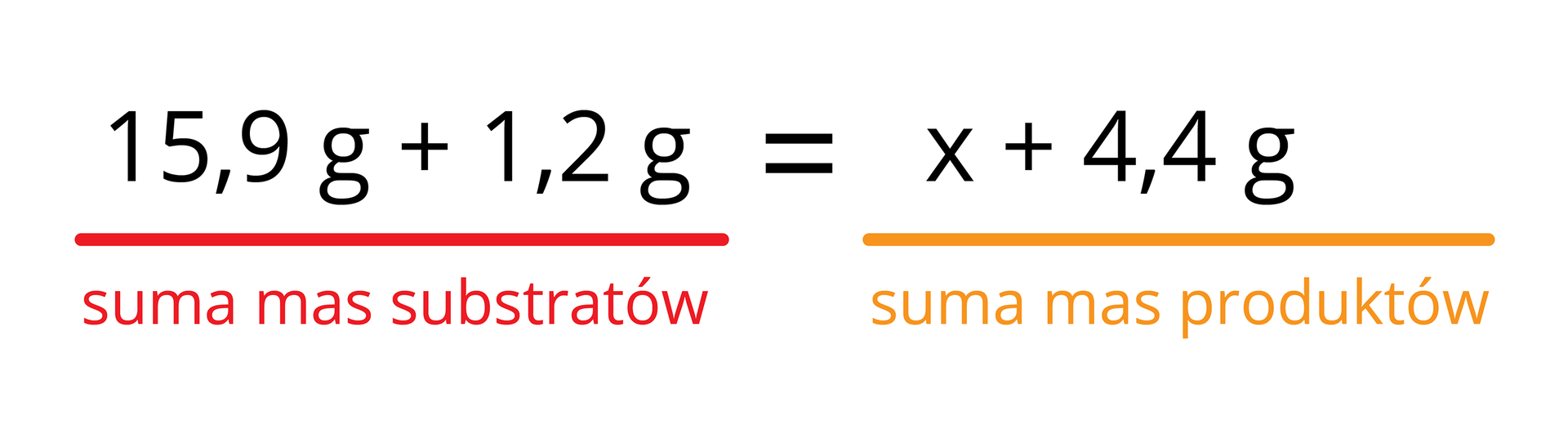
Po przekształceniach równania i wykonaniu obliczeń poznamy masę miedzi:
Dzięki wykorzystaniu prawa zachowania masy możemy stwierdzić, że w wyniku reakcji 15,9 g tlenku miedzi(II) z 1,2 g węgla powstanie 12,7 g miedzi.
Przeprowadzono doświadczenie, w którym do wody wprowadzono chlorowodór, a następnie wrzucono magnez w postaci wiórków. Zaobserwowano wydzielenie się gazu, którym był wodór. Podczas doświadczenia przereagowało ze sobą 2,4 g magnezu i 7,3 g kwasu solnego. Produktami tej przemiany były wodór i chlorek magnezu. Ustalono masę chlorku magnezu, która wynosiła 9,5 g. Przebieg reakcji opisuje poniższe równanie:

Oblicz masę wodoru powstałego w wyniku tej reakcji oraz określ liczbę cząsteczek tego gazu.
Zestawiamy dane z polecenia:

Na podstawie prawa zachowania masy obliczamy masę wodoru otrzymanego w reakcji:
Określamy liczbę cząsteczek wodoru powstałego w wyniku reakcji.
Obliczamy masę cząsteczkową wodoru, :
Obliczamy masę cząsteczki wodoru wyrażoną w gramach, wiedząc, że:
Ustalamy, ile cząsteczek wodoru znajduje się w masie wodoru z treści zadania (0,2 g). Możemy to zrobić na dwa sposoby przy użyciu proporcji lub wzoru:
RWZjTZrnIhM2b1  Źródło: Krzysztof Jaworski, licencja: CC BY 3.0.
Źródło: Krzysztof Jaworski, licencja: CC BY 3.0.
Udzielamy odpowiedzi:
W wyniku reakcji 2,4 g magnezu z 7,3 g kwasu solnego wydzieliło się 0,2 g wodoru, czyli powstało cząsteczek tego gazu.
3. Czy związki chemiczne mają jednakowy skład?
Pod koniec XVIII wieku francuski chemik Joseph Louis ProustJoseph Louis Proust (czyt. żuzef lłi prust) sformułował prawo odnoszące się do składu związków chemicznych, które nazwano prawem stałości składuprawem stałości składu.
Stosunek mas pierwiastków tworzących związek chemiczny jest stały dla danego związku i nie zależy od miejsca oraz sposobu jego otrzymywania.
Dziś prawo to wydaje się nam oczywiste i mało odkrywcze. Ale musimy pamiętać, że zostało sformułowane w czasach, gdy nie wiedziano nic na temat budowy materii, nieznane były takie pojęcia jak pojęcie atomu czy cząsteczki i nikt nie posługiwał się wzorami chemicznymi związków. Obecnie na podstawie wzoru chemicznego, na przykład wody (), i danych zawartych w układzie okresowym możemy określić stosunek masowy wodoru do tlenu w wodzie ( czyli ), natomiast niecałe 150 lat temu wyciągnięcie takiego wniosku wymagało wielu żmudnych prac doświadczalnych.
Sformułowanie tego prawa miało fundamentalne znaczenie dla dalszego rozwoju chemii. Stało się ono podwaliną pod kolejne badania prowadzące do stworzenia teorii atomistycznej budowy materii.
Bertolidy
Znana jest grupa związków chemicznych, niemających stałego składu ilościowego. Nazywa się je bertolidami – od nazwiska francuskiego chemika Claude’a Louisa Bertholleta (czyt. kloda lłisa bertoleta), który nie zgadzał się z koncepcją stałego składu związku chemicznego. Przykładem bertolidu jest tlenek żelaza(II), będący związkiem jonowym i tworzący kryształy. Jego wzór to . Z powodu defektów sieci krystalicznej występuje w niej niedobór jonów żelaza i rzeczywisty stosunek atomów odpowiada wzorowi .
4. Jak można wykorzystać prawo stałości składu w obliczeniach chemicznych?
Znajomość prawa zachowania masy i prawa stałości składu jest podstawą obliczeń chemicznych. Dzięki nim można ustalić proporcje, w jakich substraty przereagowały ze sobą, tworząc określone produkty, lub oszacować ilość powstałych produktów na podstawie masy użytych substratów.
Stosunek wagowy wodoru do tlenu w cząsteczce wody, , wynosi , co oznacza, że w wodzie na 1 część masową wodoru przypada 8 części masowych tlenu. Niezależnie od tego, jakmi jednostkami masyn będziemy się posługiwać, wymienione zależności zawsze będą takie same. Na przykład, jeśli w danej próbce wody znajduje się 1 g wodoru, to tlenu będzie 8 g, a próbka wody będzie miała masę: . Ten sam stosunek masowy będzie istniał zarówno w jednej cząsteczce wody o masie cząsteczkowej 18 u, jak i w próbkach wody o masie 18 g, 200 kg czy 1 tony.
Stosunek masowy poszczególnych pierwiastków w związku jest zawsze stały – niezależny od masy próbki związku, a także od sposobu otrzymywania tego związku.
Określ, ile kilogramów tlenu znajduje się w 9 kg wody.
Stosunek masowy wodoru do tlenu w wodzie wynosi .

Film dostępny na portalu epodreczniki.pl
Nagranie rozpoczyna się planszą z treścią zadania: Określ rodzaj tlenku siarki, czy jest to tlenek siarki cztery, czy tlenek siarki sześć, jeśli w próbce tlenku o masie 20 gramów znajduje się 8 gramów siarki. Pojawia się podpowiedź, że rozwiązanie zadania wymaga określenia stosunku masowego w badanej próbce i porównania go do stosunków masowych występujących w tlenkach siarki. Proponowana jest też kolejność wykonywania obliczeń: obliczanie masy tlenu w tlenku siarki z treści zadania, określenie stosunku masowego tlenu do siarki, ustalenie stosunków masowych w obu znanych rodzajach tlenków siarki i porównanie ich z tym z treści zadania. Z ekranu znikają wszystkie kroki poza pierwszym, który się powiększa. Obliczenie masy tlenu wymaga prostego działania matematycznego: 20 gramów minus 8 gramów daje 12 gramów tlenu w próbce. Następuje wyliczanie proporcji masy siarki do masy tlenu, która wynosi 8 do 12. Poniżej tego wyniku pojawia się tabela zawierająca szacunki mas tlenu do siarki w obu rodzajach tlenków siarki. Dla tlenku siarki cztery, czyli SO2 jest to 32:32, a dla tlenku siarki sześć, czyli SO3 jest to 32:48. Następuje zmiana planszy na zawierającą tabelę z zestawieniem stosunki masowe wszystkich trzech tlenków SO2, SO3 i nieustalonego tlenku z treści zadania. Aby móc łatwo porównać te wartości, obliczona proporcja 8:12 zostaje obustronnie pomnożona przez 4. Po pomnożeniu wynosi ona 32:48. Podświetlone zostają wiersze tabeli zawierające identyczne proporcje tlenku z treści zadania oraz SO3. Pojawia się odpowiedź: Substancją z treści zadania jest tlenek siarki sześć.
Oblicz masę wody poddanej analizie, jeśli w jej wyniku tej reakcji powstało 10 g wodoru. Podaj masę powstałego tlenu.
Obliczamy stosunek masowy pierwiastków chemicznych w wodzie na podstawie wzoru sumarycznego:
wzór sumaryczny:
stosunek masowy wodoru do tlenu w wodzie: 2 : 16, czyli
Tworzymy wyrażenie opisujące stosunek masowy składników wody z uwzględnieniem danych z polecenia:

Zestawiamy obliczony stosunek masowy składników wody (krok 1.) z utworzonym wyrażeniem (kroku 2.):
Obliczamy masę wody, która uległa rozkładowi:
Udzielamy odpowiedzi:
Reakcji rozkładu poddano 90 g wody. W jej wyniku powstało 80 g tlenu.
Oblicz, ile gramów sodu znajduje się w dziennej maksymalnej dawce soli kuchennej, wynoszącej 6 gramów chlorku sodu.
Obliczamy stosunek masowy pierwiastków w chlorku sodu na podstawie jego wzoru sumarycznego:
wzór sumaryczny:
stosunek masowy sodu do chloru:
Zapisujemy wyrażenie opisujące stosunek masowy składników chlorku sodu z uwzględnieniem danych z polecenia:

Zestawiamy obliczony stosunek masowy składników (krok 1.) z utworzonym wyrażeniem (krok 2.) i obliczamy masę sodu:
Udzielamy odpowiedzi:
W 6 g chlorku sodu znajduje się 2,36 g sodu.
Podsumowanie
Według prawa zachowania masy stwierdza w każdej reakcji chemicznej łączna masa substratów jest równa sumie mas produktów otrzymanych w jej wyniku.
Na podstawie prawa zachowania masy można policzyć masę jednego z substratów lub produktów, jeśli masy pozostałych są znane.
Prawo stałości składu mówi, że stosunek masowy pierwiastków w związku chemicznym jest zawsze stały oraz niezależny od sposobu i miejsca jego otrzymania (każdy związek chemiczny ma niezmienny skład jakościowy i ilościowy).
Znajomość stosunku masowego pierwiastków chemicznych w związku pozwala obliczyć masę pierwiastków chemicznych w określonej masie związku.
Na podstawie stosunku masowego pierwiastków w związku chemicznym można ustalić jego wzór sumaryczny.
Podczas ogrzewania 200 g wapienia powstało 112 g tlenku wapnia. Oblicz, ile gramów tlenku węgla(IV) otrzymano. Zapisz równanie reakcji, jeśli wiadomo, że głównym składnikiem wapienia jest węglan wapnia o wzorze sumarycznym , który podczas prażenia ulega rozkładowi na dwa produkty (tlenek wapnia i tlenek węgla(IV)).
Zastanów się i odpowiedz, o czym trzeba pamiętać, przeprowadzając potwierdzające prawo zachowania masy doświadczenia, podczas którego powstają produkty gazowe.
Słowniczek

Antoine Lavoisier
Francuski chemik, który zapoczątkował rozwój nowożytnej chemii, wprowadzając pomiary ilościowe. Udowodnił, że wszystkie pierwiastki występują w trzech stanach skupienia, wyjaśnił procesy spalania i oddychania, sformułował zasadę zachowania masy w reakcjach chemicznych, wykazał obecność tlenu i azotu w powietrzu, przeprowadził analizę i syntezę wody oraz określił skład wielu substancji, np. tlenku siarki(IV), kwasu siarkowego(VI) i kwasu azotowego(V). Pieniądze na prowadzenie badań chemicznych uzyskiwał, pracując jako poborca podatkowy. Został stracony w czasie rewolucji francuskiej. Na prośbę Lavoisiera o przedłużenie życia w celu dokończenia prowadzonych przez niego prac badawczych sędzia odpowiedział: Rewolucja nie potrzebuje uczonych
. Po śmierci został uniewinniony.

Michaił Łomonosow
Rosyjski chemik, który jako pierwszy odkrył prawo zachowania masy. W 1760 r. opublikował pracę, w której udowadniał to prawo, pisząc między innymi, że jeżeli gdzieś ubędzie nieco materii, to przybędzie w innym miejscu
. Jego rozprawy naukowe nie były powszechnie znane, ponieważ pisał tylko w języku rosyjskim. Oprócz prac w obszarze chemii prowadził też badania z zakresu fizyki i geologii. Był także poetą.
prawo odnoszące się do stosunków masowych w związkach chemicznych, zgodnie z którym stosunek masowy pierwiastków w związku chemicznym jest zawsze stały i niezależny od sposobu oraz miejsca jego otrzymania
reguła, według której mówi w przypadku każdej reakcji chemicznej całkowita masa substratów jest równa łącznej masie produktów

Joseph Louis Proust
Chemik francuski, twórca prawa stałości składu (zwanego także prawem stosunków stałych). Na potwierdzenie swoich tez wykonał badania wielu związków chemicznych (dużo pracy poświęcił węglanowi miedzi(II), który otrzymywał z różnych źródeł oraz rozmaitymi sposobami, wykazując jego niezmienny skład ilościowy). Odkrył nieznane wcześniej związki chemiczne, między innymi glukozę, lecytynę. Za wkład w rozwój wiedzy chemicznej przyznano mu tytuł członka Francuskiej Akademii Nauk w Paryżu.
Zadania
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Podczas reakcji chemicznej z określonej masy substratów zawsze powstaje identyczna masa produktów. | □ | □ |
| Łączna liczba atomów danego pierwiastka w substratach biorących udział w reakcji jest równa łącznej liczbie atomów tego pierwiastka w jej produktach. | □ | □ |
| Jednym z twórców prawa zachowania masy był Joseph Louis Proust. | □ | □ |
| Reakcje przebiegające z wydzieleniem produktu gazowego, który uchodzi z mieszaniny reakcyjnej, nie spełniają prawa zachowania masy. | □ | □ |
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Stosunek masowy pierwiastków w danym związku chemicznym jest cechą charakterystyczną tego związku. | □ | □ |
| Skład procentowy dwutlenku węgla powstałego w wyniku spalania paliw kopalnych i podczas oddychania jest identyczny. | □ | □ |
| Stosunek masowy pierwiastków w witaminie C (kwasie askorbinowym) zawartej w cytrynie różni się od stosunku masowego pierwiastków w kwasie askorbinowym wytworzonym syntetycznie w laboratorium chemicznym. | □ | □ |
| Stosunek masowy pierwiastków w związku chemicznym może zmieniać się w zależności od stanu skupienia tego związku. | □ | □ |
Przeanalizowano budowę cząsteczek tlenu zawartych w powietrzu oraz otrzymanych w wyniku rozkładu wody. Sformułowano następujące wnioski. Oceń, czy są słuszne.
| Prawda | Fałsz | |
| Masa cząsteczkowa tlenu otrzymanego z analizy wody jest mniejsza od masy cząsteczkowej tlenu zawartego w powietrzu. | □ | □ |
| Gdyby do dwóch identycznych naczyń (A, B) wprowadzono jednakową liczbę cząsteczek wody (naczynie A) i cząsteczek tlenku węgla(VI) (naczynie B), to w naczyniu B będzie więcej atomów tlenu niż w naczyniu A. | □ | □ |
| Cząsteczki tlenu otrzymane z rozkładu wody są większe od cząsteczek tlenu obecnych w powietrzu. | □ | □ |
Magnez o masie 24 g połączył się z 32 g siarki w reakcji opisanej równaniem:
Oblicz, ile gramów siarczku magnezu powstało w wyniku tej przemiany. Wskaż właściwą odpowiedź.
- 56 g
- 24 g
- 32 g
- 8 g
- 112 g
W wyniku reakcji 4,8 g magnezu z nieznaną masą tlenu powstało 8,0 g tlenku magnezu. Wskaż prawidłowo ułożone równanie matematyczne, którego rozwiązanie pozwoli obliczyć, ile tlenu przereagowało z magnezem.
- 8 g – 4,8 g
- 8 g + 4,8 g
- 2· 8 g – 4,8 g
- 8 g – 2 · 4,8 g
- 2 · 8 g + 2 · 4,8 g
Oblicz liczbę cząsteczek dwutlenku węgla, jaka powstała w wyniku reakcji 12 g węgla z 32 g tlenu. Wskaż właściwą odpowiedź.
Ile gramów tlenu znajduje się w wodzie, jeśli zawiera ona 6 g wodoru? Wskaż prawidłową odpowiedź.
- 48 g
- 16 g
- 8 g
- 3 g
Oblicz, ile gramów wodoru zawiera próbka wody, w której znajduje się 16 g tlenu. Wskaż właściwą odpowiedź.
- 2 g
- 32 g
- 1 g
- 16 g
- 8 g
Oblicz, jaką masę ma próbka wody, która zawiera 4 g wodoru. Wskaż właściwą odpowiedź.
- 36 g
- 32 g
- 24 g
- 18 g
- 8 g









